骨转化标志物在骨转移瘤中的研究进展
张超 林锋 李丽丽 刘建宇 王国文
作者单位:300060 天津医科大学肿瘤医院骨与软组织肿瘤科、国家肿瘤临床医学研究中心、天津市“肿瘤防治”重点实验室、天津市恶性肿瘤临床医学研究中心 ( 张超、李丽丽、王国文 );300270 天津医科大学临床医学院( 林锋 );065900 河北,廊坊市大城县人民医院骨二科 ( 刘建宇 )
骨转移是恶性肿瘤常见的并发症,常见于乳腺癌、前列腺癌、肺癌、肾癌和甲状腺癌,因骨骼含大量细胞因子,且骨髓腔血供丰富,因此癌细胞更易于向骨骼转移、筑巢和增殖[1]。骨转移的发生常导致患者生活质量的下降和生存周期的缩短,引起骨痛、病理性骨折、脊髓压迫、高钙血症等骨相关事件,大幅降低了患者日常活动能力,并增加其患抑郁、焦虑的风险[2-3]。
骨转移瘤是转移癌细胞与骨微环境细胞相互作用的结果,在一定程度上临床表现为溶骨性或成骨性病变,期间引起相应骨转化标志物 ( bone turnover markers,BTM ) 在体液微环境的表达水平改变。BTM 即一些蛋白酶、骨转移代谢产物或骨基质蛋白,直接或间接参与骨转移发生机制,促进骨转移发生与发展。最新研究表明 BTM 在骨转移的诊治中具有诸多优势:( 1 ) 弥补传统肿瘤标志物对骨转移病灶诊断和评价不全面的不足;( 2 ) BTM 检查操作方便,相对价廉;( 3 ) BTM 表达水平可反映骨骼病变程度,为转移瘤的临床分期提供更多的诊断及预后信息,它可作为一种新的疾病监测指标[3-4]。现聚焦乳腺癌、前列腺癌、肺癌、肾癌和甲状腺癌,结合近 3 年来骨转移瘤的研究成果和最新 BTM 的研究进展做一综述。
一、骨转移发生机制
骨转移包括骨转移机制和骨转化机制,BTM 在骨转移两大机制中都起到了很重要的作用 ( 图1 )。
1. 骨转移机制:根据 Paget 提出的“种子-土壤”学说,骨转移机制可概括为上皮-间质转化、循环和间质-上皮转化 3 个阶段[5]。
上皮间质转化 ( epithelial-mesenchymal transition,EMT ) 初期,癌细胞在多种生长因子、蛋白分子、转录因子的调控下进行,EMT 即癌细胞失去上皮样表型向间充质样表型转变、并获得迁移能力 ( 图2 ):( 1 ) 转化生长因子-β ( transforming growth factor-β,TGF-β ) 通过直接磷酸化、激活 Smad2 / 3 通路,调节黏连蛋白合成 ( 如钙黏蛋白 ( E-cadheren )、PAR6 蛋白 ( Partitioning defective 6 ) 或是影响其它介导 EMT 信号通路 ( 如 Notch、Wnt 通路 );( 2 ) Notch 通过激活 Nuclear Factor-κB ( NF-κB ) 通路以及参与 TGF-β 通路的调节,使癌细胞具有异质性;( 3 ) Wnt通过抑制糖原合酶激酶-3β ( glycogen synthase kinase-3β,GSK3β ) 磷酸化,使胞浆中 β-catenin 降解、转移至细胞核内,作为转录因子亚单位,诱导 EMT 发生;( 4 ) PTKs 引起癌细胞基因突变,导致钙黏蛋白合成减少,β-catenin 释放增加,进而细胞活动度增加;( 5 ) Hedgehog signalling 通路具有维持癌细胞间充质样表型的作用[6]。
同时,癌细胞分泌多种蛋白酶以水解细胞外基质,如基质金属蛋白酶 ( matrix metalloproteinase,MMP ),促使癌细胞局部侵袭并向周围组织迁移[4]。大量分泌的整合素增强癌细胞与内皮细胞间作用,癌细胞表面的淀粉样前体蛋白与血管壁细胞表面死亡受体-6 相互识别并激活,进而促进癌细胞对血管壁的侵袭[7]。此外,既往研究提示,原发灶的缺氧可介导 EMT 发生。
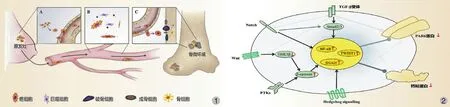
图1 骨转移发生机制 ( A:癌细胞的上皮 - 间质转化阶段;B:CTCs 的循环阶段;C:转移癌细胞间质 - 上皮转化阶段及其与骨微环境细胞相互作用形成骨转移瘤 )图2 上皮 - 间充质转化 ( EMT ) 的信号调节通路模式图Fig.1 The mechanism of bone metastases formation ( A: The epithelial-mesenchymal stage of cancer cells; B: The cycle stage of CTCs; C: The mesenchymal-epithelial stage of cancer cells and its interaction with bone microenvironment cells to form bone metastases. CTCs: circulating tumor cells )Fig.2 The model of signaling networks regulating epithelial-mesenchymal transitions ( EMT )
癌细胞进入体循环后,称之为循环肿瘤细胞 ( circulating tumor cells,CTCs ),并通过自身调节机制适应体液循环的微环境。例如,通过 CTCs 表面的酪氨酸激酶受体过表达,激活 PI3K-AKT 信号通路,进而激活促生存通路;另外,细胞表面的特定蛋白 ( 如 CD47 ) 的过表达,可使CTCs 逃避巨噬细胞的吞噬作用[4]。
合适的血流和血管变化 ( 如血流速度放缓、血管弯曲、血管壁渗漏 ) 及相应的分子信号的表达皆有利于 CTCs由体液循环进入骨靶向迁移。CTCs 常受 CXCL12-CXC-chemokine receptor4 axis 传导通路影响,使其更容易向骨髓迁移,且趋化因子受体 4 ( C-X-C motif chemokine receptor 4,CXCR4 ) 对 CTCs 的存活、基因转录、趋向性、细胞整合素表达都起到重要的调控作用[8]。
此外,癌细胞的骨转移过程还受其它因素的调节。募集的骨髓来源细胞可释放特定的细胞因子,如肿瘤坏死因子-α ( tumor necrosis factor-α,TNF-α )、TGF-β、血管内皮生长因子 ( vascular endothelial growth factor,VEGF ) 和胎盘生长因子,促进癌细胞转移的发生[9];膜联蛋白 II、E-钙黏蛋白、整合素的过表达,皆可增强 CTCs 与骨髓中内皮细胞的亲和力[1]。
2. 骨转化机制:骨转化过程主要由破骨细胞和成骨细胞介导完成。生理状况下,破骨细胞由单核巨噬细胞衍生而来,通过分泌 H+、蛋白酶及其它酶,如抗酒石酸酸性磷酸酶 5b ( tartrate-resistant acid phosphatase type 5b,TRACP-5b ),发挥溶骨性作用。成骨细胞则由间质干细胞分化而来,通过分泌骨碱性磷酸酶 ( bone specific alkaline phosphatase,BALP ),合成 I 型胶原或转化为骨细胞,发挥成骨性作用[10]。CTCs 突破血管内皮后与骨微环境细胞( 包括破骨细胞、成骨细胞、骨细胞、内皮细胞和骨髓细胞 ) 相互作用,从而破坏骨骼单位稳态,打破了原环境中破骨细胞和成骨细胞的平衡,进而出现溶骨性或成骨性病变[11]。
骨微环境细胞也促使成骨细胞和破骨细胞的代谢失衡,进而影响骨转化过程:第一,骨细胞通过陷窝-微管系统相互关联,在一定程度上调控成骨细胞和破骨细胞的表达;第二,骨转移瘤和多发骨髓瘤中的 T 细胞和 B 细胞通过分泌核因子 κb 受体活化因子配体 ( receptor activator for nuclear factor κB-ligand,RANKL ),影响破骨细胞的生成,树突细胞和 IL-6、IL-7、IL-17、IL-23 等可共同促进溶骨性改变;第三,内皮细胞可通过多种途径调控骨转移灶的形成;第四,转移癌细胞本身也可分泌 VEGF 和IL-8 促使内皮细胞局部血管化,帮助转移癌细胞进一步存活;第四,脂肪细胞不仅可以为 CTCs 的激活和活动提供能量,还可以通过分泌前体炎性因子以帮助部分转移癌细胞完成靶向修饰和增殖,进而提高其存活率[4]。此外,近期研究表明:IL-1、巨噬细胞集落刺激因子 ( macrophage colony stimulating factor,M-CSF )、维生素 D 皆可促进溶骨性病变的发生;骨保护素、IL-18、IL-4、干扰素-β、降钙素则抑制溶骨性病变[3]。
由此,经过近 3 年的针对骨转移和骨转化过程的研究,机制研究已逐步深入到各类分子探索,这为 BTM 的研究和应用打下了坚实的基础。
二、具有预测潜能的 BTM ( 表1 )
1. 乳腺癌中具有预测潜能的 BTM:乳腺癌是最常见的恶性肿瘤之一,晚期乳腺癌骨转移发生率高达 70%,常发生于中轴骨,以溶骨性病变为主[2-3]。近年来围绕着乳腺癌 BTM 的研究已广泛展开:在乳腺癌亚型研究中,通过对 263 例原发性乳腺癌样本采用转录介导的恒温扩增技术分析显示:当雌激素受体 ( estrogen receptor,ER ) 表达为阳性、人表皮生长因子受体-2 ( human epidermal growth factor receptor 2,Her2 ) 表达为阴性、癌细胞的 Ki67 阳性表达率>13% 时,骨转移的发生率最高,可达 87.8%,由此可看出 ER、Her2 和 Ki67 对于乳腺癌骨转移或是重要的转移预测指标[12]。也有学者对 157 例原发性乳腺癌的基因表达谱进行分析发现:体内含有 15-gene 的患者,骨转移的复发率高达 82.4%,这些基因编码产物是参与蛋白结合的膜分子,但其作用不同于破骨细胞的募集反应和癌细胞的趋化性[13]。
同时,有学者通过对 150 例原发性乳腺癌患者进行长达 84 个月的随访比对子代 BTM 表达水平发现:子代中IL-1β 水平显著上升,差异有统计学意义 (P<0.0001 )[14],IL-1β 或也可以作为乳腺癌 BTM 的一个重要成员。此外,也有研究发现:骨转移发生时,MDA-MB-231 乳腺癌细胞内的一些蛋白肽,巨噬细胞加帽蛋白 ( macrophagecapping protein,CapG ) 和 G 蛋白相互作用蛋白 C 末端 ( PDZ domain-containing protein member 1,GIPC1 ) 表达显著增强[15]。目前已有通过 CapG / GIPC1 评估双磷酸盐辅助治疗的报道[15]。
2. 前列腺癌中具有预测潜能的 BTM:我国前列腺癌的发病率逐年递增,前列腺癌骨转移的发生率约为 65%~70%,呈典型的成骨性病变[16]。既往临床研究多以 PC3-ML 和 PC3-N 两种亚型为研究对象,在小鼠实验中,尽管两种亚型具有不同的转移机制,但相关细胞因子的表达相似[3]。相比 PC3-N 型,PCR-ML 细胞膜上的血小板源性生长因子-α 受体 ( platelet-derived growth factor receptor-α,PDGFRα ) 过表达,且 PCR-ML 型细胞对血小板源性生长因子的敏感性更高[17]。PDGFRα 具有促进 IL-1β 表达的特性,有学者给小鼠注射 PDGFRα 后也发现:PC3-N 型细胞可诱导逆转录病毒介导 IL-1β 过表达,进而促进骨转移的发生[17]。
另有学者对小鼠原发性肿瘤和骨转移模型观察发现:骨转移组骨钙素 ( osteocalcin,BGP )、骨桥蛋白( osteopontin,OPN ) 和成骨特异性转录因子 ( runt related transcription factor 2,Runx-2 ) 的产生明显高于对照组[18]。同时,近期的荟萃分析结果也表明:前列腺癌中 CXCR-4的表达与骨转移发生密切相关[19]。
3. 肺癌中具有预测潜能的 BTM:肺癌骨转移发生率为30%~40%,中位生存周期为 6~12 个月,经过治疗后,1 年生存率仅为 40%~50%,好发于脊柱和躯干骨近端,以溶骨性病变为主[20-21]。有学者通过研究 2021 例肺癌患者 ( 骨转移患者占 23.9% ) 发现:癌抗原 125( cancer antigen 125,CA-125 ) 和碱性磷酸酶 ( alkaline phosphatase,ALP ) 水平可被确定为肺癌骨转移的独立危险因素,CA-125 诊断骨转移的敏感性和特异性分别为32.1% 和 80.8%,ALP 分别为 41.3% 和 77.1%[21]。另有学者对 65 例小细胞癌患者 ( small cell lung cancer,SCLC ) 研究发现:CXCR4 的高表达与骨转移的发生密切相关,它可能是 SCLC 中骨转移有效预测因子[22]。也有学者发现RANKL 和胰岛素样生长因子-1 受体 ( insulin-like growth factor-1 receptor,IGF-1R ) 的表达,能诱导破骨细胞的分化;甲状旁腺相关蛋白 ( PTH related protein,PTHrP ),RANKL,M-CSF 参与骨转移发生机制[23]。在对肺癌骨转移小鼠模型的探索发现:降低整合素 β1 和 MMP2 的表达可抑制骨转移发生[24]。
4. 其它癌中具有预测潜能的 BTM:肾癌骨转移中位生存周期为 8 个月,经过治疗后,1 年生存率为 50%,5 年以上的生存率仅为 10%,以溶骨性病变为主[25]。在探讨肾癌骨转移发生机制和转移癌细胞增殖机制时,有学者发现:786-O 型肾癌细胞膜表面钙黏素-11 明显增多,癌细胞的侵袭力也随之增强[25];也有学者研究发现:胰岛素样生长因子-II mRNA 结合蛋白 3 ( insulin-like growth factor-II mRNA-binding protein 3,IMP3 ) 的表达增强与较差的预后相关,它可作为肾癌骨转移独立的预后指标[26];近期也有文献报道:在肾癌骨转移发生时,血清中 TGF-α、TGF-β、PTHrP、钙敏感受体 ( calcium-sensing receptor,CASR ) 和表皮细胞因子 ( epidermal growth factor,EGF ) 等标志物表达明显增强[25-26]。

表1 恶性肿瘤中具有预测骨转移潜能的 BTMTab.1 BTM in the prediction of bone metastasis in malignant tumors
甲状腺癌骨转移发生率为 2%~13%,生存期长达10 年,好发于中轴骨,以溶骨性病变为主[27]。目前对甲状腺癌骨转移潜能的 BTM 研究相对较少,曾有报道骨转移发生时,患者体内 IL-1、IL-6 和 RANKL 表达水平明显增强[28]。
三、BTM 的临床应用价值
骨转移的发生与特定 BTM 的释放相关,在诊断中可通过检测体液中相应 BTM,获悉骨转移的发生及进展情况,为骨转移的预后提供可靠的参考。
1. 骨转移的诊断:BTM 的潜在作用在骨转移诊断中得以应用。有学者以 83 例前列腺癌患者 ( 骨转移 42 例 ) 为研究对象,检测其血清中骨唾液酸蛋白 ( bone sialoprotein,BSP )、ALP、I 型胶原吡啶交联终肽 ( pyridinoline-crosslinked carboxyterminal of type I collagen,ICTP ) 和前列腺特异抗原 ( prostate specific antigen,PSA ) 水平,经 ROC 曲线分析显示:BSP、ALP、ICTP 和 PSA 在骨转移诊断的灵敏度分别为 80.95%、57.14%、69.05% 和 71.43%,其特异性分别为 72.80%、6.80%、76.80% 和 88.80%,且四种 BTM 的联合检测灵敏度提高至 97.62%,特异性提高至97.60%。当两种 BTM 联合检测时,发现 PSA 与 BSP 联合检测效果最佳[16]。也有学者分别通过检测 42 例非小细胞肺癌 ( non-small cell lung cancer,NSCLC ) 患者和 31 例小细胞癌患者的血清中癌胚抗原 ( carcino-embryonic antigen,CEA ) 和 OPN 水平发现:在 NSCLC 和 SCLC 中,伴有骨转移的患者血清 CEA 和 OPN 均明显高于非骨转移组[29]。
同时,一项最新的荟萃分析结果表明:血清中 I 型胶原 N 末端肽 ( N-telopeptide of type I collagen,NTX ) 水平可作为中国人群骨转移诊断的重要指标[30]。另一项荟萃分析结果提示:不同肿瘤类型中,骨转移患者血清中 BALP 水平显著上升[31]。
综上所述,BTM 的表达水平可作为预测和诊断骨转移发生的一项新临床策略。
2. 骨转移的预后:值得一提的是,近年来开始出现一系列通过采用 BTM 评估骨转移治疗的报道。有学者对52 例乳腺癌骨转移患者采用不同骨靶向治疗方案后,分别检测治疗后血清中相关 BTM 表达水平,结果表明治疗后血清中 TRACP-5b、NTX 和 BALP 水平显著下降,且NTX 和 BALP 在治疗后第 3 个月和第 6 个月下降最快[32]。同时,有学者对前列腺癌骨转移患者使用阿比特龙治疗发现:患者血清中 ALP 表达水平存在跳跃现象,即在 8 周内,ALP 水平上升,随后显著下降,经过 12 周的治疗后该现象消失,同时 PSA 水平开始下降[33]。此外,对肾癌骨转移患者采用唑来膦酸治疗时发现:预后不良或者死亡的患者血清中 β-CTX 和 BAP 表达明显增强[25]。
上述类型研究近年来虽数量不多,但可以看出 BTM对于临床骨靶向治疗效果的评估也具有良好的评估作用。未来或成为骨转移 BTM 研究的一个重要研究方向。
3. BTM 的局限性和研究方向:结合最新研究结果及笔者研究团队的经验,BTM 距离正式临床应用仍有一定距离:( 1 ) 部分 BTM 正常值范围广,昼夜更替、季节变化都会影响体内 BTM 水平,因此,制订基于 BTM 的诊断和预测标准需要进一步探索与研究;( 2 ) 骨转移作为一个复杂的病生理过程,部分肿瘤分子分型的探索尚未完成,这加大了检测数据分析难度;( 3 ) 一些 BTM 水平因当前检测技术受限而无法准确测量;( 4 ) 骨代谢性疾病、骨折、治疗药物等因素皆可干扰 BTM 表达水平[3,25-34]。上述瓶颈未来或可成为骨转移 BTM 研究的重点方向。
综上所述,BTM 在骨转移的诊断和治疗评估中有重要的临床指导作用及潜在研究价值。未来经过进一步探索,或可在肿瘤诊治过程中通过检测外周血 / 体液中相应 BTM表达水平,从而掌握肿瘤骨转移的发生及进展情况,甚至评估骨靶向治疗效果,进而提高临床对骨转移的认识和诊治水平,为未来骨转移的精准治疗的方案制订奠定基础。

