褪黑素减轻心肌缺血再灌注损伤的新机制
张 彬,翟蒙恩,李凯峰,李步潆,刘振华,陈正希,江丽青,梁宏亮,段维勋,金振晓,俞世强
随着发病率逐年攀升,缺血性心脏病严重威胁着人类健康[1],主因冠脉血流供应减少,导致心肌细胞营养物质供应不足,影响心脏正常的能量代谢。目前,随着急诊溶栓、急诊冠脉介入治疗和冠状动脉旁路移植手术等缺血再灌注技术的广泛应用,部分急性心肌梗死(acute myocardial infarction,AMI)患者能得到及时的再灌注治疗。然而,在恢复血流供应后,缺血心肌组织损伤在某些情况下反而进一步加重,导致大量心肌细胞死亡,严重影响心脏功能及其预后,这种现象被称为心肌缺血再灌注损伤(my⁃ocardial ischemia reperfusion injury, MI/RI)[2-3]。 深入研究MI/RI发病机理,探索保护心肌的新靶点及药物是目前心血管保护领域亟待解决的问题。
褪黑素(Melatonin,Mel)是一种由松果体分泌的吲哚类激素,具有改善睡眠、抗免疫、抗衰老和抗肿瘤等广泛的生物学效应[4]。许多研究证实,褪黑素在高血压、动脉粥样硬化、MI/RI、心肌肥厚等多种心血管疾病中发挥重要的保护作用[5]。同时,有研究报道衰老标记蛋白30(senescence marker pro⁃tein-30,SMP30)作为一种新型钙结合蛋白,参与调节体内细胞增殖及多种生理代谢过程,近年来也发现其在抗氧化应激、抗炎、抗凋亡等细胞保护作用中扮演重要角色[6-7],但其是否介导 Mel抗 MI/RI 尚不清楚。为此,本研究采用H9c2细胞模拟缺血再灌注(simulated ischemia reperfusion,SIR)损伤模型,深入探究Mel减轻MI/RI新机制,为今后Mel用于缺血性心肌病及其并发症的治疗提供新的理论依据和实验基础。
1 主要材料和实验方法
1.1 细胞株及主要试剂 H9c2细胞(ScienCell公司,美国);Mel,超氧化物阴离子荧光探针(二氢乙锭,dihydroethidium,DHE)(Sigma-Aldrich公司,美国);钙离子荧光探针(Fluo-4 AM)(Thermo Fisher Scientific公司,美国);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶 (superoxide dismutase,SOD)(南京建成生物工程研究所);CCK-8细胞毒性检测试剂盒(上海七海复泰生物科技有限公司);anti-SMP30 和 anti-gp91phox抗体(Santa Cruz公司,美国);anti-Bcl2、anti-Bax、anti-cleaved caspase 3 抗体(Cell Signaling公司,美国);anti-β-actin 抗体(CMCTAG公司,美国);辣根过氧化物酶标记的羊抗兔、羊抗鼠和驴抗羊IgG二抗(北京中杉金桥生物技术有限公司)。
1.2 主要实验仪器 灭菌型CO2细胞培养箱(Ther⁃mo);激光扫描共聚焦显微镜和倒置显微镜(Olym⁃pus);高速低温离心机(Eppendorf);Western blot电泳、转膜及凝胶成像设备(Bio-Rad);酶标仪(Spec⁃traMax)。
1.3 H9c2细胞培养及SIR模型的建立 H9c2培养用含10%胎牛血清的完全培养液在37℃,5%CO2培养箱内培养。SIR通过使用缺血液培养实现:待各组细胞贴壁并生长到一定密度后,弃掉培养液,加入缺血液(含 CaCl2·2H2O 0.9 mmol/L、MgCl20.49 mmol/L、NaCl 137 mmol/L、KCl 12 mmol/L、4-羟乙基哌嗪乙磺酸(HEPES) 4 mmol/L、脱氧葡萄糖 10 mmol/L、连二亚硫酸钠 0.75 mmol/L、乳酸钠 20 mmol/L,pH 值调至 6.5)避光置于 37℃,5%CO2的孵箱内培养45 min,模拟缺血过程结束后更换正常培养液在孵箱中继续培养4 h完成再灌注。
1.4 SMP30 siRNA 的转染 将 H9c2 细胞按 1.0×106/孔接种于6孔板上,贴壁生长24 h,待细胞密度达50%融合时进行转染。转染操作按lipofectamine 3000试剂说明书进行。转染前4 h吸净含血清的普通培养液,换成2 ml不含血清的细胞培养基(dulbec⁃co's modified eagle medium,DMEM)培养液。 转染结束后继续进行相应给药及SIR处理。实验分组如下:①Con:对照组;②SIR组;③Mel+SIR组:药物预处理加SIR损伤组;④siSMP30+Mel+SIR组:抑制SMP30表达后,再进行药物处理及SIR组;⑤ siSMP30+SIR组:单纯抑制SMP30表达后,进行SIR损伤组。
1.5 DHE荧光探针检测活性氧(reactive oxygen species,ROS)含量 待各组细胞处理结束后,吸净培养液,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗3 次,加入含有 DHE 染液(5 μmol/L)的无血清培养液避光在培养箱中继续孵育30 min,进行荧光探针装载,随后用无血清的培养液洗涤细胞3次,立即用酶标仪检测各孔外直径(outside diameter,OD)值(535 nm波长下吸光度值)指示细胞内ROS含量。
1.6 Fluo-4 AM 荧光探针检测胞内 Ca2+浓度 Ca2+荧光探针Fluo-4 AM负载细胞时需用无Ca2+培养液(NaCl 135 mmol/L、KCl 2 mmol/L、MgCl22 mmol/L、HEPES 10 mmol/L、葡萄糖 4 g/L)稀释成工作浓度5 μmol/L。 待各组细胞处理结束后,吸净培养液,用PBS漂洗3次,向细胞中加入Fluo-4 AM工作液,避光37℃孵育30 min。弃去荧光探针,更换新的无Ca2+培养液,避光37℃继续孵育30 min。以酶标仪检测各孔 OD值(Ex/Em:494/506 nm 波长下吸光度值)指示细胞内Ca2+浓度。
1.7 细胞活力检测 将H9c2细胞接种在96孔板上,待各组细胞处理结束后,向每孔内加入10 μl的CCK-8反应液,避光在培养箱内继续孵育2 h,用酶标仪检测各孔OD值(450 nm波长下吸光度值)指示细胞活力。
1.8 Western blot检测细胞相关蛋白表达水平 收集处理结束后的各组细胞,加入裂解液、蛋白酶抑制剂和磷酸酶抑制剂混合物,置于冰上充分裂解,并对细胞裂解上清进行蛋白定量。各组蛋白经聚丙烯酰胺变性凝胶电泳(sodium dodecyl sulfate polyacrylam⁃ide gel electrophoresis, SDS-PAGE)分离,并用湿转法转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF膜)上,5%脱脂牛奶室温封闭2 h后,分别孵育在 SMP30(1 ∶500)、gp91phox(1 ∶500)、β 细胞淋巴瘤/白血病基因 2(B-cell lymphoma, Bcl2)(1 ∶1 000)、Bcl2相关 X 蛋白(Bcl2-Associated X,Bax)(1 ∶1 000)、裂解半胱天冬酶 3(cleaved caspase 3)(1 ∶1 000)、β-肌动蛋白(β-actin)(1 ∶4 000)抗体中4℃过夜。洗膜缓冲液(tris Buffered saline with tween,TBST)洗脱3次,加入对应辣根过氧化物酶标记的羊抗兔、羊抗鼠和驴抗羊IgG二抗,室温孵育2 h,TBST洗脱3次,通过Bio-Rad照相系统采集照片,用ImageLab软件对其进行分析,以β-actin作为内参,分别检测各蛋白表达情况。
1.9 统计学分析 用SPSS 13.0统计学软件进行统计分析,实验数据以均数±标准差(±s)表示;多组间数据比较采用方差分析(ANOVA),若总体差异显著,再以t检验分析相应两组间的显著性差异。以P<0.05表示差异有统计学意义。
2 结 果
2.1 Mel呈剂量依赖性的减轻H9c2细胞SIR损伤
与Con组相比,SIR处理后H9c2细胞的存活率显著降低(P<0.05);Mel预处理可提高 SIR损伤后H9c2细胞的存活率,其中 Mel浓度为 100 μmol/L作用效果最明显(P<0.05)。同时,与Con组相比,SIR损伤显著上调了凋亡蛋白cleaved caspase 3和氧化应激标志蛋白 gp91phox的表达(P<0.05);Mel预处理可抑制SIR损伤后H9c2细胞凋亡蛋白cleaved caspase 3和氧化应激标志蛋白gp91phox的表达,其中Mel浓度为100 μmol/L时作用效果最明显(P<0.05),后续实验均采取此浓度进行药物预处理。见图1A~D。
2.2 Mel可显著增强SIR损伤后SMP30蛋白的表达,减轻细胞钙超载 首先笔者检验了siRNA的干扰效率,发现 SMP30 siRNA可以显著降低细胞SMP30蛋白的表达,但对细胞凋亡通路无明显影响,除外了siRNA本身对细胞的影响(图2A~C)。与Con组相比,SIR损伤后H9c2细胞SMP30蛋白表达量显著降低,细胞内Ca2+浓度显著升高,经Mel预处理可呈剂量依赖性的提高SMP30的表达量,降低 Ca2+浓度,且 Mel浓度为 100 μmol/L 时作用效果最明显(P<0.05);免疫荧光染色也发现 Mel预处理可显著提高SMP30的表达,用SMP30 siRNA抑制SMP30分子的表达后,可逆转Mel的上述作用(P<0.05)。 见图 1E~F;图 2D~G。

图1 不同浓度Mel(μmol/L)对SIR损伤后细胞的保护作用及胞内Ca2+浓度及SMP30表达量的影响
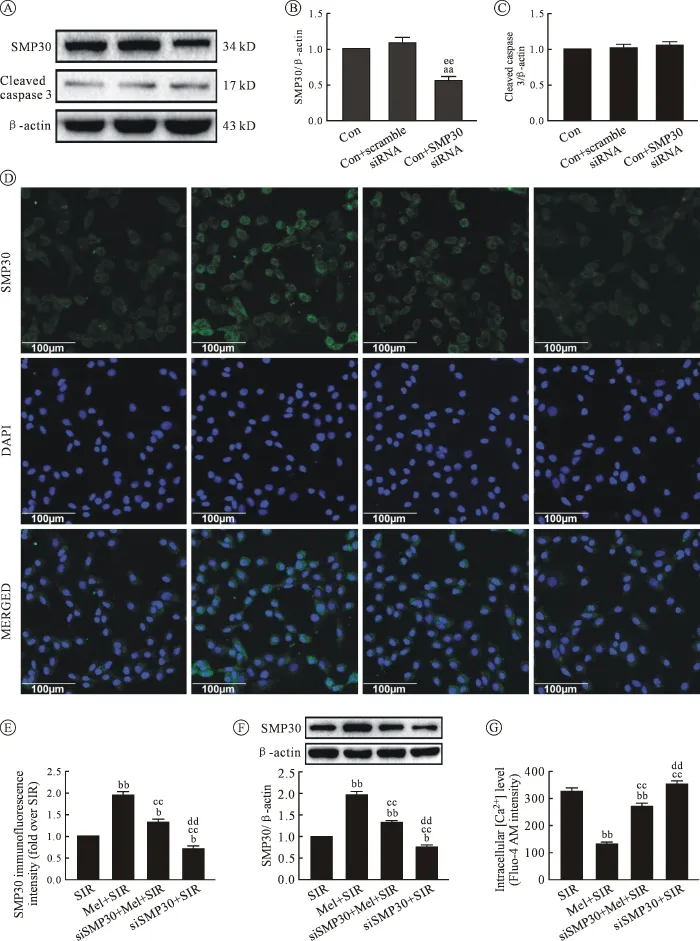
图2 SMP30 siRNA抑制SMP30表达后对细胞内Ca2+浓度及SMP30表达量的影响
2.3 SMP30介导Mel抗凋亡作用减轻H9c2细胞SIR损伤 抑制SMP30蛋白表达后发现,与Mel+SIR组相比,siSMP30+Mel+SIR组细胞皱缩明显增多,脱落增加,细胞活力明显下降;同时细胞抗凋亡蛋白Bcl2表达显著下降,凋亡蛋白Bax、cleaved caspase 3表达显著增加(P<0.05)。与SIR组相比,siSMP30+SIR 组细胞形态和 Bcl2、Bax、cleaved caspase 3蛋白表达无明显变化(P>0.05)。见图3。
2.4 SMP30介导Mel抗氧化应激作用减轻H9c2细胞SIR损伤 抑制SMP30蛋白表达后发现,与Mel+SIR组比,siSMP30+Mel+SIR组细胞中SOD活性显著降低,MDA含量、ROS生成量及gp91phox表达量均显著增加(P<0.05)。 与 SIR 组比,siSMP30+SIR 组对H9c2细胞中MDA含量、SOD活性、ROS生成量、gp91phox表达量均没有显著影响(P>0.05)。 见图4。
3 讨 论
本研究通过离体细胞实验首次发现,Mel预处理可激活SMP30信号,增强细胞的抗氧化应激能力,减轻细胞内钙超载,进而减少细胞凋亡和坏死,最终改善心肌细胞缺血再灌注损伤。本实验结果为完善Mel在MI/RI中的保护作用提供了新的实验依据,为其进一步的临床应用奠定了理论基础。
近年来,缺血性心脏病严重地威胁着人群健康,其治疗核心是重新恢复缺血心肌的血液供应。然而通过对先前缺血心肌实行血流恢复后,在某种情况下又会加重再灌注损伤症状,包括心肌细胞功能异常和细胞死亡。MI/RI形成是一个多因素、多步骤的复杂过程,其发生机制尚不完全清楚。有大量文献显示MI/RI的发生可能与细胞内钙超载、氧自由基的产生、中性粒细胞浸润、能量代谢障碍、血管内皮细胞功能障碍及心肌细胞凋亡等因素密切相关[8-10]。而氧化应激和钙超载是其中两个重要的损伤因素,寻找减轻氧化应激和钙超载的有效措施来改善MI/RI显得尤为重要。
心肌细胞内Ca2+主要储存于肌浆网和线粒体内,并且静息状态下胞浆内游离Ca2+浓度很低。心肌细胞缺血后,无氧代谢使组织间液和细胞内pH下降,激活 Na+通道、Na+/H+交换体和 Na+/HCO3-同向转运体,胞内Na+浓度增加;同时,缺血期细胞线粒体受损,导致能量供应障碍,Na+-K+-ATP酶活性降低,也造成胞内Na+浓度增加。再灌注时,膜上反向钠钙交换体(Na+/Ca2+exchanger,NCX) 被广泛激活,导致胞外Ca2+大量、快速进入心肌细胞,加之细胞膜通透性增加,再灌注时Ca2+顺着浓度梯度大量内流,最终形成胞内钙超载[11-12]。 以往研究发现,SMP30在细胞调控中扮演多种角色,能够维持机体多种细胞内的钙稳态。并且有报道称,在SMP30高表达的肝细胞内,SMP30可能通过调控胞膜Ca2+泵,增强胞内 Ca2+外流进而减轻细胞损伤[13]。本研究同样发现,在 SIR损伤后,细胞内Ca2+浓度显著升高,Mel预处理可显著促进SMP30的表达,继而降低胞内Ca2+浓度,减轻细胞损伤;然而,用SMP30 siRNA抑制SMP30表达可逆转Mel的保护作用,表明Mel可能通过激活SMP30信号,减轻胞内钙超载,进而改善细胞缺血再灌注损伤。
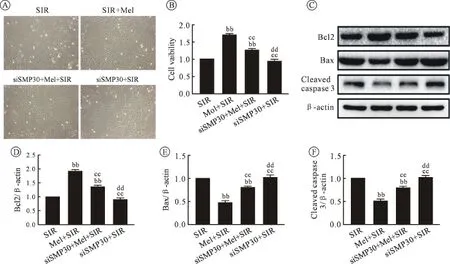
图3 SMP30 siRNA抑制SMP30表达后对相关蛋白凋亡指标的影响

图4 SMP30 siRNA抑制SMP30表达后对氧化应激相关指标的影响
氧化应激与MI/RI的关系近年来也被大量的研究证实。当心肌细胞缺血、缺氧时,ROS清除系统功能降低,生成系统活性增强,一旦恢复组织血液供应和氧供,ROS反而会进一步产生并急剧堆积,以不同方式造成细胞急性或慢性损伤[14-15]。 Mel作为内源性的吲哚类激素,具有强效抗氧化应激作用,在肠、肝脏、心脏、脑等多种器官的缺血再灌注损伤实验中发挥保护性作用[16-19],其作用机制包括清除自由基、降低一氧化氮合酶和一氧化氮生成、保护线粒体功能、抑制细胞凋亡等。此外,作为一种衰老相关蛋白,SMP30会随着机体的衰老在多种组织器官中表达量逐渐下降。除了在调节细胞内钙稳态中扮演重要角色,SMP30的抗氧化作用也在多种动物模型和细胞系中得到验证[7,20],并且能够通过抑制一氧化氮合酶、蛋白激酶和蛋白磷酸酶的活性以及促进Bcl2、Akt的表达来减轻细胞凋亡[21]。 然而,SMP30能否介导Mel的抗氧化应激与凋亡的作用未见报道,在本研究中,笔者发现,缺血再灌注损伤后,细胞活力下降,SMP30蛋白表达量下调,凋亡通路相关蛋白表达上调,氧化应激水平上升。Mel预处理可以逆转上述效应的发生,发挥减轻缺血再灌注损伤的作用,而Mel的抗氧化应激与抗凋亡作用均可被SMP30 siRNA抵消,进一步验证了SMP30可介导Mel对H9c2细胞的保护作用。
综上所述,SMP30分子可作为Mel新的作用靶点,来介导其发挥减轻MI/RI的作用。

