无血预充大鼠体外循环模型的建立
李 健,郭 震,路丽明,李 欣
由于临床上接受心脏外科体外循环手术患者体质差异,基础病变及外科、麻醉的多重因素影响,使得去除临床其他干扰因素,单独研究体外循环的损伤作用及探索机体保护措施相关研究受到很大局限。同时受到伦理学限制,研究者们无法轻易就可能的临床干预措施对临床患者进行前瞻性随机对照研究。因此,建立稳定可靠、可以模拟临床体外循环过程的动物实验模型显得尤为重要。
大鼠价格低廉、具有与人的心血管解剖相似、针对大鼠成熟研究手段丰富等优点,逐渐受到研究者的青睐,成为建立体外循环动物模型的首选。经回顾近十几年来国内外体外循环大鼠模型建立经验,发现既往模型存在外科操作较复杂、预充量较大等问题,因此本研究拟对大鼠体外循环模型建立的相关外科技术进行改良,并减少预充量,实现安全无血预充,探索大鼠体外循环模型安全有效的建立方法。
1 研究对象及方法
1.1 实验动物 选取体重在350~450 g的成年雄性SD大鼠15只,大鼠由上海交通大学附属胸科医院动物实验中心提供,并由上海交通大学附属胸科医院动物伦理委员会审核通过。
1.2 材料物品 整个大鼠体外循环系统由蠕动泵(中国kamoer公司)、泵管道(20 cm 长内径2.4 mm的硅胶管道)、小动物膜式氧合器(中国科威公司)、储血罐、连接管道组成,其中储血罐和连接管道分别选用临床上常用的10 ml注射器针筒与输液器管道制作。其他试验材料包括恒温水浴箱(中国奥尔科特公司),多导生理监护仪(荷兰Philip公司),1 ml、2 ml、50 ml一次性注射器(中国康德莱公司),手术缝线(美国强生公司);14 G、16 G、20 G、24 G 套管穿刺针(美国Becton Dickinson公司);乳酸林格注射液(中国济民公司),琥珀酰明胶注射液(佳乐施Ⓒ,美国贝朗公司),碳酸氢钠注射液(中国回音必公司)。
1.3 实验方法
1.3.1 准备与麻醉 术前 12 h禁食,术前 2 h禁水。称重,按体重5 ml/kg腹腔注射10%水合氯醛麻醉诱导。
用乳酸林格液6 ml、琥珀酰明胶注射液6 ml、碳酸氢钠注射液1 ml比例共13 ml进行管道预充,预充完毕后储血罐内约2 ml液体。将管道没入37℃恒温水浴箱中。
使用一次性2 ml注射器针筒自制开口器,尾端部加工成为楔形。楔形前端角度约为25°,前端处理光滑,以防刮伤大鼠口腔内黏膜组织。导管顶端和底端长度根据大鼠体重可相应修改。手术区域备皮、碘伏消毒、铺无菌单,将大鼠妥善固定与手术板上。大鼠头朝向术者,用橡皮筋将大鼠上门齿固定于手术板头端的钉子上,倾斜手术板约20°。大鼠头侧稍微垫高,左手用眼科镊子夹持纱布包裹鼠舌并轻微向外牵拉出口腔。插入开口器使口腔张开,将光源引入口腔,右手持插管,向上轻压大鼠舌根部,即能看到大鼠的声门随呼吸开启与闭合,趁声门打开瞬间迅速将气管导管插入气道,退出管芯,确定插管位置。如不在气道内,应立即拔管,稍后重插。插管位置无误后,用胶带固定气管插管并连接小动物呼吸机行机械通气。潮气量设置为10 ml/kg,呼吸频率60次/min,吸入纯氧,氧气流量1 L/min。根据动脉血气调整呼吸机参数,使PaCO2保持在35~45 mm Hg。根据大鼠麻醉深度实际情况进行麻醉维持,10%水合氯醛0.5 ml或1 ml间断腹腔注射。
1.3.2 外科操作 左股部沿股血管走形做 1.5 cm皮肤切口,游离左股动脉与左股静脉。在股动脉与股静脉下预置4-0丝线,可在穿刺血管时用来牵拉保持张力,置管完成后也可直接打结进行插管的固定。股动静脉均以24 G套管针穿刺置管,动脉血管由于压力较高,穿刺前先用血管夹夹闭近端,穿刺成功后松开血管夹完成置管,丝线打结牢固固定。股动脉连接换能器监测平均动脉压(mean arterial pressure,MAP)及采血,MAP 维持在70~90 mm Hg;股静脉连接输液器进行补液及推注肝素。从左股动脉采血0.5 ml行血气分析,根据体重以500 IU/kg从左股静脉套管缓慢推注肝素。
于右颈部旁开正中0.5 cm做一1.5 cm斜行切口,钝行游离右颈外静脉与右颈总动脉。在右颈外静脉与右颈总动脉下预置4-0丝线,以自制头端带多个侧孔的16 G套管针穿刺右颈外静脉,使头端进入右心房,固定,排气后连接静脉回流管。以20 G套管穿刺针穿刺右颈总动脉,使头端进入主动脉,固定,排气后连接灌注管道。见图1、2。
1.3.3 体外循环过程 使储血罐与大鼠保持30 cm高度以便于重力引流。管道及监护仪连接完毕后打开静脉引流端开关,使大鼠静脉血经右颈外静脉缓慢引流至储血罐。当监护仪上动脉血压波形消失时,开始体外循环转机。
灌流流量逐渐增加至 100~150 ml/(kg·min),保持MAP稳定于70~90 mm Hg,达到最大流量后停止机械通气,小动物膜式氧合器中通入纯氧,氧流量 1~2 ml/min,保持肛温在 36.5~38.3℃。 体外循环转流30 min时从左股动脉采血0.5 ml行血气分析,根据血气结果调整呼吸机参数。保证储血罐液体量在2 ml以上。
1.3.4 停机与拔管 转流60 min逐渐减小灌注流量,当监护仪上动脉血压出现波形时恢复机械通气,参数同前,流量减小至1~2 ml/min时停机。
从左股动脉采血0.5 ml行血气分析。将所有进行插管的血管结扎,用4-0丝线进行皮肤切口的缝合。自主呼吸恢复后拔出气管插管,改用自制面罩(50 ml注射器针筒)给予大鼠面罩吸氧,氧流量0.5 ml/min,直至大鼠自主意识恢复。 放回鼠箱,供食水,通风,保暖。
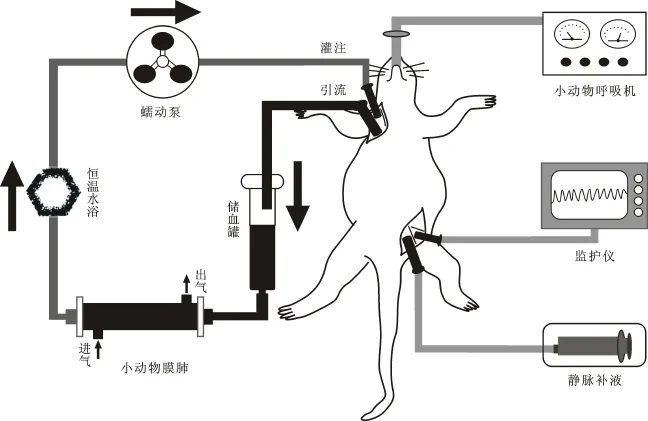
图1 大鼠体外循环组成示意图
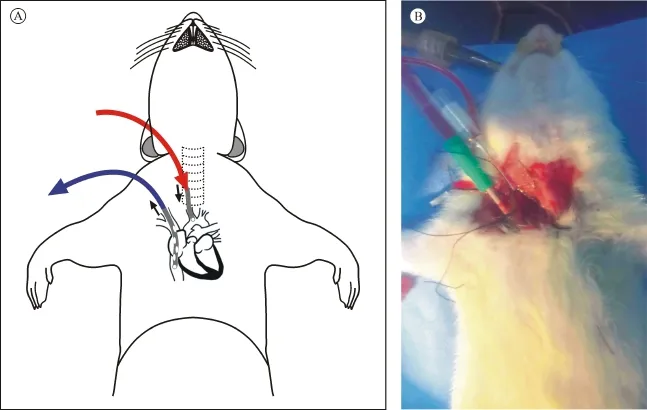
图2 右颈总动脉插管与右颈外静脉插管
2 结 果
2.1 基本资料比较 早期3只大鼠在外科准备阶段死亡而失败。分析失败的主要原因在于:游离右颈总动脉由于刺激到了伴行的右侧迷走神经引起迷走反射,影响了血流动力学的稳定;右颈静脉插管时穿破血管壁,导致无法补救的失血死亡;右颈静脉插管头端没有放在右心房处,引流不畅,体外循环无法维持。随后12只大鼠顺利完成体外循环建立及转流,停机后拔除气管插管,恢复自主呼吸、自主运动、反射,在水食充足及通风环境下存活超过1天。
2.2 存活情况 12只大鼠顺利停体外循环。血流动力学稳定后拔股动、静脉插管,自主呼吸恢复后拔气管插管,并用自制面罩给予吸氧。大鼠恢复意识及运动后放回鼠笼,保暖通风,供食、水。术后24 h再次观察大鼠存活情况,12只大鼠均可正常活动,精神状态如常,反应灵敏,手术切口无活动性出血,四肢末端颜色无紫绀。
2.3 血流动力学及血气 存活大鼠整个体外循环时间60 min,大鼠MAP在体外循环过程中有所降低,在体外循环结束后逐渐恢复,大鼠血气基本维持在正常水平,见表1。
3 讨 论
大鼠由于体格小,进行外科操作需要熟悉解剖并进行一定程度的练习。本研究在总结国内外大鼠体外循环模型后,结合自身实验条件及相关设备进行了改良。
3.1 麻醉与气管插管 合适的麻醉深度是顺利进行气管插管的前提。麻醉过浅,过度牵拉舌体会引起大鼠挣扎抵抗,插管过程会引起大鼠强烈应激反应,呕吐反射明显,呼吸节律紊乱,声门关闭,增加插管难度;麻醉过深则容易引起大鼠发生呼吸抑制,如不能尽快完成气管插管开始机械通气,容易导致大鼠死亡。吸入麻醉是近年来的麻醉方式,易于控制麻醉深度。本研究采用10%水合氯醛麻醉,得到了良好的麻醉效果,但需注意避免将药物注入大鼠实质性脏器引起动物死亡。
合适的体位有助于气管插管顺利操作,既往研究[1]认为将大鼠固定于15~20°倾斜的手术板较为合适。若倾斜角度超过30°,由于大鼠受自身重力下坠牵拉膈部引起疼痛造成大鼠挣扎,容易导致拉伸扭曲,增加插管难度。本研究中插管时大鼠手术板与桌面角度保持在20°,插管时不影响插管操作。
既往报道气管插管方式有盲插法、经口直视插管法、颈部切口插管法、钢丝引导插管法等等,盲插法成功率较低,容易损伤气道,切开插管会对气管及喉部组织造成损伤,因而无创插管的方法较为推崇,但是大鼠呼吸频率快、口腔狭小、声门位置较高较难暴露,因而笔者根据报道[2]制作了大鼠口腔撑开器,能够较好的暴露大鼠声门。本研究采用的大鼠平均体重在400 g左右,采用14 G套管针作为气管插管,可以获得满意通气效果。
3.2 外科操作 大多数已报道的大鼠体外循环模型不需要正中开胸中心插管,而是采用外周血管插管。动静脉插管被认为是大鼠体外循流量得以保证的最重要一环,而右颈外静脉插管又是大鼠体外循环模型决定成败的一个关键步骤。右颈外静脉、右上腔静脉、右心房壁均菲薄,且右颈外静脉汇入右上腔静脉过程中有两次迂曲,故对插管技术要求很高。插管一旦失败出现静脉破裂,将会不可避免的大鼠失血死亡,无法补救。本研究通过前期预实验,总结出几点经验可以提高插管成功率:①通过前期预实验精确估计从右颈外静脉到右心房的插管深度并在插管上提前做好距离标记;②熟练掌握使用穿刺套管针的方法,包括穿刺角度、穿刺后旋转斜面、套管进入血管后尽快退出穿刺针芯;③熟悉大鼠血管解剖,穿刺过程中顺血管走形置管。由于大鼠有两条上腔静脉,因而体外循环结束后结扎右颈外静脉不会造成大脑一侧静脉回流不畅[3]。本研究静脉插管采用头端带多个侧孔的16 G套管作为静脉插管,可以较轻松完成插管,套管头端插入右心房可以获得满意流量。
灌注血管选择右颈总动脉有三个优点:经右颈总动脉插管至主动脉弓可以很好的模拟临床手术情况;大鼠具有完整的Willis脑基底动脉环[4],体外循环结束后结扎一侧颈总动脉不会影响大鼠存活;大鼠右颈总动脉与右颈外静脉解剖位置适宜,可以在颈部做单一切口完成两条血管的游离,避免了使用尾动脉或股动脉增加切口,不利于大鼠术后存活于恢复。但颈总动脉与迷走神经伴行,游离过程中需注意动作轻柔,避免暴力操作刺激迷走神经,引起迷走反射,影响大鼠血流动力学稳定,增加大鼠死亡风险。本研究采用20 G套管作为动脉插管,可以较轻松完成插管,并且可以达到满意的灌注流量。
表1 大鼠体外循环模型血流动力学及血气变化(n=12,±s)

表1 大鼠体外循环模型血流动力学及血气变化(n=12,±s)
体外循环前 90.42±3.75 7.39±0.01 0.420±0.009 131.33±7.70 38.59±0.59体外循环 30 min 67.17±3.69 7.33±0.01 0.311±0.007 176.92±9.65 36.84±0.65体外循环 60 min 59.58±1.51 7.33±1.01 0.2962±0.006 177.25±5.50 37.48±0.40体外循环结束后 79.25±3.08 7.32±0.01 0.293±0.007 176.33±9.23 37.49±0.57
大鼠动脉血压检测血管通路及静脉输液血管通路选择左股动脉及左股静脉,股静脉血管壁菲薄且分支较多,游离过程需小心操作。
3.3 体外循环管理 静脉引流不足经常是限制流量的原因。本研究采用静脉重力引流,储血罐与大鼠保持30 cm高度差,虹吸作用满意。当引流不足时,可以轻柔调整插管位置,以获得最佳引流。
本研究中最大灌注流量在100~120 ml/min,虽然没有能够实现全流量,但是可以模拟基本的临床体外循环,且大鼠MAP稳定保持在60~90 mm Hg,术后可以存活至1天以上。
预充量较小,总共在13 ml左右,最大限度的避免了血液稀释,并做到无血预充,在完成体外循环过程的同时能够保证大鼠术后存活。
3.4 改良与问题 插管技术对于大鼠体外循环模型建立成功与否是最重要的。本研究中静脉血引流、动脉灌注、动脉压监测、静脉补液的完成均需应用到插管技术。通常需要三到四根血管建立血管通路,在体外循环中完成动脉灌注、静脉引流、动脉血压监测等。常用的动脉血管有颈总动脉、股动脉、尾正中动脉,常用的静脉血管有颈外静脉、股静脉。既往大鼠手术体外循环模型通常起码要做三个部位的切口进行血管游离穿刺置管。切口数量多会延长操作时间并影响大鼠术后恢复。本研究中大鼠模型建立为了缩短操作时间,减少大鼠手术创伤,仅在右颈部与左股部两处做皮肤小切口。游离右颈总动脉、右颈外静脉、左股动脉、左股静脉分别用作动脉灌注、静脉引流、动脉压检测、静脉补液。术中轻柔、谨慎操作,妥善插管固定,手术效果满意。此外也精简了体外循环管道,减少了预充量,减轻血液稀释。
本研究利用腹腔注射进行麻醉,麻醉深度不易控制,会出现体外循环过程中需要追加麻醉药物或体外循环结束后大鼠不能及时苏醒的问题;缩短体外循环管道虽然减少了预充量,但是没入恒温水箱中的管道较短,不能很快的达到目标温度;大鼠右颈部与左股部均需进行两支血管的穿刺置管固定,空间较小,操作过程中需要十分小心,一定程度上减慢了操作速度。
综上,本研究成功建立了易于操作、稳定可重复的无血预充微创大鼠体外循环模型,并且可以很好地模拟临床体外循环相关病理生理过程,可用于进一步研究体外循环手术围术期的全身炎症反应及多脏器损伤的病理生理机制;大鼠与人的同源性高,分子生物学检测手段丰富,可以更为全面深入的探究体外循环炎症反应过程发生的机制机理,为临床上进一步寻求预测及治疗策略提供帮助。

