慢性缩窄性心包炎行心包剥脱术的预后及危险因素:单中心二十年经验
李汉美,佟明汇,王 巍,杨 研,董 超
慢性缩窄性心包炎(chronic constrictive pericarditis,CCP)是心包炎患者常见的转归,由于慢性炎症导致心包增厚粘连,使心室舒张受限而产生一系列循环障碍[1]。内科治疗仅能暂时减轻症状,外科手术松解形成狭窄的心包组织是唯一有效的治疗手段[2]。目前该类手术的报道一般样本例数较少,或时间跨度大,而且缺乏远期随访的结果[3]。本研究的目的旨在报道本院CCP患者行心包剥脱术后的长期预后,并分析影响预后的危险因素。
1 资料与方法
1.1 研究对象 回顾性分析阜外医院1997年1月至2016年12月因CCP行心包剥脱术患者,最终共297 例患者被纳入分析,其中年龄在 3.7~83(41.8±16.1) 岁,女性患者 81 例(27.3%),对其进行随访,分析其术前、术后的临床资料。
1.2 诊断 CCP的症状主要是右心功能不全、体循环淤血和浆膜腔积液的表现。最常见的体征包括颈静脉怒张、肝大、下肢浮肿、心脏搏动减弱或消失,触诊时心脏的搏动明显弱于正常。心电图可见全导联QRS波低电压和ST-T段低平。胸片具有鉴别诊断意义的征象是心包钙化。超声心动图主要表现为深吸气时下腔静脉萎陷率小于50%或更低,组织多普勒二尖瓣环舒张速度加快,瓣环中央大于瓣环侧壁处。CT可以精确地显示心包增厚的程度和范围。心脏磁共振成像通过核磁心脏电影多切面、多角度显示心脏的活动情况,让手术医生在术前即知道心脏受束缚的程度和部位。
1.3 手术方法 所有患者均采用胸部正中切口开胸,尽量在常温下行心包剥脱术,剥离困难及合并需同期处理的瓣膜病变时则需建立体外循环。术中特殊要求是必须贴好胸壁上的体外除颤电极板,以便一旦剥脱术中电刀引颤心脏后能迅速除颤。标记好髂血管,应对可能需要的心包剥脱之前的体外循环插管。皮肤消毒按照冠状动脉旁路移植术准备,以防术中出现冠状动脉损伤。心包剥脱的顺序应该遵从逆血流方向的原则,先开放流出道,然后是心室窦部,接着是房室环,最后是心房和上、下腔静脉的左侧。先左心后右心。多数患者的剥脱范围都要超过双侧膈神经脊柱侧,心尖部位需完全剥脱;房室沟及腔静脉入口处的纤维性缩窄环必须松解。
1.4 统计学方法 采用SPSS 19.0统计软件进行统计处理。连续变量用平均值±标准差(±s)表达,分类变量采用百分比表达。具有正态分布的计量资料组间均值比较采用t检验,率的比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 患者的基础资料 297例患者平均年龄(41.8±16.1)岁,女性为 81(27.3%)。 按病因学分类,结核病182 例(61.3%),不明病因的 99 例(33.3%),心脏介入治疗或心胸外科手术后11例(3.7%),创伤后3 例(1.0%),放射治疗后 2 例(0.7%)。 病程为(8.3±10.2)年。 见表 1。
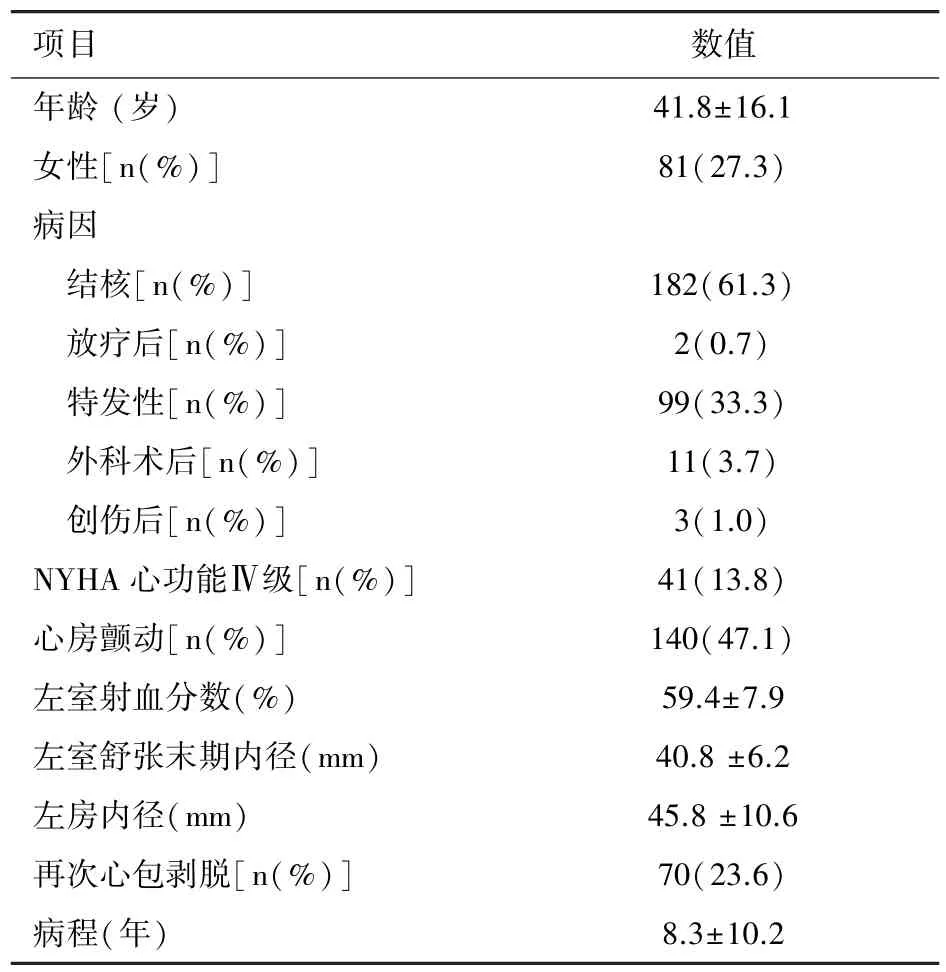
表1 患者的基础资料(n=297)
2.2 围术期资料 共纳入297例患者,接受298次心包剥脱手术,其中剥脱完全者281例 (94.6%),体外循环下手术48例 (16.2%),其中16例阻断升主动脉,平均阻断时间(72.7±35.2)min。 手术死亡13例,手术死亡率4.4%(其中非体外循环下手术249例,死亡7例,死亡率2.8%;体外循环下手术48例,死亡6例,死亡率12.5%)。见表2。
2.3 随访结果 对全部患者进行随访,平均随访55.7月,失随访 38 例(12.8%),随访中死亡 13 例。总体5年及10年免于主要不良心脑血管事件(main adverse cardiovascular and cerebrovascular events,MACCE)生存率分别为65%及59.7%。5年累积生存率 90.1%,10 年 89.2%。 见图 1。
根据患者确诊CCP病程而分组:①<5年(n=158);②≥5 年(n= 139),比较组间远期免于MACCE累积生存率,存在组间差异,病程长于5年的患者,其10年免于MACCE生存率较病程较短的患者明显下降[(47.0±5.3)%vs (71.1±4.5)%,Log-rankP<0.001]。 见图 2。
根据患者术前心房颤动(atrial fibrillation,AF)情况分为AF组(n=140)及无 AF组(n=157),两组患者10年免于MACCE累积生存率存在组间差异,术前合并AF的患者MACCE生存率明显较低[(47.8±5.8)%vs (68.9±4.6)%,log-rank<0.001]。 见图 3。

表 2 围术期资料[(n=297),n(%)]

图1 患者远期随访的预后情况
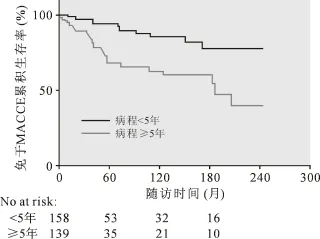
图2 根据病程时长评估患者远期预后情况
根据患者首次(n=227)和再次(n=70)接受心包剥脱手术分组,远期免于MACCE生存率存在组间差异,再次心包剥脱术的患者10年免于MACCE的生存率明显较低[(28.6±7.7)%vs (67.7±3.8)%,logrank<0.001]。 见图 4。
根据患者使用体外循环(n=48)和未用体外循环者(n=249)分组,虽然患者的远期免于MACCE生存率的组间差异未及统计学差异[(60.9±3.8)%vs (51.0±10.4)%,log-rank=0.339],但使用体外循环的心包剥脱患者较不停跳手术患者的10年累积生存率明显较低[(76.2±7.2)%vs(91.7±2.3)%,log-rank=0.001]。 见图 5。
单因素分析显示年龄、术前房颤及再次剥脱术是影响患者MACCE事件的影响因素,进一步行多因素回归分析显示:再次剥脱术是影响患者生存率的唯一独立危险因素 OR= 4.03(1.5-10.5)。 见表3。
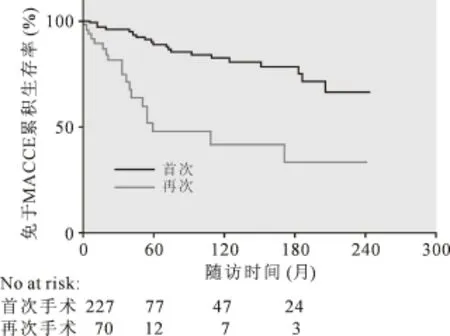
图4 根据首次和再次手术情况评估患者远期预后
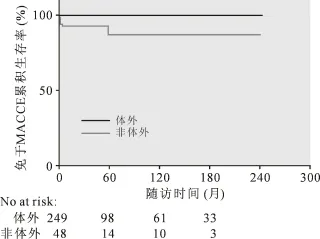
图5 根据术中体外循环使用情况评估患者远期预后
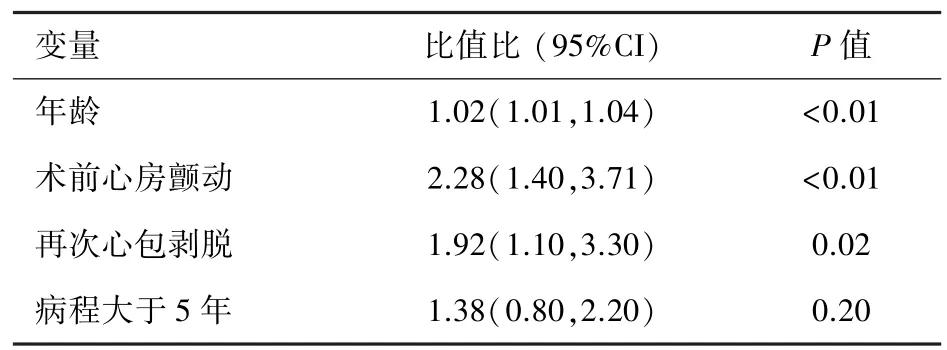
表3 远期随访患者发生MACCE的多因素分析
3 讨 论
CCP是因炎症累及心包的脏层和壁层,导致其纤维化和疤痕化,发生心包粘连、增厚、钙化和挛缩,限制心室的舒张,致心室舒张功能受损的一类疾病。作为CCP的主要有效治疗手段,心包剥脱术是最早被认知并成功开展的心脏外科手术。1921年法国人Hallopeau首次报道了心包剥脱手术成功个例,1926年德国医生报道了一组心包剥脱手术病例[4]。1948年吴英恺在国内成功地完成了心包炎患者的心包剥脱手术[5]。目前国际上此手术的大宗病例报道仅来源于少数大的心脏中心,此病的手术死亡率和并发症发生率仍然明显高于一般心脏手术[6]。国内外经验都显示,在非大型心脏外科中心接受心包剥脱手术的患者,仍然有相当数量的患者因心包缩窄需要接受再次心包剥脱,而在有经验的大型心脏外科中心接受过心包剥脱的CCP患者则罕有这种情况。这说明CCP进行彻底的心包剥脱的确存在一定的技术难度。
左侧开胸入路进行心包剥脱手术目前已较少被采用。这种手术入路唯一的、理论上的优点是方便对心室后壁的心包也进行剥脱。它的主要问题,一是增加对右房室沟和心脏膈面右侧病变处理的困难,二是紧急情况时建立体外循环时难度大,三是无法处理可能合并的房室瓣返流。2015年欧洲心脏协会关于心包疾病的指南中写明[2],应该避免使用左侧开胸入路进行CCP的心包剥脱,因为这种入路无法彻底剥脱心包。除外1例初次手术的患者选用左侧开胸外,全部患者均使用胸骨正中切口。
本组病例中,有相当比例的患者有既往心包剥脱手术史。患者之所以接受再次心包剥脱,唯一的原因是之前的心包剥脱手术没有达到心包剥脱手术的首要目标,即:尽可能完全地解除异常心包对心脏活动的束缚,尽可能减少将来可能发生的心包缩窄的组织学基础。彻底的心包剥脱手术后,心包缩窄的组织学基础消失,所谓的“心包再缩窄”在理论上已经变为不可能。2015年欧洲心脏协会的指南也指出[2],应该尽量彻底剥脱心包,避免部分剥脱。那种左侧开胸只剥脱心尖部心包和正中开胸只剥脱右室前壁心包的心包剥脱手术使患者需要接受再次心包剥脱手术的风险增加。本组做过的心包剥脱手术的患者,无论本次手术是第一次、第二次还是第三次,只有1例接受了再次心包剥脱。
Cho等分析了41例再次心包剥脱的患者[7],他们发现该组患者5年的生存率为49%,两次手术间隔时间短的患者生存率明显优于间隔长的患者(73%vs 29%,P=0.032)。 这可能是与间隔时间长的患者心肌受损和心室舒张功能影响更为明显有关。本中心的结果与上述研究相似,病程大于5年的患者生存率及免于MACCE的几率明显较病程短于5年的患者低。所以,在患者出现症状并明确诊断为CCP时,应尽早手术治疗,以减少心功能受损情况,改善预后。
多数研究均发现年龄是影响患者行心包剥脱术的危险因素[8-9],年龄大的患者手术风险高,且远期生存率低。本中心的结果也显示年龄高的患者生存率及免于MACCE的几率低,但是多因素回归分析发现只有再次心包剥脱才是影响预后的独立危险因素。这可能是因为高龄患者容易合并其他影响预后的因素,其预后差与其他因素有关。
放射性心包缩窄多发于放疗后5~10年,心包剥脱手术只能解决心包对心脏的束缚,不能改善心肌纤维化对心脏舒张功能的损害。美国Johns Hop⁃kins的经验也证明[10],放射性心包炎接受心包剥脱的患者,其远期生存率明显低于其他病因的患者。因此,放射线导致的CCP被有些作者称为无法手术的疾病[11]。 心脏移植已经用于此疾病的治疗[12],阜外医院亦有报道[13]。本组297例患者,只有2例为放射性治疗后的患者,术中剥离困难,术后患者症状改善不明显。由于该组患者中放射性治疗术后的患者比例较少,难以进行统计学分析。
大组的报道显示,使用体外循环是CCP心包剥脱手术的主要风险因素之一[14]。对于单纯CCP进行心包剥脱手术,体外循环下,对于层次不清的部位进行剥脱更有把握,对于左室侧、后壁进行剥脱时不用再顾忌搬动心脏对循环的影响。有了体外循环的后备,剥脱过程中无法控制的出血将不至于产生严重后果。另外,体外循环优势还在于可以迅速调整患者的血容量和电解质平衡。使用体外循环,患者术前的高血容量可以被有效地消除。体外循环的劣势有两个,一是损伤本已不正常的凝血功能,二是在炎症亚急性期的患者有发生感染播散及栓塞的风险。笔者的原则是尽量避免使用体外循环,但必须做好体外循环的准备。这也和目前的指南意见完全一致[2]。对于有轻度心内病变的患者,手术医生一定要反复权衡将非体外循环下单纯心包剥脱手术扩大为心包剥脱加体外循环下心内病变矫治带来的利弊。如果必须这样做,笔者的策略也是先在非体外循环下完成心包剥脱,继而完成术中经食道超声心动图检查,最后进行体外循环下心内病变矫治,尽量缩短体外循环和心脏停跳时间。本组患者中,共有48(16.2%)例患者在体外循环下接受手术,其中的17例为单纯心包剥脱,手术死亡2例,另外31例为心包剥脱合并心内其他病变矫治,手术死亡4例,死亡率分别为 12.5%,11.8%和 12.9%。
综上所述,心包剥脱术是治疗慢性CCP的唯一安全有效的手段,手术应尽可能地完全剥离,去除其病理基础,减少行二次手术的可能。年龄、术前房颤及再次剥脱术是影响患者MACCE事件的危险因素,多因素回归分析显示再次剥脱术是影响患者生存率的唯一独立危险因素。

