CXCR4和CXCR7在肾透明细胞癌组织中的表达及其临床意义
吕栋,滕志刚,周云飞,任选义
(河南省开封市中心医院 泌尿外科,河南 开封 475000)
趋化因子相对分子质量为10×103~12×103,是细胞因子超家族中具有化学趋化作用的小分子蛋白,现发现约50种趋化因子和约20种受体[1]。趋化因子与其相对应的受体结合后,在血管生成、胚胎发育、炎症和肿瘤等生理或病理过程中发挥作用。CHATTERJEE等[2]报道趋化因子受体与肿瘤的转移特性有关以来,更多研究发现趋化因子受体与肿瘤的发展密切相关。过去认为趋化因子受体4(chemokine receptor 4, CXCR4)是趋化因子基质细胞衍生因子1(stromal cell derived factor-1, CXCL12)的唯一受体,然而最近研究发现CXCL12尚存在趋化因子受体7(chemokine receptor 7, CXCR7) 这 一 新 的 受 体[3-4],CXCL12/CXCR7生物轴同样在肿瘤发展过程中起重要作用。因此本实验检测趋化因子受体CXCR4和CXCR7在肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)组织中的表达,并探讨其相关性,现报道如下。
1 资料与方法
1.1 临床资料
选取2010年9月-2015年8月在河南省开封市中心医院泌尿外科行手术切除且临床资料完整的50例肾癌患者,取其ccRCC组织标本。其中,男性28例,女性22例;年龄49~83岁,平均62.4岁。采用2004年世界卫生组织肾癌组织学分级方法:高、中分化32例,低分化18例。按照2010版UICC/AJCC的TNM分期系统进行临床分期:Ⅰ期16例,Ⅱ期14例,Ⅲ期12例,Ⅳ期8例;其中骨转移3例,淋巴结转移14例;外科切缘阴性46例,阳性4例。所有患者术前未行放、化疗。随机切取20例远离肾癌的正常肾组织作为对照,其中男性12例,女性8例;年龄49~83岁,平均67.4岁。
1.2 方法
使用免疫组织化学SABC三步法。一抗试剂CXCR4和CXCR7为浓缩型羊多克隆抗体,工作液浓度1∶100;二抗试剂为浓缩型兔抗羊多克隆抗体,稀释比例1∶200。兔抗人CXCR4一抗、兔抗人CXCR7一抗、兔抗SABC试剂盒及DAB显色剂由上海哈灵生物科技有限公司提供,所有标本用10%甲醛溶液固定,石蜡包埋,2~4μm连续切片。应用免疫组织化学SABC法检测,组织切片常规脱蜡,水化后经3%过氧化氢处理,加热抗原修复,按试剂盒说明书进行操作。所有实验均设阳性对照及阴性对照,用已知CXCR4、CXCR7表达的阳性图片作阳性对照,PBS代替一抗作为阴性对照。
免疫组织化学法阳性反应为黄棕色颗粒,阳性表达定位于细胞质或细胞膜。用半定量积分判断结果:①阳性细胞数≤10%为0分,10%~30%为1分,31%~60%为2分,61%~80%为3分,>80%为4分;②阳性强度:无着色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。将两者积分相乘,0分阴性(-),1~4分弱阳性(+),5~8分阳性(++),9~12分强阳性(+++)。将ccRCC组织标本及正常肾组织标本中CXCR4和CXCR7蛋白的表达水平进行比较,分析ccRCC组织中CXCR4和CXCR7的表达水平及其与患者临床病理学指标的相关性。
1.3 统计学方法
数据分析采用SPSS 13.0统计软件,计数资料以率(%)表示,比较用χ2检验或一致性检验,P<0.05为差异有统计学意义。
2 结果
2.1 CXCR4、CXCR7在ccRCC和癌旁组织中的表达
免疫组织化学法结果显示,CXCR4和CXCR7蛋白阳性表达于细胞浆和细胞膜,以细胞浆为主。ccRCC组织中,CXCR4和CXCR7蛋白含量升高。CXCR4在ccRCC组织中的阳性表达率为72%(36/50),在正常肾组织为10%(2/20);CXCR7在ccRCC组织中的阳性表达率为70%(35/50),在正常肾组织为15%(3/20),经χ2检验,差异有统计学意义(χ2=22.128和0.000,P=17.414和0.000)。见图1~3。
2.2 CXCR4、CXCR7与患者临床病理特征的关系
CXCR4、CXCR7蛋白的表达与患者年龄、性别、肿瘤大小等无相关性(P>0.05),与患者TNM分期、组织学分级及有无淋巴结转移关系密切(P<0.05)。见表1。
2.3 CXCR4、CXCR7在ccRCC组织中表达的相关性
CXCR4与CXCR7蛋白在ccRCC组织中的表达呈正相关(r=0.467,Kappa=0.740,P=0.001)。见表2。
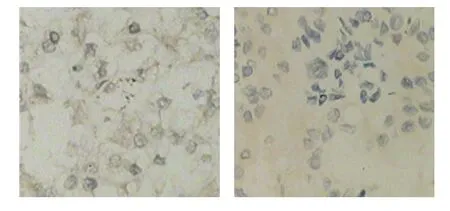
图1 CXCR4在ccRCC组织中阳性表达
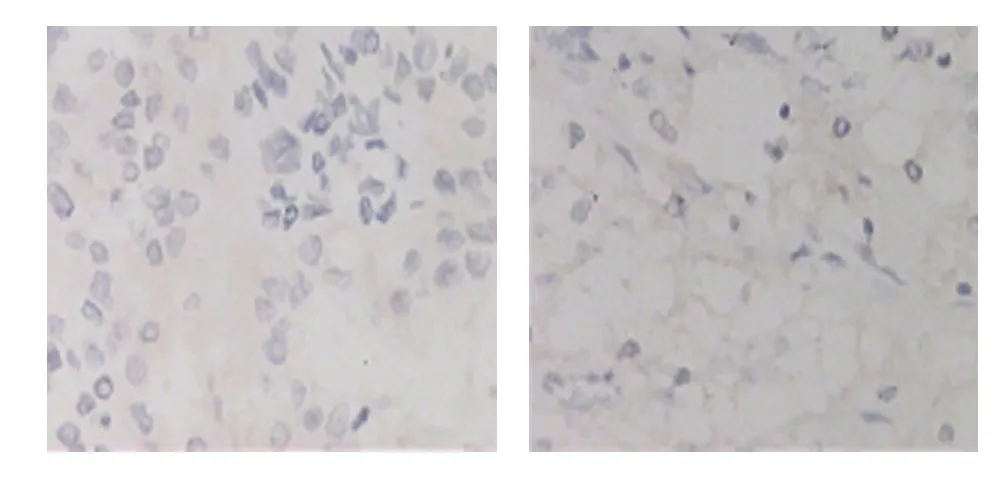
图2 CXCR4在正常肾组织中阴性表达
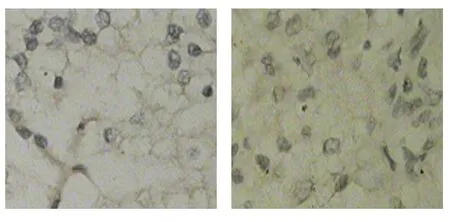
图3 CXCR7在ccRCC组织中阳性表达

表1 ccRCC患者临床病理特征与CXCR4、CXCR7蛋白表达的关系

表2 CXCR4、CXCR7在ccRCC组织中表达的相关性 例
3 讨论
CXCR4是有7个跨膜结构域的GTP-蛋白偶连的跨膜受体之一,在免疫系统和中枢神经系统的细胞中广泛表达[5]。不同的肿瘤高表达特异的趋化因子受体,肿瘤细胞借助趋化因子与受体的特异结合力,最终向这些器官特异性转移。CXCR4作为CXCL12的受体不仅表达于细胞浆,也可在细胞膜中检测到。CXCL12/CXCR4生物轴在多种恶性肿瘤的特定转移中起关键作用,在淋巴结、肺、肝及骨髓肿瘤常见的转移灶中均发现CXCL12/CXCR4高表达[6],但其在肾肿瘤组织中的研究甚少[7]。最近研究发现,CXCL12尚存在CXCR7受体,CXCL12/CXCR7生物轴同样在肿瘤发展过程中起重要作用[3-4,8]。CXCR7作为膜相关的受体蛋白,在多种肿瘤细胞、内皮细胞及胎肝细胞中高表达,在正常细胞中不表达。CXCR7在乳腺癌、宫颈癌、肺癌等多种肿瘤细胞株中高表达[9-11],但对肾肿瘤的研究甚少。目前,CXCR4和CXCR7在肾肿瘤发生、发展过程中的作用尚不明确。本研究发现,CXCR4在ccRCC组织中呈高表达,其阳性率为72.0%,相比癌旁肾组织,CXCR4蛋白表达升高。同样CXCR7在ccRCC组织中的阳性表达率为70%,高于正常肾组织的15%。尤其重要的是,本实验结果表明CXCR4、CXCR7的阳性表达与患者TNM分期、组织学分级及有无淋巴结转移关系密切,与患者的性别、年龄及肿瘤大小无关。本组资料显示,随着ccRCC细胞的恶性程度升高和分化变差,CXCR4和CXCR7蛋白的阳性表达水平逐渐升高;同样随着浸润深度增加和淋巴结转移的发生,即进展期ccRCC组织中CXCR4和CXCR7蛋白的阳性表达率升高。据此推测,CXCR4和CXCR7可能作为促癌基因发挥作用,其高表达与肾肿瘤分期、分级及恶性发展进程相关,可用来推断ccRCC的预后。本实验结果表明,CXCR4与CXCR7蛋白在ccRCC组织中表达呈正相关,两者共阳性表达30例(60%,30/50),提示两者可能通过CXCL12/CXCR4/CXCR7生物轴,借助于某种复杂的信号转导机制,协同作用于ccRCC的发生、发展及转移,其具体机制尚需研究。
本研究认为,CXCR4、CXCR7在ccRCC组织中高表达,其与ccRCC TNM分期和组织学分级关系密切,联合检测2种蛋白的表达可作为判断ccRCC预后的生物学指标。

