冷藏小黄鱼优势腐败菌致腐能力评价 及其对挥发性成分的影响
黄佳奇,葛雨珺,向迎春,余海霞,杨水兵,胡亚芹,,*
(1.浙江大学生物系统工程与食品科学学院,浙江杭州 310058; 2.浙江大学舟山海洋研究中心,浙江舟山 316021)
小黄鱼是中国四大海产品之一,作为一种高蛋白低脂肪食物受到广大消费者的青睐,根据渔业年鉴,2014~2017年,其产量均维持在35万吨上下,但自然捕捞上来的小黄鱼经过剧烈挣扎,很大一部分带有明显的机械损伤,鱼鳃和内脏处粘液是天然的微生物培养基,很容易滋生多种腐败微生物和病原菌体型,而小黄鱼体型较小,比表面积大,更容易受微生物污染而腐败变质。据估计,每年有高达25%的水产品在捕获后由于腐败微生物作用而被迫丢弃[1],因其而产生的小黄鱼经济损失在10~20亿元人民币。因此,采用合适的方法抑制微生物的代谢活动对保持小黄鱼的品质至关重要。
优势腐败菌是指贮藏初期数量和种类并不占明显优势,但随着贮藏时间的延长而大量繁殖的腐败微生物[2]。优势腐败菌将肌肉组织中的蛋白质、氨基酸及其它含氮物质分解成挥发性胺类和硫化物等,使水产品散发出具有腐败特征的臭味,如腐败希瓦氏菌(Shewanellaputrefaction)侵染大黄鱼会使其产生强烈的腐臭味,严重影响其感官品质[3]。目前有关小黄鱼优势腐败菌的研究非常少。
在水产品新鲜度的感官评价中,气味所占的比例往往高于其他指标,达到30%以上[4-5]。不同类型的优势腐败菌由于其代谢方式的不同,产生的腐败挥发性成分种类和含量也有较大的差异[6]。现在有关优势腐败菌致腐能力的评价很大部分以挥发性盐基氮(Total volatile basic nitrogen,TVB-N)为主,存在一定的片面性。
本课题以小黄鱼及其优势腐败菌为原料,探究4 ℃冷藏小黄鱼的优势腐败菌种类及其对腐败挥发性成分的影响,并探究全面评价优势腐败菌致腐能力的指标,为后期建立优势腐败菌生长模型、靶向抑菌和小黄鱼质量快速检测提供理论依据。
1 材料与方法
1.1 材料与仪器
舟山小黄鱼(70~90 g/尾) 取自浙江省舟山市沈家门码头,选取的小黄鱼外形完整,色泽明亮,无机械损伤,用泡沫箱碎冰包装并在5 h内运输至杭州;变形杆菌属(Proteushauseri,P.hauseri)、普罗威斯登菌属(Providenciaheimbachae,P.heimbachae)、希瓦氏菌属(Shewanellaglacialipiscicola,S.glacialipiscicola) 实验室自分离优势腐败菌,保存于-80 ℃;大豆酪蛋白琼脂培养基(Soybean-Casein Digest Agar Medium,TSA)、假单胞CFC选择性培养基(Pseudomonas CFC Selective Agar,CFC)、结晶紫中性红胆盐葡萄糖琼脂(Violet Red Bile Glucose Ager,VRBGA) 青岛海博生物技术有限公司;环己酮 色谱纯,阿拉丁试剂有限公司;高纯氦气(>99.9%) 杭州今工特种气体有限公司。
SW-CJ-1FD型超净台 南京苏净安泰空气技术有限公司;I Mix型均质机 法国InterLab有限公司;5418R型冷冻离心机 德国Eppendorf公司;K9860型全自动凯氏定氮仪 山东海能仪器有限公司;固相微萃取(solid-phase micro-extraction,SPME)DVB/CAR/PDMS萃取头 美国Supelco公司;DB-5毛细管色谱柱(30 m×250 μm,0.25 μm) 美国Agilent公司。
1.2 实验方法
1.2.1 无菌鱼块制备 参考Herbert等[7]的方法并稍作改动。4 ℃解冻小黄鱼后,去头、尾、鳞、内脏后清洗,在无菌超净台中将小黄鱼块放在灭菌的砧板上,并切成约2 cm×1 cm×0.5 cm的鱼块,在75%的乙醇中浸泡10 s后捞起自然挥发,并用无菌蒸馏水再次清洗,使鱼体表面菌落数小于2 lg CFU/g。
1.2.2 菌悬液制备 单菌液的制备参考李学英等[8]的方法并稍作改动。将先前冷冻保藏的3株冷藏小黄鱼优势腐败菌冻存液在37 ℃水浴中活化15 min,并在营养琼脂中划线培养复壮后,将变形杆菌属Proteushauseri于VRBGA培养基中划线37 ℃培养、普罗威斯登菌属Providenciaheimbachae于VRBGA培养基中划线37 ℃培养、希瓦氏菌属Shewanellaglacialipiscicola于CFC培养基中划线37 ℃培养。挑取典型单菌落于50 mL营养肉汤中,37 ℃下培养12 h,4000 r/min离心后弃上清液,并用无菌生理盐水调整细菌悬液浓度至6~6.5lg CFU/g范围。
1.2.3 单优势腐败菌接种 将上述制备的无菌鱼块及单菌菌悬液置于超净台中。将小黄鱼块浸泡于稀释菌液中,10 s后取出,放置于无菌培养皿中,每个菌株接种30个小黄鱼块,以无菌小黄鱼块作对照,4 ℃冰箱保存。
1.2.4 菌落总数测定 菌落总数测定参考GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》[9]。取小黄鱼肉5.00 g于无菌均质袋中,加入45 mL生理盐水后用均质器拍打3 min,制备1∶10 (g∶mL)样品匀液,并依次做10倍梯度稀释。取1 mL适宜稀释度的样品稀释液,用相应的培养基倾注混匀,于37 ℃培养24 h,每个稀释度3组平行。
1.2.5 TVB-N值测定 TVB-N值测定参考唐文静等[10]的方法并稍做改动。取3.00 g小黄鱼块于50 mL离心管中,加入27 mL,0.6 mol/L HClO4溶液,冰浴下匀浆1 min,4000 r/min离心10 min,取10 mL上清液于全自动凯氏定氮仪内测定,每个样品做3组平行。
1.2.6 致腐能力测定 参考李学英等[8]的方法,以产量因子YTVB-N/CFU为指标,即以冷藏小黄鱼感官评价终点时单位优势腐败菌产生的腐败代谢产物的量为腐败菌腐败能力指标,计算公式如下。
式中,Ns、N0分别为初始菌落数和感官终点时的菌落数(CFU/g);(TVB-N)s、(TVB-N)0分别为货架期初始点及终点的TVB-N含量(mg N/100 g)。
1.2.7 SPME及GC-MS分析 参考刘源等[11]和Mikškrajnik等[5]的方法并做适当修改。称取2.00 g样品于15 mL萃取小瓶中,加入5 mL饱和氯化钠溶液及20 μg/mL环己酮溶液。55 ℃条件下水浴平衡10 min后将经老化的SPME头插入封口顶空采样,吸附30 min后拔出并再将萃取针头插入气相色谱仪进样口,250 ℃条件下解析3 min。
参考汪倩等[12]的方法并做适当修改。以DB-5柱(30 m×0.25 mm,0.25 μm)为毛细管柱,以高纯氦气为载气,恒定流速为1.2 mL/min。升温程序为起始温度40 ℃,保持5 min,以5 ℃/min速率升到160 ℃,保持5 min,再以10 ℃/min的速率升到250 ℃,保持5 min。进样口温度为250 ℃。以全扫描模式采集信号,电子轰击能量为70 eV;接口温度为270 ℃,离子源温度为230 ℃,四极杆温度为150 ℃,扫描质量范围45.00~500.00 u,扫描频率3.47/s。
1.3 数据处理
使用SPSS 22.0和Excel 2013软件进行方差分析,以p<0.05表示差异显著;GC-MS数据对照已知的环己酮含量及其峰面积计算得到,以μg/g为单位。
2 结果与分析
2.1 菌落总数和TVB-N值的变化
4 ℃贮藏下定期取样测定菌落总数如图1所示,初期接种浓度为6~6.5lg CFU/g,期间各腐败菌呈现出类似的增长趋势,贮藏前2 d菌落总数维持在恒定的水平,一方面可能无菌鱼块有残留酒精,另一方面可能是微生物的停滞期[13],即初始微生物在37 ℃下的肉汤中扩增培养,而接种后需要时间来适应较低的环境温度和不同的营养介质。第2~8 d菌落总数呈现快速增长,到第8 d之后增速放缓,最后均趋向于9lg CFU/g水平。

图1 3种优势腐败菌接种鱼块菌落总数随贮藏时间的变化Fig.1 Changes of total viable counts of 3 kinds of SSOs
各优势腐败菌影响下冷藏小黄鱼TVB-N值变化如图2所示。小黄鱼初始TVB-N值为(8.953±2.017) mgN/100 g,并随贮藏时间逐渐增大,至贮藏后期P.hauseri、P.heimbachae和S.glacialipiscicola接种鱼块分别达到(88.383±7.752)、(75.173±5.220)和(92.583±7.130) mgN/100 g。贮藏期间TVB-N值与腐败微生物的生长具有密切关系[14-15],虽然自身酶、冷藏等因素也会影响其值大小,但影响力还远不到十分可观的程度[16]。以30 mg N/100 g为水产品的TVB-N值上限,在贮藏第4d时,所有接种优势腐败菌的小黄鱼鱼块均达到腐败,表明3种菌株都有着较强的致腐能力。不同水产品TVB-N值变化与优势腐败菌也密切相关,唐文静等[17]发现4 ℃冷藏海鲈鱼在接种腐败希瓦氏菌后在贮藏第8 d的TVB-N值超过100 mg N/100 g,而徐振伟等[18]发现在接种腐败希瓦氏菌后冷藏鲤鱼和罗非鱼在贮藏第8 d的TVB-N值仅为50 mg N/100 g。

图2 3种优势腐败菌接种鱼块TVB-N随贮藏时间的变化Fig.2 Changes of TVB-N values inoculated by 3 kinds of SSOs
2.2 TVB-N产量因子分析
不同腐败菌利用分解蛋白质产生的代谢物不同,引起肉品腐败的程度和特性也不同,由此可反映不同优势腐败菌致腐能力的差异[19]。以TVB-N产量因子作为优势腐败菌致腐能力的定量分析指标,结果见表1。P.hauseri和S.glacialipiscicola的YTVB-N/CFU值相仿,P.heimbachae的YTVB-N/CFU值要小于其它两株优势腐败菌。
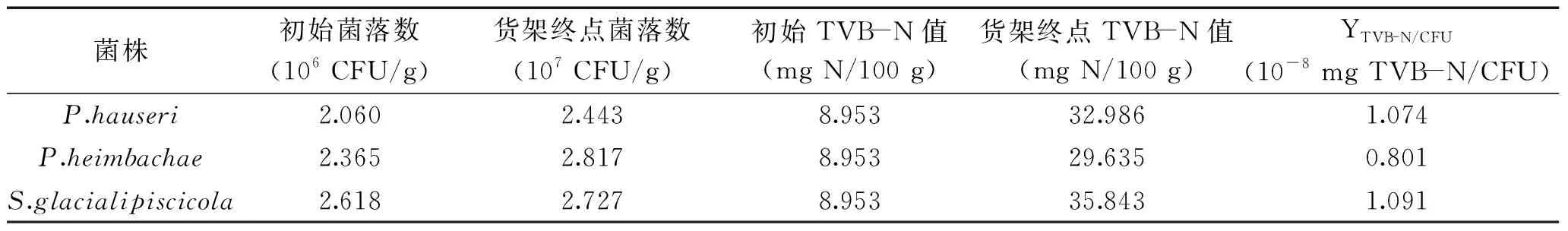
表1 3种优势腐败菌的TVB-N产量因子Table 1 Yield factors of TVB-N of specific spoilage organisms
综上,通过YTVB-N/CFU得出冷藏小黄鱼优势腐败菌致腐能力最强的为P.hauseri和S.glacialipiscicola,P.heimbachae较弱。本实验各优势腐败菌YTVB-N/CFU值与之前的研究在同一数量水平,刘爱芳等[20]测定的冷藏金枪鱼各优势腐败菌YTVB-N/CFU差异为298%,徐振伟等[18]测定的冷藏鲤鱼和罗非鱼各优势腐败菌YTVB-N/CFU差异为394%,本实验3株优势腐败菌致腐能力差异在36%以内,与先前感官评价初筛一轮腐败菌有关。
2.3 GC-MS分析
顶空SPME是利用萃取针内部纤维提取浓缩挥发性成分,随后将吸附的气体解析进入GS-MS仪,可以对气味产生物质进行定性和定量分析[21]。从P. hauseri接种黄鱼块中累计分离鉴定出40种挥发性成分,P. heimbachae 39种,S. glacialipiscicola 37种,各类挥发性成分总含量变化如图3所示。
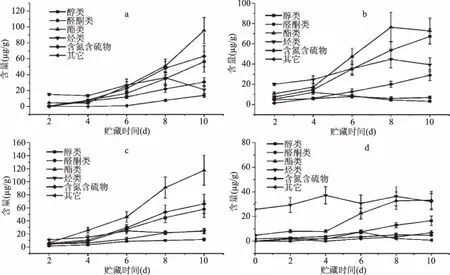
图3 3种优势腐败菌接种鱼块各类挥发性成分变化情况Fig.3 Changes of volatile organic compounds produced by specific spoilage organisms注:a:P. hauseri;b:P. heimbachae;c:S. glacialipiscicola;d:对照。
从图3中可以看到接菌鱼块的挥发性成分主要为醇类、醛酮类、酯类、烃类、含氮含硫物和其它含苯挥发物。初始贮藏时,鱼块的挥发物总含量为(37.164±7.060) μg/g,以烃类为主,约占挥发物总量的70%。至贮藏第10 d,P.hauseri,P.heimbachae和S.glacialipiscicola接种鱼块的挥发物总含量分别为(280.913±55.652)、(218.548±33.952)和(301.835±59.450) μg/g,以醇类、酯类为主。醇类的产生途径包括氨基酸代谢、甲基酮的还原、多不饱和脂肪酸过氧化及醛类的还原等[22-23],3种腐败菌接种鱼块醇类含量呈稳步上升趋势,至第10 d均介于50~70 μg/g范围,醇类气味阈值较高,对气味的贡献度较小。醛酮类主要来源于脂肪氧化及氨基酸转氨作用等[24],3种腐败菌接种鱼块的醛种类较少,且贮藏期间总含量均在10 μg/g以下,由于醛类普遍含量较低,且在贮藏期间极易氧化成酸类,因此多数情况下很难与腐败菌进行很好的关联[25]。3种优势腐败菌接种鱼块的挥发性成分中,酯类的种类最多,所占比例最大,浓度变化幅度最大。从P.hauseri接种鱼块中检测到15种酯类,P.heimbachae17种,S.glacialipiscicola14种,贮藏第10d总含量分别为(72.680±12.807),(95.485±16.335)和(117.399±22.746) μg/g,有研究报道显示单菌接种肉类更易产生酯类化合物,且其含量占主导地位[26],而在自然腐败下,酯类产生量相对较少。总体而言酯类物质虽然含量高,但对气味的贡献度不大,且多数情况下感官感受偏向积极。烃类主要为C10到C19的中链烷烃,且接菌鱼块和无菌鱼块烃类总含量随贮藏时间均维持在20~40 μg/g范围内,目前普遍的观点是烃类产生源于食品自身的理化变化,而非微生物的作用[25]。苯及其衍生物的含量很大程度上与小黄鱼的食物来源有关[27],个体差异较为显著。
含硫化合物和含氮化合物通常具有极低的气味阈值低,是腐臭味的主要来源。两种含硫化合物在P.hauseri、P.heimbachae和S.glacialipiscicola贮藏第10 d接种鱼块总含量分别达到(5.503±1.135)、(2.058±0.353)和(12.386±3.07) μg/g。含硫化合物主要来自含硫氨基酸(甲硫氨酸和半胱氨酸)的分解,此次研究中发现的二甲基二硫和二甲基三硫出现在腐败菌接种第4 d后,虽然含量维持在较低的水平,但较低的气味阈值使得这两种含硫化合物具有硫磺味和洋葱刺激味[28],两种含硫化合物也是大黄鱼的特征腐败挥发物[29],表明分解含硫氨基酸能力方面S.glacialipiscicola最强,P.hauseri次之,P.heimbachae最弱,希瓦氏菌属较强的致腐能力体现之一即为能高效分解含硫氨基酸释放挥发性硫[30],因此S.glacialipiscicola接种鱼块的含硫挥发物含量远远高于其它两组接种鱼块。含氮化合物主要为吲哚和三甲胺,属于特征腐败挥发物,在猪肉[31]、三文鱼[5]等腐败过程中均有报道,在3种优势腐败菌接种下这两种物质含量随贮藏时间发生显著的升高。吲哚在P.hauseri、P.heimbachae和S.glacialipiscicola贮藏第10 d接种鱼块中的含量分别达到(37.448±6.905)、(15.718±2.737)和(47.228±8.571) μg/g,吲哚由色氨酸酶以5′-磷酸吡哆醛为辅酶催化L-色氨酸产生,吲哚的产生受内源酶和外在环境的双重影响,温度、pH、胞外色氨酸水平等环境因子影响色氨酸酶的活性[32],因此相同条件下P.hauseri和S.glacialipiscicola的色氨酸酶活性要显著强于P.heimbachae,与产量因子计算结果一致。三甲胺在P.hauseri、P.heimbachae和S.glacialipiscicola贮藏第10 d接种鱼块中的含量分别达到(13.903±3.851)、(6.930±1.181)和(12.881±3.334) μg/g,氧化三甲胺是体现海产品特色鲜味成分物质,鱼体死亡后体内氧化三甲胺经微生物氧化三甲胺还原酶还原得到三甲胺,是腐败恶臭成分之一。氧化三甲胺还原酶在多种海洋细菌和肠道细菌中被发现,S.glacialipiscicola为典型的海洋细菌,而P.hauseri和P.heimbachae为典型的肠杆菌,但酶活存在较大差异,相同条件下P.hauseri和S.glacialipiscicola的氧化三甲胺还原酶活性显著强于P.heimbachae,也与产量因子计算结果一致。综上所述,在腐败味贡献方面,S.glacialipiscicola最强,P.hauseri次之,P.heimbachae最弱。
苯酚主要的来源为含苯氨基酸(酪氨酸、苯丙氨酸和色氨酸)的降解,在猪肉、牛肉和草鱼中都作为腐败特征性挥发物[33-35],但其对腐败气味的贡献度不大,苯酚在P.hauseri接种鱼块中没有检测到,在P.heimbachae接种鱼块中含量较低,贮藏期间含量在1~6 μg/g范围,而在S.glacialipiscicola接种鱼块中含量逐渐上升,至第10 d达到(17.947±2.227) μg/g,表明在分解芳香族氨基酸方面S.glacialipiscicola要显著强于P.heimbachae(p<0.05)。
2.4 TVB-N与挥发性成分相关性分析
腐败代谢产物,如TMA、TVB-N、组胺等其它与腐败有关的代谢产物,其产量因子可作为评价肉类腐败菌腐败能力的定量指标[3,36]。以TVB-N值为参考指标,将各优势腐败菌接种下小黄鱼含氮含硫挥发物与对应的TVB-N值做相关性分析,结果如表2至表4所示。P.hauseri接种下冷藏小黄鱼的三甲胺含量、二甲基二硫含量和二甲基三硫含量与TVB-N值呈极显著相关(p<0.01),而吲哚含量与TVB-N值呈显著相关(p<0.05);P.heimbachae接种下冷藏小黄鱼的吲哚含量、三甲胺含量和二甲基二硫含量与TVB-N值呈极显著相关(p<0.01);S.glacialipiscicola接种下冷藏小黄鱼的三甲胺含量、二甲基二硫含量和二甲基三硫含量与TVB-N值呈极显著相关(p<0.01),而吲哚含量与TVB-N值呈显著相关(p<0.05),表明吲哚、三甲胺、二甲基二硫和二甲基三硫作为腐败有关代谢产物可以很好地反应出小黄鱼的新鲜度,理论上可以代替TVB-N值进行优势腐败菌致腐能力的评价。本研究中,优势腐败菌接种鱼块的气味物质含量有着较大的差异,如以含硫物质作为致腐能力评价指标,主要表明优势腐败菌在分解含硫氨基酸能力的差异,TVB-N值作为一个综合性腐败化学指标,更多的表明优势腐败菌综合性的致腐能力,而两者配合能更加全面和深入地反映优势腐败菌的致腐能力。

表2 P. hauseri接种鱼块TVB-N值与挥发性成分的相关性系数Table 2 Correlation coefficient of TVB-N value and VOC of little yellow fish inoculated by strain P. hauseri

表3 P. heimbachae接种鱼块TVB-N值与挥发性成分的相关性系数Table 3 Correlation coefficient of TVB-N value and VOC of little yellow fish inoculated by strain P. heimbachae

表4 S.glacialipiscicola接种鱼块TVB-N值与挥发性成分的相关性系数Table 4 Correlation coefficient of TVB-N value and VOC of little yellow fish inoculated by strain S.glacialipiscicola
3 结论
产量因子计算结果表明变形杆菌属P.hauseri和希瓦氏菌属S.glacialipiscicola致腐能力相当,普罗威斯登菌属P.heimbachae略逊。挥发性成分结果显示3种优势腐败菌产生的气味物质主要为吲哚、三甲胺、二甲基二硫和二甲基三硫,S.glacialipiscicola产生的气味物质的总量大于P.hauseri大于P.heimbachae。进一步分析发现气味物质含量变化与对应的TVB-N值呈显著相关,一方面可比TVB-N值更全面地衡量优势腐败菌的致腐能力,另一方面通过建立TVB-N值与这些腐败挥发物的联系,可直接利用生物传感器检测挥发性成分中的这些特征挥发物,进而可实现水产品工业中的小黄鱼新鲜度的快速质量控制[5]。

