类胡萝卜素清除自由基活性构效关系
刘科梅,邬子彬,胡基志,陆 豫,余 勃,*
(1.南昌大学资源环境与化工学院,江西南昌 330031; 2.南昌大学化学学院,江西南昌 330031; 3.中德联合研究院,江西南昌 330047)
类胡萝卜素(carotenoids)普遍存在于绿色植物中,是多叶蔬菜中主要的抗氧化物之一。它作为一种天然抗氧化物,功能多样,被广泛运用于医药、食品、化妆等行业。类胡萝卜素与人们的身体健康密切相关,具有保护视力、提高机体免疫力、抑制或缓解心血管疾病、维持畜禽正常生长与繁殖等功能[1-3]。现代医学研究表明,自由基过量与人类大部分常见的疾病有关[4-5],类胡萝卜素可与自由基发生反应,形成无害的产物,或通过破坏自由基链的反应,将自由基清除,从而有效地抑制或是缓解这些疾病的发生[6]。
类胡萝卜素是具有多个共轭双键的萜烯基团类化合物,主要分为烃类胡萝卜素与含氧衍生物两种[7-8]。由于其多带一个或两个端环,从环的结构与数目而言,又可分为直链分子与带环分子两种。直链分子如番茄红素、六氢番茄红素、八氢番茄红素;而带环分子根据环上基团结构及数目的不同,分为碳氢类胡萝卜素(α-胡萝卜素、β-胡萝卜素)、羟基类胡萝卜素(叶黄素、玉米黄素、β-隐黄质)、酮基类胡萝卜素(角黄素、海胆酮)、α-羟基-酮基类胡萝卜素(虾青素)、羟基-环氧基类胡萝卜素(紫黄素、花药黄质)等[9-10]。基本结构以α-胡萝卜素为例,见图1。
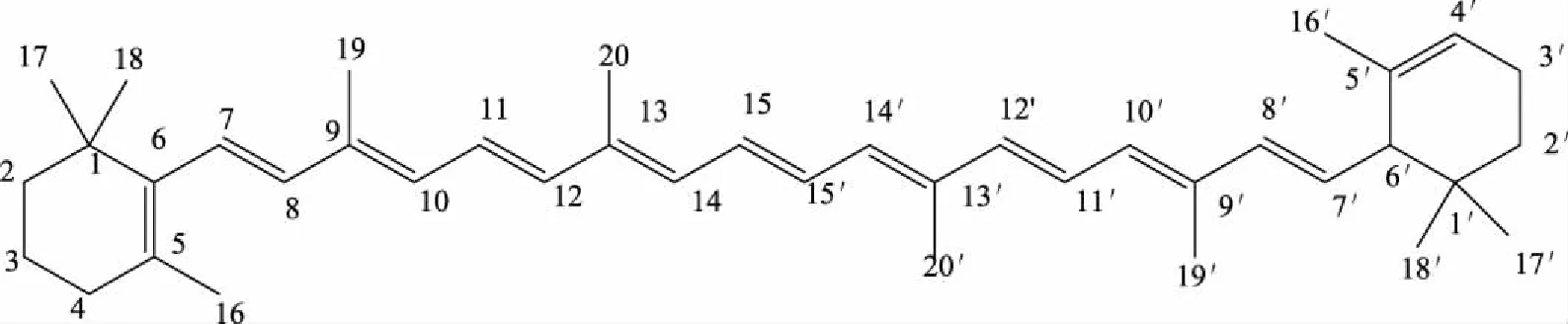
图1 α-胡萝卜素Fig.1 α-carotene
目前,对于类胡萝卜素的生物学功能、合成以及抗氧化等方面的研究较多;但运用量子化学计算类胡萝卜素,从理论角度探讨其抗氧化活性的研究仍较少。将理论结果与类胡萝卜素抗氧化能力实际测定结果结合起来,是分析其自由基清除能力构效关系很好的研究方法。本文通过量子化学方法对13种类胡萝卜素进行理论计算,同时使用四种自由基清除方法测定β-胡萝卜素、番茄红素、叶黄素、虾青素的自由基清除能力,理论分析结合实际试验,从中探讨类胡萝卜素的结构对其自由基清除能力的影响。
1 材料与方法
1.1 材料与仪器
β-胡萝卜素标品(97%) 美国Sigma公司;虾青素(98%)、叶黄素(90%)、番茄红素(98%)标品 北京瑞尼克生物科技有限公司;1,1-二苯基-2-苦基肼基自由基(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH) 梯希爱(上海)化成工业发展有限公司;2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(Agreement of basic telecommunications services,ABTS) 美国Sigma公司;水杨酸、过硫酸钾、FeSO4·7H2O、Tris-HCl 缓冲液(pH=8.0)、邻苯三酚 天津市大茂化学试剂厂;二甲基亚砜(Dimethyl sulfoxide,DOMSO)、乙醇、甲醇、盐酸等 均为国产分析纯。
TU-1810PC紫外可见光分光光度计 北京普析公司;T型恒温水浴锅 德国LAUDA公司;ER-180A型电子分析天平 日本AND公司;Multiskan spectrum全波长酶标仪 Thermo Scientific公司;Gaussian 09软件 南昌大学高等研究院。
1.2 实验方法
1.2.1 ABTS自由基清除能力的测定 参考Tang等[11]的实验方法。将0.0038 mg/mL ABTS、0.00067 mg/mL过硫酸钾按1∶1体积比混合,室温避光12~16 h后稀释40倍待用。取ABTS 4 mL,分别加入0.2、0.4、0.6、0.8、1.0 mg/mL用DMSO溶解的β-胡萝卜素、番茄红素、叶黄素及虾青素200 μL,混匀后用紫外分光光度计在734 nm下测定吸光度。对照组以相同体积的甲醇代替ABTS,空白组以相同体积的DMSO代替样品。
式中:A0为空白组的吸光度;Ai为样品组的吸光度;Aj为对照组的吸光度。
1.2.2 DPPH自由基清除能力的测定 参考尹蔷[12]、Kim等[13]的实验方法。配制0.0394 mg/mL的DPPH溶液待用。取0.30、0.45、0.60、0.75、0.90 mg/mL用DMSO溶解的β-胡萝卜素、番茄红素、叶黄素及虾青素20 μL与3 mL DPPH液混合均匀,使用酶标仪在519 nm下测定吸光值。对照组以相同体积的乙醇代替DPPH,空白组以相同体积的DMSO代替样品。
式中:A0为空白组的吸光度;Ai为样品组的吸光度;Aj为对照组的吸光度。
1.2.3 羟自由基清除能力的测定 参考Wang[14]等的实验方法。在96孔板上加入1.24 mg/mL的水杨酸溶液10 μL、2.5 mg/mL的硫酸亚铁溶液10 μL、超纯水200 μL,再分别加入15 μL浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL用DMSO溶解的β-胡萝卜素、番茄红素、叶黄素及虾青素,最后加入10μL 0.03%的H2O2启动反应。使用酶标仪37 ℃孵育15 min后,在510 nm下测定吸光值。对照组用同等体积的超纯水代替H2O2,空白组用同等体积的DMSO代替样品。
式中:A0为空白组的吸光度;Ai为样品组的吸光度;Aj为对照组的吸光度。
1.2.4 超氧阴离子自由基清除能力的测定 参考Zhang[15]等的实验方法。将0.05 mol/L 的Tris-HCl缓冲液(pH=8.0)、样品液、1.26 mg/mL的邻苯三酚液置于25 ℃水浴中预热20 min。取Tris-HCl 3 mL、邻苯三酚液200 μL混合,并分别加入0.2、0.4、0.6、0.8、1.0 mg/mL用DMSO溶解的β-胡萝卜素、番茄红素、叶黄素及虾青素200 μL,混匀后于25 ℃水浴中准确反应5 min。最后加入300 μL 10 mol/L盐酸终止反应,在320 nm处测定吸光值。对照组以同等体积的HCl代替邻苯三酚,空白组以同等体积的DMSO代替样品。
超氧阴离子自由基清除率S(%)=[A0-(Ai-Aj)]/A0×100
式中:A0为空白组的吸光度;Ai为样品组的吸光度;Aj为对照组的吸光度。
1.2.5 相关量化理论参数的计算方法 通过Gaussian view软件构建β-胡萝卜素、虾青素、叶黄素、番茄红素、六氢番茄红素、八氢番茄红素、α-胡萝卜素、β-隐黄质、玉米黄素、海胆酮、角黄素、花药黄质、紫黄素十三种类胡萝卜素的分子模型,运用Gaussian 09程序中的半经验法AM1对分子模型进行初步优化,再利用密度泛函法B3LYP/6-311G(d,p)基组对初步优化的构型进行全几何构型优化并进行频率分析,直至无虚频产生得到优势构型[16-17]。得到需要的优势构象后,最后通过密度泛函法计算其能量,得到前线轨道能级差、原子净电荷分布等相关量化理论参数。以上计算均采用Gaussian09程序软件完成,计算平台由南昌大学高等研究院高性能计算集群(浪潮天梭TS10000)提供。
1.3 数据统计分析
每个结果重复处理3次,并采用Excel软件制图。实验数据采用SPSS 19.0软件处理,其中p<0.05表示存在显著性差异。
2 结果与分析
2.1 4种类胡萝卜素自由基清除能力的测定结果
选取了β-胡萝卜素、叶黄素、虾青素、番茄红素进行自由基清除能力测定,这4种类胡萝卜素均是常见的类胡萝卜素[18]。
2.1.1 4种类胡萝卜素的DPPH自由基清除能力 根据图2可知,4种类胡萝卜素的DPPH自由基清除率差异显著,且虾青素的DPPH自由基清除率远远高于其他几种类胡萝卜素(p<0.05)。β-胡萝卜素在0.45、0.75、0.9 mg/mL的自由基清除率无显著性差异(p>0.05),叶黄素与番茄红素在0.45、0.6、0.75、0.9 mg/mL的自由基清除率无显著性差异(p>0.05),而虾青素在0.45、0.6 mg/mL的DPPH自由基清除率与其他三组浓度具有显著性差异(p<0.05)。4种类胡萝卜素的DPPH自由基清除能力顺序为:虾青素>番茄红素>叶黄素>β-胡萝卜素。

图2 4种类胡萝卜素的DPPH自由基清除率Fig.2 DPPH free radical scavenging rate of 4 carotenoids注:小写字母不同表示相同浓度不同种类胡萝卜素间差异 显著(p<0.05);大写字母不同表示相同种类胡萝卜素 不同浓度间差异显著(p<0.05);图3~图5同。
2.1.2 4种类胡萝卜素的ABTS自由基清除能力 由图3可知,虾青素的ABTS自由基清除率最高,而β-胡萝卜素在浓度达到0.4 mg/mL后,ABTS自由基清除率显著小于其他3种类胡萝卜素(p<0.05)。与浓度为0.2 mg/mL时相比,叶黄素与番茄红素的ABTS自由基清除率随浓度变化较大;浓度为0.2 mg/mL时,叶黄素的ABTS自由基清除率显著大于番茄红素(p<0.05);随着浓度逐渐增大,两者清除率差距逐渐减小,1 mg/mL浓度下,番茄红素与叶黄素的ABTS自由基清除率无显著性差异(p>0.05)。四种类胡萝卜素ABTS自由基清除能力顺序为:虾青素>番茄红素≥叶黄素>β-胡萝卜素。
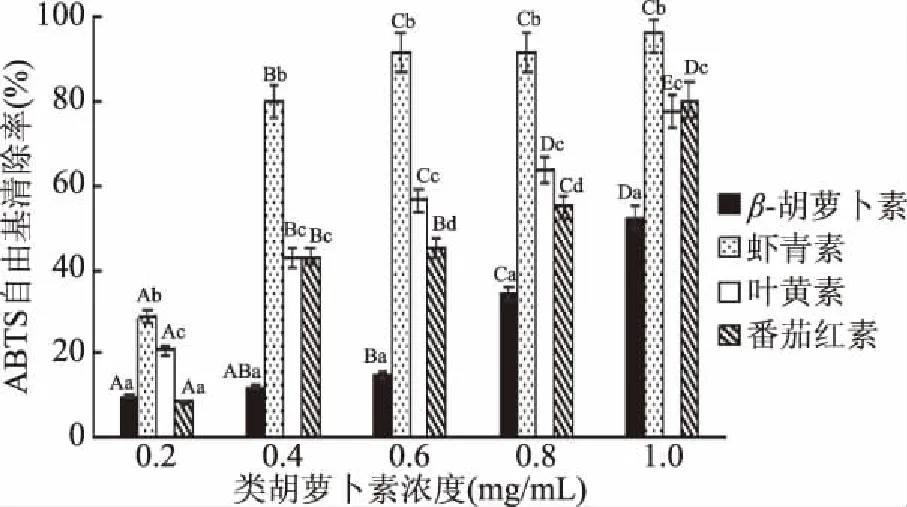
图3 4种类胡萝卜素的ABTS自由基清除率Fig.3 ABTS free radical scavenging rate of 4 carotenoids
2.1.3 4种类胡萝卜素的超氧阴离子自由基清除能力 由图4可知,浓度对虾青素的超氧阴离子自由基清除率影响非常大,在0.2 mg/mL浓度下,番茄红素的超氧阴离子自由基清除率显著高于其他3种类胡萝卜素(p<0.05);浓度为到1 mg/mL时,虾青素与番茄红素的超氧阴离子自由基清除率无明显差异(p>0.05)。β-胡萝卜素在0.4、0.6、0.8 mg/mL浓度下自由基清除率无显著性差异(p>0.05)。叶黄素在0.6、0.8 mg/mL浓度下的自由基清除率显著高于0.2、0.4 mg/mL,在1.0 mg/mL浓度下显著高于0.6、0.8 mg/mL。而四种类胡萝卜素超氧阴离子自由基清除能力顺序为:虾青素≥番茄红素≥叶黄素>β-胡萝卜素。
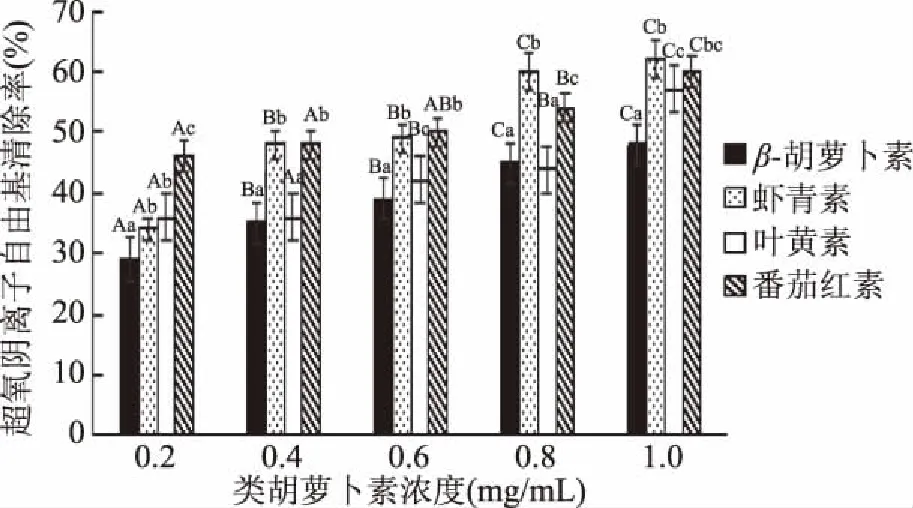
图4 4种类胡萝卜素的超氧阴离子自由基清除率Fig.4 Superoxide anion free radical scavenging rate of 4 carotenoids
2.1.4 4种类胡萝卜素的羟自由基清除能力 由图5知,0.2 mg/mL浓度下,虾青素与叶黄素的羟自由基清除率较高,但两者差异不显著(p>0.05);0.4 mg/mL浓度下,虾青素的自由基清除率最高;0.6~1.0 mg/mL浓度下,虾青素与番茄红素的羟自由基清除率远远高于叶黄素与β-胡萝卜素(p<0.05)。4种类胡萝卜素羟自由基清除能力顺序为:虾青素≥番茄红素≥叶黄素>β-胡萝卜素。

图5 4种类胡萝卜素的羟自由基清除率Fig.5 Hydroxyl radical scavenging rates of 4 carotenoids
4种类胡萝卜素中,番茄红素属于直链式类胡萝卜素;β-胡萝卜素属于碳氢类胡萝卜素;叶黄素属于羟基类胡萝卜素,含2个羟基;虾青素属于α-羟基-酮类胡萝卜素,含2个羟基及2个酮基。其共轭双键数目为:虾青素13个>番茄红素11个>叶黄素10个=β-胡萝卜素10个。
根据图2~图5可知,对于不同种类的自由基,类胡萝卜素的清除能力具有较大差异。结合四种自由基清除能力测定方法,可得出结论,总体上虾青素的自由基清除能力最强,其次是番茄红素、叶黄素,β-胡萝卜素最弱,这与它们的共轭双键数目排序一致,表明共轭双键数目越多,类胡萝卜素的自由基清除活性越高;对比β-胡萝卜素与叶黄素,发现端环上的羟基提高了类胡萝卜素的自由基清除活性。可见,共轭双键数目及其端环上的基团都是影响类胡萝卜素自由基清除能力的重要参数。
本试验得到的结果与袁磊[19]研究结果存在一些差异,其根据DPPH法、水杨酸法和邻苯三分法测定虾青素、番茄红素、叶黄素、β-胡萝卜素的自由基清除能力,得到结论虾青素>叶黄素>β-类胡萝卜素>番茄红素。分析原因可能是:用于测定的类胡萝卜素样品不同,样品纯度不一致,导致结果存在差异;自由基清除能力测定方法不一致。刘晓庚[20]、林恋竹等[21]发现样品浓度、反应时间对分子的自由基清除能力影响较大,在不同的浓度、反应时间下,可能得到不一样的比较结果。
2.2 前线分子轨道
前线轨道是指分子参与反应分子轨道房发生变化时,优先起作用的分子轨道,即分子中的最高被电子占有分子轨道(Highest occupied molecular orbital,HOMO)和最低空分子轨道(Lowest unoccupied molecular orbital,LUMO)。前线轨道能级差ΔE(LUMO-HOMO)表征了分子从基态到激发态所需要的能量,能极差越小,电子越容易发生跃迁,分子的反应活性越强[22]。
由表1可知,13种类胡萝卜素的前线轨道能级差ΔE大小顺序:番茄红素≪虾青素<角黄素≈海胆酮<β-隐黄质≈玉米黄素<β-胡萝卜素<花药黄质≈叶黄素<α-胡萝卜素<紫黄素<六氢番茄红素<八氢番茄红素。番茄红素的ΔE要远远小于其他类胡萝卜素,其次是α-羟基-酮基类胡萝卜素、酮基类胡萝卜素、羟基类胡萝卜素、羟基-环氧基类胡萝卜素与碳氢类胡萝卜素。共轭双键的数目对分子的ΔE影响显著;而带环的类胡萝卜素,明显受到共轭双键数目与基团结构、数目的影响。根据十三种类胡萝卜素分子的能级差推测,在提高类胡萝卜素活性上,酮基的作用最大,其次是羟基与环氧基,实验测得,整体自由基清除能力为虾青素>叶黄素>β-胡萝卜素,验证了这一点。

表1 13种类胡萝卜素的部分性质和前线分子轨道能级差Table 1 The partial properties and ΔE of 13 carotenoids
虾青素与紫黄素的前线分子轨道能级图见图6。由图6可以看出,平面型离域大π键主要集中在共轭长链上,代表它是类胡萝卜素主要的活性部位。此外,电子云在端环碳碳双键、酮基、环氧基上也有分布。根据其电子云密度大小,其活性强弱碳碳双键>酮基>环氧基。
类胡萝卜素清除自由基有两种机制:氢原子转移机制(Hydrogen atom transfer,HAT)和单电子转移机制(Single electron transfer,SET)。氢原子转移机制[23]:CAR+R·→CAR·+RH,该机制中类胡萝卜素(CAR)提供氢,使自由基(R·)与氢结合生成一个更稳定的自由基,从而中断自由基链式反应。单电子转移机制[24]:CAR+R·→CAR·++R-/CAR+R·→CAR·-+R+,该机制中类胡萝卜素(CAR)能通过转移或接受电子而清除自由基(R·)。对于不同的自由基清除能力测定方法,由于所测自由基的亲电给电性质不一样,不同方法所得的结果也有一定差异;对于不同的类胡萝卜素,其清除自由基的机制可能是其中一种,也有可能是两种并存。量子化学理论认为,前线分子轨道能与分子的活性密切相关,最高占据轨道能与最低空分子轨道能分别代表着分子的给电子能力与接受电子的能力。根据图6可知,虾青素的酮基位点上,最低空分子轨道上的电子云密度比最高占据轨道上的大,代表其亲电能力较强;而紫黄素的环氧基上,最高占据轨道的电子云密度比最高占据轨道大,代表其给电子能力较强。由此推测,酮基为亲电子基团,环氧基为给电子基团。
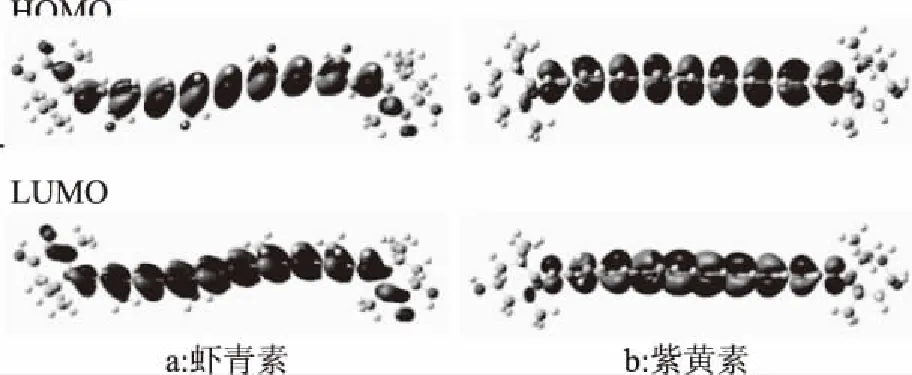
图6 虾青素与紫黄素的前线分子轨道能级图Fig.6 The frontier molecular orbital of astaxanthin and violaxanthin
2.3 NPA电荷分析
在由电荷控制的反应中,原子的负电荷越多,其受亲电试剂进攻的可能性越大;反之,原子的正电荷越多,则受亲核试剂进攻的可能性也越大。自由基一般都是负电子,所以化合物中C原子所带正电荷越大,就是与自由基反应的最大可能活性部位。类胡萝卜素分子中的羟基、酮基、环氧基相邻的C原子均带着正电荷,电荷差值大,说明这些基团位点都是类胡萝卜素的活性部位。
根据分子结构理论,原子间电荷差值越大,电子越容易发生跃迁,原子间键越容易发生解离,容易发生化学反应;反之,则不易发生化学反应。量子化学中一般认为电荷差值较大的位点为分子活性位点[25]。根据表2可知,酮基与相邻碳原子的电荷差值均超过了1.2,羟基、环氧基上的电荷差值则在0.8、0.9左右,初步推测类胡萝卜素环上的酮基活性要大于羟基及环氧基。对比同分异构体叶黄素与玉米黄素的净电荷差值,3-OH上几乎一致,但3′-OH上玉米黄素>叶黄素,可能是玉米黄素比叶黄素多一个共轭双键导致。将海胆酮与β-隐黄质、玉米黄素与角黄素进行对照分析,发现带酮基的类胡萝卜素共轭双键都比较多,酮基的双键增大了分子的共轭体系,推测这是酮基位活性要大于羟基位、环氧基位的原因。虾青素较角黄素多了两个羟基,酮基位点上的电荷差值略大于角黄素,较玉米黄素多了两个酮基,羟基位点上的电荷差值却明显小于玉米黄素,由此推测,环上羟基,可促进酮基位的活性。由于不含环氧基的类胡萝卜素环上5、6、5′、6′位上多是双键,对分子活性影响大,不易对环氧基的活性与其他基团进行直观的对比分析。
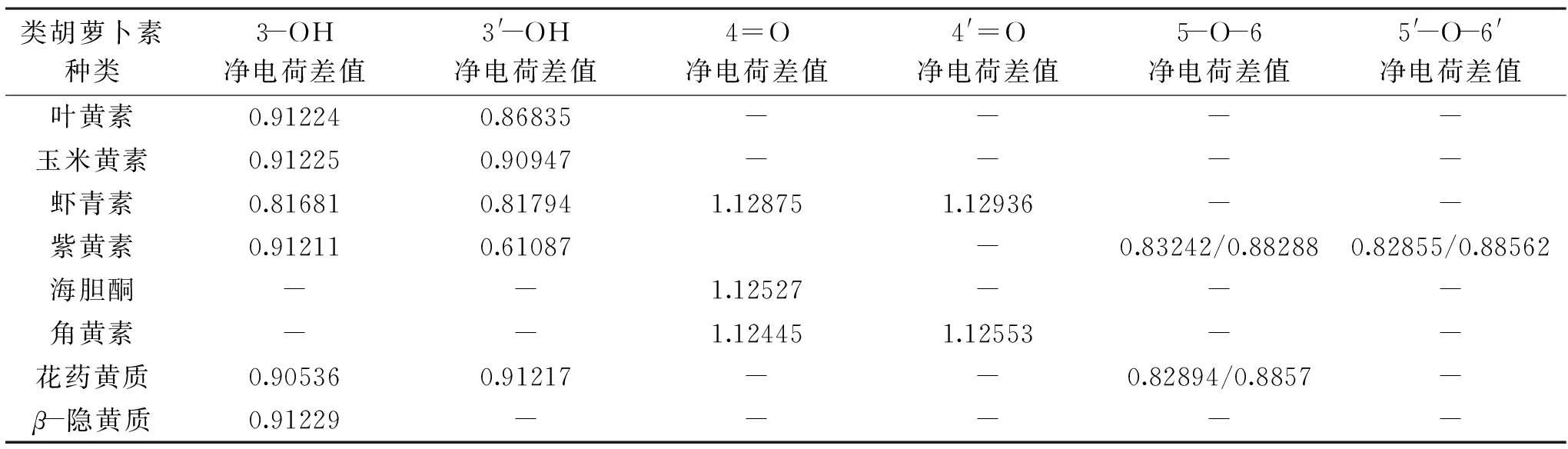
表2 8种类胡萝卜素基团位点上的净电荷差值Table 2 The net charge difference on the 8 carotenoids
3 结论
本研究通过量子化学手段对13种类胡萝卜素进行了计算,同时使用DPPH自由基清除方法、ABTS自由基清除方法、超氧阴离子自由基清除方法、羟自由基清除方法β-胡萝卜素、虾青素、叶黄素以及番茄红素的自由基清除能力进行了测定。结果表明,四种类胡萝卜素的DPPH自由基清除能力顺序为:虾青素>番茄红素>叶黄素>β-胡萝卜素;ABTS自由基清除能力顺序为:虾青素>番茄红素≥叶黄素>β-胡萝卜素;超氧阴离子自由基清除能力顺序为:虾青素≥番茄红素≥叶黄素>β-胡萝卜素;羟自由基清除能力顺序为:虾青素≥番茄红素≥叶黄素>β-胡萝卜素;总体上虾青素的自由基清除能力最强,其次是番茄红素、叶黄素,β-胡萝卜素最弱。四种类胡萝卜素的多个共轭双键的特殊结构是它具有自由基清除能力的重要原因,而端环上的基团对类胡萝卜素活性也有影响,碳碳双键、羟基、酮基以及环氧基能够促进分子的活性。其中,碳碳双键、酮基影响了分子的共轭体系,对类胡萝卜素活性影响最大。对于带环的类胡萝卜素,根据前线轨道能级差及NPA净电荷分布,对其活性影响最大的基团为酮基,其次是羟基与环氧基,这与试验测定的自由基清除能力强弱顺序相吻合,表明前线轨道能级差、NPA净电荷分布是表征带环类胡萝卜素自由基清除的能力的重要参数。本研究分析了类胡萝卜素清除自由基活性的构效关系,但由于类胡萝卜素种类繁多、分子量大,难以进行高精度、规模性、系统性的量子化学计算,类胡萝卜素清除自由基的机理还需深入探讨。

