白花香莲解毒颗粒对HBV全基因组1.3倍体细胞模型病毒复制与表达的影响*
邱 华 毛德文△ 龙富立 刘雪梅 王明刚 李 媛 李家焕 苏翠丽
1.广西中医药大学第一附属医院 (广西 南宁,530023)2.广西中医药大学
我国属HBV感染中-高流行区,现有慢性HBV感染者约9300万人,其中慢性乙型肝炎(CHB)患者约2000万例[1]。虽然最新的调查显示我国HBsAg检出率呈下降趋势,但总体而言,CHB仍然是影响我国人民身体健康、社会发展及稳定的重大传染病之一[2]。白花香莲解毒颗粒是在壮医“毒虚致病”理论指导下,凝练而成的抗HBV特色壮药。前期临床研究表明,其联合阿德福韦酯治疗HBeAg阳性CHB患者能提高HBV DNA阴转率,增加HBeAg的血清学应答率及转换率[3~5]。体外实验已证实其能抑制HepG2.2.15模型的HBV的复制与表达[6,7]。本研究将在课题组所构建的HBV 1.3P模型上,进一步评估白花香莲解毒颗粒的抗HBV作用。
1 材料与方法
1.1 材料 HepG2细胞(中国科学院上海细胞生物研究所),MEM培养基(41500034,GIBCO),Opti-MEM(31985,GIBCO),DMEM培养基(SH30023.01B,HyClone)PVDF超滤膜(RC05290A,Sigma),CCK-8试剂盒(CA1210,Solarbio),PCR相关试剂盒(KK4610,KAPA),0.05% Trypsin(25200-072,IVGN),FBS(S1810-500,Biowest南美血源),Mouse Anti-HBsAg(H2F4)antibody (bsm-2024M,Gentaur),Anti-Mouse IgG H&L (PE/Cy5.5)preadsorbed (ab130784,Gentaur)。HBsAg、HBeAg化学发光法检测试剂盒(郑州安图生物工程股份有限公司)。PCR引物合成和测序由金唯智生物科技有限公司完成。去乙酰车叶草酸甲酯对照品(成都曼斯特生物科技有限公司,批号MUST-16101706,供含量测定用),美国Agilent HP1260高效液相色谱仪。余姚市金偌天平仪器有限公司YP5000型电子天平。水为超纯水,乙腈为色谱纯试剂。白花香莲解毒颗粒由白花蛇舌草30g、黄花倒水莲15g、三叶香茶菜20g、排钱草15g四味壮药组成,由我院药剂科统一购入,并经我校中药(民族药)鉴定专家夏星教授甄别。
1.2 方法
1.2.1 白花香莲解毒颗粒制备工艺 以去乙酰车叶草酸甲酯的含量和得膏率为考察指标,以加水倍量、提取时间、提取次数为考察因素,采用L9(34)正交试验方法确定白花香莲解毒颗粒的最佳提取工艺为:处方药材加10倍水加热回流提取2次,每次1.5h,合并两次滤液,滤液浓缩至相对密度1.20~1.25(50~60℃)稠膏。称取稠膏重量,按稠膏∶糊精=1∶2比例加入糊精,按阿斯巴甜∶甜菊糖苷(1∶1)加入0.5%矫味剂,再加入75%乙醇做润湿剂,以上各辅料混合均匀,过14目筛制粒,80℃鼓风干燥后14目筛整粒,即可。在制剂的稠膏阶段取出壮药稠膏100g,冷藏备用。
1.2.2 白花香莲解毒颗粒的去乙酰车叶草酸甲酯含量测定
精密称取去乙酰车叶草酸甲酯对照品适量,置10ml容量瓶中,用流动相稀释并超声溶解至刻度,摇匀,即得1.014mg/ml的去乙酰车叶草酸甲酯标准溶液,作为储备液。精密吸取去乙酰车叶草酸对照品储备液0.20ml于10 ml容量瓶中,用流动相溶解稀释至刻度,得浓度20.28μg/ml的对照品溶液。精密吸取去乙酰车叶草酸对照品储备液0.05、0.10、0.15、0.20、0.30、0.40ml于 10 ml容量瓶中,用流动相溶解稀释至刻度,得浓度为5.071、10.14、15.21、20.28、30.42、40.56μg/ml的标准品溶液。精密称取白花香莲解毒颗粒稠膏0.3g加至25ml的容量瓶中,加水稀释并定容至刻度。摇匀,浓缩液过0.22μm的微孔滤膜,取续滤液作为供试品溶液,上述对照品溶液、标准品溶液、供试品溶液按色谱柱 Inertsil ODS-3(4.6×250mm,5μm);流动相乙腈∶水(9∶91);检测波长238nm;柱温30℃;流速0.85ml/min;进样量5μl进行色谱分析。
1.2.3 白花香莲解毒颗粒细胞干预液的制备 取备用的白花香莲解毒颗粒稠膏4g,加入无菌纯水中充分溶解后,定容到40ml,浓度相当于0.1g稠膏/ml。依次经滤纸及0.45μM孔径、0.22μM孔径PVDF超滤膜过滤后,取100μL加入1.9mL MEM完全培养基中,配置成5mg稠膏/ml(以下简称为mg/ml,均为稠膏量)的白花香莲解毒颗粒细胞干预液。采用MEM完全培养基进行梯度稀释,5mg/ml(1倍)、2.5mg/ml(1/2倍)、1.25mg/ml(1/4倍)、0.625mg/ml(1/8倍)、0.32mg/ml(1/16倍)、0.16mg/ml(1/32倍)、0.08mg/ml(1/64倍)、0.04mg/ml(1/128倍)。
1.2.4 CCK-8法检测白花香莲解毒颗粒对HBV 1.3P细胞生长的影响
1.2.4.1 细胞铺板数量及CCK-8孵育时间的确定 96孔板内每孔铺HBV 1.3P细胞数0、1000、2000、4000、6000、8000、10000、12000,各3个复孔。细胞贴壁后,加入CCK-8液。37℃分别孵育1h、2h、3h,490nm波长检测OD读值。绘制出标准曲线,确定出最佳细胞铺板数、孵育时间。
1.2.4.2 CCK-8检测白花香莲解毒颗粒对HBV 1.3P细胞增殖的影响 选择对数生长期的HBV 1.3P细胞,收集细胞,记数,按照预实验的最佳铺板数铺板,设置3个对照孔,边缘孔用PBS补充,5%CO2,37℃,孵育过夜,设置空白对照组(只加MEM完全培养基);按照药物不同的浓度加药,每组进行3重复,继续于CO2培养箱中培养;分别在0h、3h、6h、12h、24h、48h和72h,加入CCK-8 10μl/孔,孵育2h(由预实验确定),酶联免疫检测仪测量OD490。各组以空白对照组时间点为对照,计算每个不同浓度白花香莲解毒颗粒干预组每个时间点相对生长速度,根据生长曲线计算细胞的数量及细胞增殖抑制率。
1.2.5 白花香莲解毒颗粒干预HBV复制的最佳浓度与时间确定 将制备成功的HBV 1.3P细胞模型分为干预24h组,干预48h组,然后根据CCK-8结果,加入不同浓度的白花香莲解毒颗粒细胞干预液,实验结束后收取各组细胞及上清液。
1.2.6 qPCR检测HBV DNA的水平 将收集到各组HBV 1.3P细胞,抽提总DNA,采用qPCR检测HBV DNA的表达水平,HBV DNA的检测引物为(F:CTCGTGGTGGACTTCTCTC,R:CAGCAGGATGAAGAGGAA);以18S rDNA为内参,检测引物为(18S-F:GAATTGACGGAAGGGCACCAC,18S-R:AAGAACGGCCATGCACCACCA)。实验组与对照组中基因的倍数关系通过公式R=2-ΔΔCt计算,qPCR产物的特异性通过扩增曲线和溶解曲线来检测。反应体系:2×SYBR Green PCR Master Mix 10μl、引物F(10mM)1 μl、引物R(10mM)1 μl、模板 1 μl、RNase-free H2O 5μl;反应条件:95℃ 30s、60℃ 30s、72℃ 30s,40个循环,PCR数据采集。HBV DNA抑制率=(1-待测样品相对表达量值)×100%。
1.2.7 化学发光法检测细胞内HBsAg、HBeAg的表达量 参照前期方法[8],将收集到的各组HBV 1.3P细胞上清液,按HBsAg、HBeAg化学发光法试剂盒的说明书实施检测,为了减少因细胞数量对检测结果的影响,实验按4×105个细胞量计算发光强度。
1.2.8 间接免疫荧光法检测细胞内HBsAg的表达水平 收集各组HBV 1.3P细胞,消化细胞,将细胞爬片,爬片后的细胞用PBS洗3次,4%多聚甲醛固定,PBS洗3次,0.25% Triton X-100/PBS孵育5min通透细胞,PBS洗2次;10% BSA/PBS,37℃下孵育30min,用3%BSA/PBS稀释第一抗体,37℃下孵育2h,PBS洗复3次,3%BSA/PBS稀释第二抗体,37℃下避光孵育45min,PBS 3次;荧光显微镜观察并拍照,每张玻片拍摄5张(4个边角及片中央),将荧光显微镜拍下的照片用Image-Pro Plus软件计算平均光密度(Mean IOD),分析荧光的强弱。

2 结果
2.1 白花香莲解毒颗粒稠膏中去乙酰车叶草酸甲酯的含量 以峰面积(A)为纵坐标,以对照品浓度(C)为横坐标,绘制标准曲线,计算得去乙酰车叶草酸甲酯的回归曲线方程如下:A=11.45333C+1.01567(R=0.99994)。对照品溶液测定结果见图1A,供试品溶液测定稠膏中去乙酰车叶草酸甲酯的峰面积为170.9,稠膏中去乙酰车叶草酸甲酯的含量为1.23mg/g,并作为白花香莲解毒颗粒制剂的质量标准,见图1B。
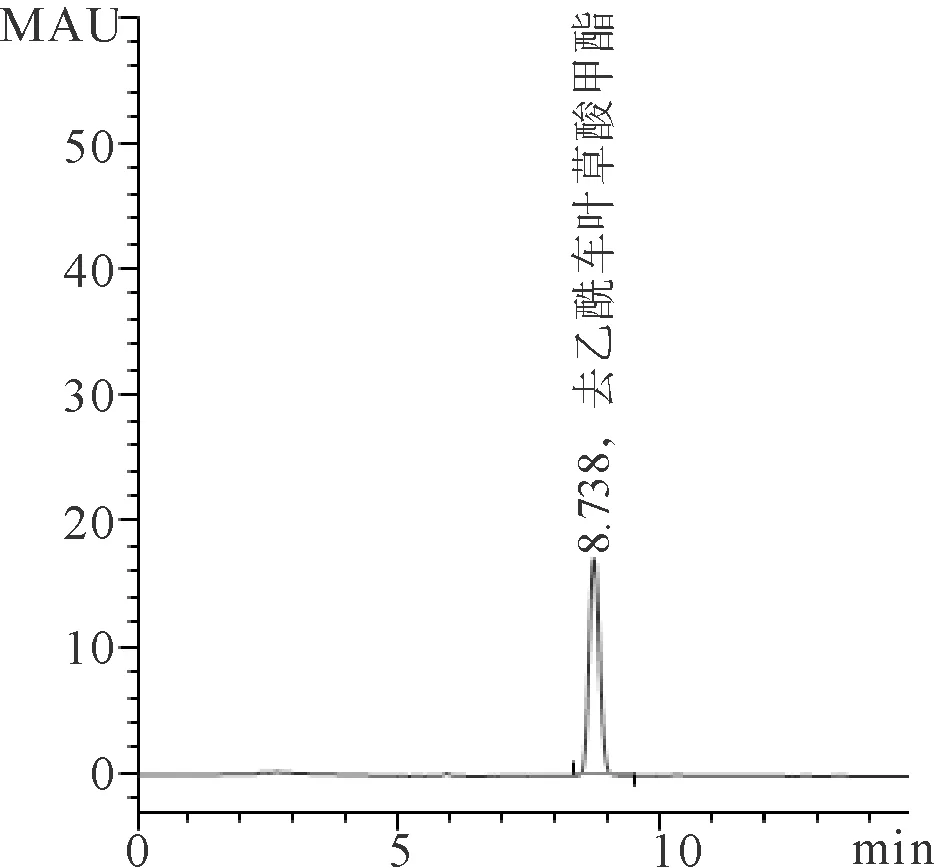
A 对照品溶液
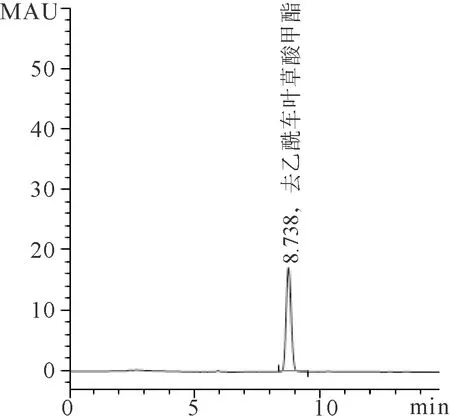
B 供试品溶液
2.2 CCK-8实验最佳检测时间与最佳铺板细胞数 结果显示,不同数量的各组细胞数均在孵育2h时其OD值达到最高水平(图2A),选择孵育2h为CCK-8实验的最佳检测时间;在2000~12000细胞数范围内OD值呈现良好的线性关系(图2B),Y = 0.00006X + 0.16392(Y为OD值,X为细胞数)。

图2 CCK-8孵育时间及细胞数与OD值的关系图
2.3 CCK-8实验测定白花香莲解毒颗粒对HBV1.3P细胞增殖的影响 与空白对照组比较,白花香莲解毒颗粒在0.04~0.625mg/ml对HBV1.3P细胞增殖无明显抑制作用。在1.25~5mg/ml范围内,白花香莲解毒颗粒则会抑制HBV1.3P细胞的增殖,抑制率随浓度而升高,其中5mg/ml在干预72h后细胞增殖抑制率达到了(71.2±2.95)%。(见图3)。

图3 白花香莲解毒颗粒对HBV1.3P细胞增殖率的影响图
2.4 白花香莲解毒颗粒对HBV1.3P细胞HBV DNA复制的影响 在相同干预时间条件下,白花香莲解毒颗粒对HBV DNA抑制率与药物浓度呈正相关关系,而由于CCK-8实验提示1.25mg/ml条件下对细胞增殖具有一定抑制作用,因此选择0.625mg/ml为最佳浓度。在相同药物浓度条件下,白花香莲解毒颗粒对HBV DNA抑制率与干预时间呈正相关关系,其中最佳浓度0.625mg/ml干预48h时HBV DNA抑制率为(42.92±2.42)%,优于干预24h的(35.36±9.16)%,差异具有统计学意义(P<0.05)。见表1。

表1 不同浓度白花香莲解毒颗粒对HBV DNA复制的抑制率 (%)
与同组干预24h时相比,*P<0.05
2.5 白花香莲解毒颗粒对HBV1.3P细胞上清液HBsAg、HBeAg表达量的影响 在干预48h情况下,HBV1.3P细胞上清液中HBsAg、HBeAg表达量与白花香莲解毒颗粒浓度呈负相关关系。见表2。

表2 不同浓度白花香莲解毒颗粒对HBV1.3P细胞上清HBsAg、HBeAg表达量的影响
与0.625mg/ml组比较,*P<0.05
2.6 白花香莲解毒颗粒对HBV1.3P细胞HBsAg表达强度的影响 在干预48h情况下,HBV1.3P细胞HBsAg表达强度与药物浓度呈负相关关系。0.625mg/ml组HBsAg表达强度与0.04mg/ml、0.08mg/ml组比较,差异具有统计学意义(P<0.01),表3。

表3 不同浓度白花香莲解毒颗粒对HBV1.3P细胞HBsAg表达量的影响比较
与0.625mg/ml组比较,**P<0.01
3 讨论
抗病毒是慢性乙型肝炎治疗的关键,目前核苷(酸)类似物、干扰素等抗病毒药物在实现抑制HBV DNA复制的基本目标上已能获得比较满意的疗效,然而在达到理想目标即HBsAg血清学转换、满意目标即HBeAg血清学转换方面仍然比率较低。因此,在深入研究HBV和宿主相互关系的基础上,寻找更有效、安全的治疗方法,仍是当前国内、外肝病学者亟待解决的难题。
在我国,中医药是治疗CHB的一种重要手段,其在保肝降酶、抗肝纤维化、调节免疫及抗病毒等方面具有较好的疗效。针对HBV抗病毒治疗低HBeAg、HBsAg血清学转换率的临床难题,由北京中医药大学东直门医院叶永安教授、广州中医药大学深圳附属医院周大桥教授领衔的国家“十一五”、“十二五”科技重大传染病专项进行了深入研究。其中叶永安教授主持的项目对590例HBeAg阳性CHB患者进行了为期48周的临床研究,试验组使用中药联合阿德福韦酯,对照组使用中药安慰剂联合阿德福韦酯。结果证实,试验组治疗48周时HBeAg应答率为29.64%,对照组为17.86%,提高HBeAg应答率达11.78%,差异具有统计学意义(P<0.05),同时研究发现试验组24~48周的HBV DNA下降率高于对照组[9]。周大桥教授主持的项目对300例HBeAg阳性HBV携带者进行为期52周的抗病毒疗效观察,治疗组患者(200例)给予补肾健脾方治疗,对照组患者(100例)给予中药安慰剂治疗。结果治疗52周时治疗组患者血清HBV DNA 水平明显下降,与0周及安慰剂对照组比较,差异具有统计学意义(P<0.05);其中治疗组HBV DNA下降>1 log及>2 log的比例分别为45.98%、21.84%,明显高于对照组的11.83%、5.38%。治疗过程中,治疗组患者HBeAg均值、HBsAg均值均呈持续下降趋势。52周时,治疗组患者HBeAg均值、HBsAg均值下降均显著优于安慰剂对照组,差异具有统计学意义(P<0.05)[10]。上述研究结果从循证医学层面证实,中医药确能提高HBeAg阳性CHB或携带者的HBeAg血清学转换率,是一种切实可行的新途径。
本课题组前期多中心临床研究证实,白花香莲解毒方(颗粒)联合阿德福韦酯胶囊治疗HBeAg阳性的CHB患者48周,其HBV DNA阴转率提高24.31%,生化学应答率提高7.8%,临床综合疗效优于单纯阿德福韦酯对照组(P<0.05)。在HBeAg/抗-HBeAb血清学应答率与阴转率方面,治疗24、48 周试验组HBeAg 血清应答率分别为26.27%、39.83%,对照组为13.68%、29.06%,差异有统计学意义(P<0.05);治疗48周,试验组HBeAg阴转率为22.03%,对照组为11.96%,差异有统计学意义(P<0.05),其机制与降低CHB患者CD4+CD25+Treg细胞比率,突破免疫耐受,恢复机体对HBV的特异性CTL免疫应答有关[4,5]。HBV1.3P细胞模型包含了HBV基因组的5’末端Enh Ⅰ、Enh Ⅱ,复制起始区(DR1、DR2),前基因组转录起始位点X 和前C 区启动子,X 开放阅读框等构件,能依赖自身启动子启动转录与复制,且以cccDNA 为复制模板,复制和表达效率高于1.1 和1.2 倍体的模型,其较传统将HBV 基因组整合入HepG2细胞基因的HepG2.2.15模型等更适合于中药/壮药抗HBV的疗效评估[8]。本研究发现,白花香莲解毒颗粒不仅能直接抑制HBV1.3P细胞模型的HBV DNA复制,而且能显著下调HBeAg、HBsAg的表达量,从而提示该药物除了能通过免疫调控途径外,还可能在转录、转录后、蛋白成熟、蛋白分泌等环节上直接干扰HBV复制与表达,其具体机制有待深入研究。

