响应面法分析复合酶对扔糟淀粉出酒率的影响
张晓龙,刘 燕,曹 冉,朱文众*
(1.河北科技大学 生物科学与工程学院,河北 石家庄 050018;2.河北省环保产品质量监督检验研究院,河北 石家庄 050091)
酒糟别名红糟、酒醅糟、扔糟等,是米、麦、高梁等原料酿酒后剩余的残渣。通常情况下白酒与酒糟的对应产量比为1∶3,据中国产业信息网统计分析,2016年、2017年,我国白酒的总产量分别达到1 358.4千万升和1 341.9千万升[1],我国白酒行业每年有大量丢糟产生,丢糟的综合利用意义重大[2]。鲜酒糟的含水量约占总体含量的60%以上,其蛋白质和淀粉等的含量也相对较高,酒糟中的残余淀粉一般是指游离的含α-1,6糖苷键的淀粉和纤维素包裹的淀粉,难以被传统固态发酵所利用。研究表明,扔糟中含有丰富的白酒香气物质和前体物质,包括有机酸、醇类、酯类、含氮化合物等[3],国内学者对白酒酒糟的研究主要集中在酒糟中淀粉再利用、纤维素的提取、以及菌种的筛选[4-5],其中左上春等[6]综述了近年来我国白酒酒糟资源化利用的主要进展,包括生产饲料、培养食用菌、提取高附加值产物、酿醋、生产能源和有机酸等,讨论酒糟资源化过程中存在的问题并展望后期发展的方向。
本实验针对扔糟中残余淀粉的结构组成,在单因素试验基础上,采用响应面法[7-8]优化糖化酶[9]、纤维素酶[10-11]、普鲁兰酶[12-13]酶制剂处理扔糟制备白酒工艺条件,使其中的粗淀粉水解为还原糖,接种酵母进行固态发酵[14]产生酒精,以提高扔糟淀粉出酒率[15]。扔糟的再次发酵,节约了资源,一定程度上提高了衡水老白干酿酒工艺中的淀粉出酒率,具有一定的现实意义,并为酶制剂在白酒生产上的应用提供了参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
白酒扔糟:河北衡水老白干酒业股份有限公司。
1.1.2 主要试剂
糖化酶(酶活1万U/g)、纤维素酶(酶活5万U/g):北京索莱宝科技有限公司;P2000型普鲁兰酶(酶活2 000 U/mL):宁夏夏盛实业集团有限公司;酿酒高活性干酵母:安琪酵母股份有限公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):天津市光复精细化工研究所。
1.2 仪器与设备
7200型分光光度计:上海天美科学仪器有限公司;PL203电子天平:梅特勒-托利多仪器(上海)有限公司;高温蒸汽灭菌锅:上海博讯实业有限公司;800型离心机:上海手术器械厂;25mL附温比重瓶:上海信谊仪器厂有限公司。
1.3 方法
1.3.1 扔糟制备白酒工艺流程及操作要点

操作要点:
扔糟在121℃、30 min条件下湿法灭菌[16],添加酶制剂(糖化酶、纤维素酶、普鲁兰酶添加量),在47℃下糖化48 h,添加0.05%活性干酵母用去离子水常温下活化15 min,调节温度至25℃,发酵15 d。取100 g酒醅加水蒸馏100 mL原酒液测定酒精度为3.06%vol。
1.3.2 扔糟基本成分分析检测
含水量的测定采用GB 5009.3—2016《食品安全国家标准食品中水分的测定》中的减压干燥法[17];酒精度的测定采用GB5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》中密度瓶法[18];粗淀粉(总糖)及游离还原糖含量的测定采用DNS比色法[19-20]。扔糟淀粉水解率、出酒率计算公式如下:

式中:Y—扔糟中游离还原糖含量,mg/100 g(以湿基计,下同);0.9—还原糖与淀粉折算系数;693.36—扔糟中初始还原糖含量,mg/100 g;M—扔糟质量,g;0.095—扔糟粗淀粉含量系数。

式中:V—折合成65%vol原酒体积,mL;M—扔糟质量,g;0.897—65%vol原酒密度,g/mL,0.095—扔糟粗淀粉含量系数。
1.3.3 糖化工艺优化单因素试验
以还原糖含量为评价指标,分别考察温度(15℃、25℃、35 ℃、45 ℃、55 ℃)、时间(12 h、24 h、36 h、48 h、60 h、72 h)、pH值(3.0、3.5、4.0、4.5、5.0)、糖化酶添加量(0.20%、0.40%、0.60%、0.80%、1.00%、1.50%、2.00%)、纤维素酶添加量(0.30%、0.60%、0.90%、1.20%、1.50%、1.80%)、普鲁兰酶添加量(0.30%、0.60%、0.90%、1.20%、1.50%、1.80%)对糖化工艺的影响。
1.3.4 糖化工艺优化响应面试验
根据单因素试验,确定各因素优化水平,以扔糟中游离还原糖含量作为响应值,利用Design Expert软件中Box-Behnken Design进行响应面试验设计,因素与水平编码值见表1。

表1 响应面试验设计因素与水平Table 1 Factors and levels of response surface experiments design
2 结果与分析
2.1 扔糟基本成分测定结果
对衡水老白干酿酒工艺中各环节酒醅基本成分进行测定,结果见表2。由表2可知,衡水老白干酿酒扔糟中含水分64.4%、淀粉9.50%、还原糖693 mg/100 g,pH值3.12。
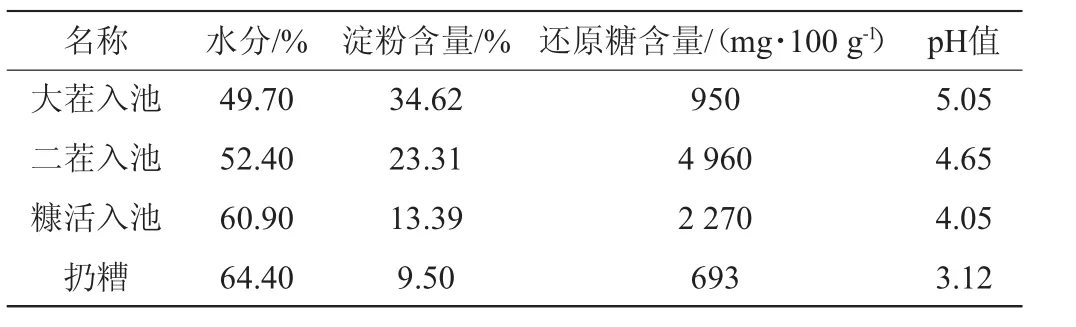
表2 衡水老白干酒醅参数Table 2 Parameters of Hengshui Laobaigan fermented grains
2.2 糖化工艺优化单因素试验
2.2.1 作用温度对扔糟糖化工艺条件的影响
在时间48 h,pH 4.0,糖化酶添加量1.00%,纤维素酶添加量1.20%,普鲁兰酶添加量0.90%条件下,考察不同作用温度对糖化工艺的影响,结果见图1。

图1 作用温度对扔糟还原糖含量的影响Fig.1 Effect of reaction temperature on reducing sugar content of distiller's grains
从图1可以看出,作用温度15~45℃区间扔糟中还原糖含量由1733mg/100g增至3556mg/100g;作用温度为45~55℃条件下,还原糖含量稳定在3 500 mg/100 g左右,数值变化不大,糖化效果趋于稳定;作用温度为45℃时,还原糖含量最大,为3556mg/100g。因此,作用温度选用45℃为宜。
2.2.2 作用时间对扔糟糖化工艺条件的影响
在作用温度45℃,pH 4.0,糖化酶添加量1.00%,纤维素酶添加量1.20%,普鲁兰酶添加量0.90%条件下,考察不同作用时间对糖化工艺的影响,结果见图2。

图2 作用时间对扔糟还原糖含量的影响Fig.2 Effect of reaction time on reducing sugar content of distiller's grains
从图2可以看出,在作用时间为12~48 h内,扔糟中还原糖含量由2 589 mg/100 g上升至4 342 mg/100 g;作用时间为48 h时,还原糖含量最大,为4 342 mg/100 g;作用时间>48 h后,扔糟中还原糖含量稳定在4 300 mg/100 g,糖化效果趋于稳定。因此,作用时间选择48 h为宜。
2.2.3 pH值对扔糟糖化工艺条件的影响
在作用温度45℃,作用时间48 h,糖化酶添加量1.00%,纤维素酶添加量1.20%,普鲁兰酶添加量0.90%条件下,考察不同pH值对糖化工艺的影响,结果见图3。

图3 pH值对扔糟还原糖含量的影响Fig.3 Effect of pH value on reducing sugar content of distiller's grains
从图3可以看出,当pH在3.0~4.0时,还原糖含量由2 875 mg/100 g增至4 019 mg/100 g;当pH值为4.0时,还原糖含量最大,为4019mg/100g,扔糟糖化效果最好;当pH>4.0之后,还原糖含量有所下降。由于扔糟中有复杂的缓冲系统,试验中难以对扔糟pH进行精确控制,采用pH 4.0作为固定水平。
2.2.4 糖化酶添加量对扔糟糖化工艺条件的影响
在温度45℃,时间48h,pH 4.0,纤维素酶添加量1.20%,普鲁兰酶添加量0.90%条件下,考察不同糖化酶添加量对糖化工艺的影响,结果见图4。
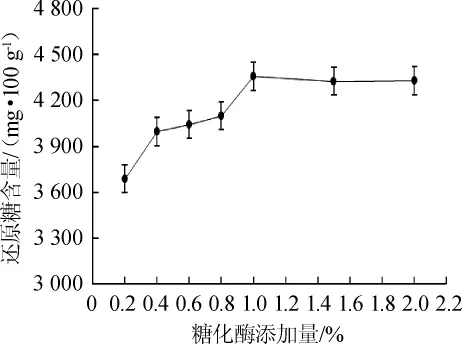
图4 糖化酶添加量对扔糟还原糖含量的影响Fig.4 Effect of glucoamylase addition on reducing sugar content of distiller's grains
从图4可以看出,在糖化酶添加量为0.20%~1.00%时,扔糟中还原糖含量由3688mg/100g增至4357mg/100g;在糖化酶添加量为1.00%时,还原糖含量最大,为4357mg/100g;在糖化酶添加量>1.00%之后,还原糖含量稳定在4300mg/100g,糖化效果趋于稳定。因此,糖化酶添加量选择1.00%为宜。
2.2.5 纤维素酶添加量对扔糟糖化工艺条件的影响
在温度45℃,时间48 h,pH 4.0,糖化酶添加量1.00%,普鲁兰酶添加量0.90%条件下,考察不同纤维素酶添加量对糖化工艺的影响,结果见图5。
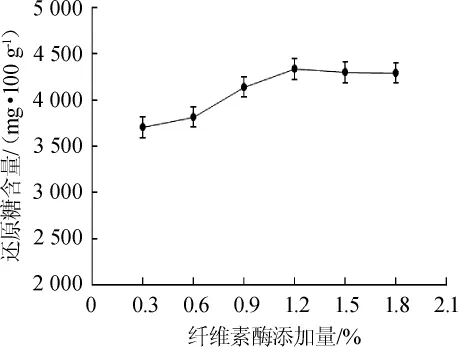
图5 纤维素酶添加量对扔糟还原糖含量的影响Fig.5 Effect of cellulase addition on reducing sugar content of distiller's grains
从图5可以看出,在纤维素酶添加量在0.30%~1.20%时,扔糟中还原糖含量由3703mg/100g增至4334mg/100g;在纤维素酶添加量为1.20%时,还原糖含量最大,为4334mg/100g;在纤维素酶添加量>1.20%之后,糖化效果趋于稳定。因此,纤维素酶添加量选择1.20%为宜。
2.2.6 普鲁兰酶添加量对扔糟糖化工艺条件的影响
在温度45℃,时间48 h,pH 4.0,糖化酶添加量1.00%,纤维素酶添加量1.20%条件下,考察不同普鲁兰酶添加量对糖化工艺的影响,结果见图6。

图6 普鲁兰酶添加量对扔糟还原糖含量的影响Fig.6 Effect of pullulanase addition on reducing sugar content of distiller's grains
从图6可以看出,在普鲁兰酶添加量为0.30%~0.90%时,扔糟中还原糖含量由3310mg/100g增至4133mg/100g;在普鲁兰酶添加量为0.90%时,还原糖含量最大,为4133mg/100g;普鲁兰酶添加量>0.90%之后,糖化效果趋于稳定。因此,普鲁兰酶添加量选择0.90%为宜。
2.3 扔糟糖化工艺条件的优化
2.3.1 响应面试验设计与结果
根据单因素试验,以扔糟中游离还原糖含量(Y)作为响应值,对糖化工艺中作用温度(A),作用时间(B),糖化酶添加量(C),纤维素酶添加量(D)及普鲁兰酶添加量(E)进行研究,利用Box-Behnken Design进行响应面试验设计,试验设计及结果见表3,回归模型方差分析见表4。

续表

表4 回归模型的方差分析Table 4 Variance analysis of regression model
运用Design Expert 8.0.6软件响应面分析程序对表3结果进行回归分析,得到以扔糟中还原糖含量为响应函数,各参数编码值的二次多项回归方程:

由表4可知,可以得出本试验的二次多项模型显示极显著性(P<0.01),失拟项不显著(P>0.05),回归方程决定系数R2=0.9954,表示该模型可以解释99.54%的响应值变化,方程拟合程度较好,可以用作扔糟中淀粉水解进行分析和预测。
在回归方程中一次项与二次项对响应值影响均极显著(P<0.01);交互项中,作用温度和纤维素酶、纤维素酶和普鲁兰酶对响应值影响不显著(P>0.05)外,作用时间和糖化酶对响应值影响显著(P<0.05),其他交互项对响应值影响极显著(P<0.01)。
2.3.2 响应面分析与优化
为考察各因素在交互项上对扔糟中淀粉水解效果的影响,利用Design-Expert 8.06分析软件对回归方程进行运算,得出各因素交互项的响应面及等高线图,结果见图7。

图7 各因素间交互作用对扔糟还原糖含量影响的响应面及等高线图Fig.7 Response surface plots and contour line of interaction between factors on reducing sugar content of distiller's grains
从图7中可以看出,各因素间两两交互项对响应值扔糟中还原糖含量的影响,对试验结果以及回归方程进行参数优化分析,得到糖化的最优条件:作用温度47.41℃、作用时间48.59 h、糖化酶添加量1.01%,纤维素酶添加量1.26%,普鲁兰酶添加量0.95%。为了便于实际操作,将该最优条件修正为作用温度47℃、作用时间49 h、糖化酶添加量1.0%,纤维素酶添加量1.3%,普鲁兰酶添加量1.0%,在此最优条件下,扔糟中还原糖净生成量为4 564.14 mg/100 g,扔糟中淀粉水解率为49.8%。
2.4 验证试验
2.4.1 扔糟糖化效果验证试验
根据响应面优化得到各因素最佳参数,为验证优化结果,进行了3次平行试验,结果见表5。

表5 最佳条件下扔糟各项参数Table 5 Parameters of distiller's grains at the optimal conditions
由表5可知,在此最佳糖化工艺条件下,实际扔糟中还原糖净生成量平均值为4 556.11 mg/100 g,酶制剂处理过的扔糟淀粉水解率平均值可达49.7%,本研究得到的还原糖含量相对于理论数据误差为0.2%,验证了回归方程的有效性,为开发利用扔糟中残余淀粉提供理论指导。
2.4.2 发酵验证试验
为进一步验证白酒扔糟的糖化效果,进行接种发酵试验,设置空试验组分别添加0.05%酵母(1#)、0.05%糖化酶(2#),复合酶制剂(糖化酶添加量1.01%,纤维素酶添加量1.26%,普鲁兰酶添加量0.95%)(3#),25℃条件下固态发酵15 d,结果见表6。

表6 发酵试验结果Table 6 Results of fermentation experiments
从表6可以看出,在扔糟中仍含有少量可以被酿酒酵母利用的淀粉,1#、2#组酒精度分别为0.52%vol、1.45%vol,淀粉出酒率分别为7.4%、21.5%,说明酿酒酵母糖化能力低于单一糖化酶制剂。3#组酒精度为3.06%vol,淀粉出酒率达44.5%,证明扔糟含有较多α-1,6-糖苷键淀粉,糖化酶和酵母难以降解,复合酶制剂可以降解被酵母利用,说明复合酶制剂的协同作用效率很高,对扔糟中淀粉的水解影响明显。对于扔糟发酵而言,复合酶制剂可以大幅提高扔糟淀粉出酒率,复合酶制剂高于单一酶制剂对白酒扔糟的糖化效果。
3 结论
本研究采用响应面分析得出复合酶制剂协同作用于白酒扔糟最佳糖化条件:糖化酶1.0%、纤维素酶1.3%、普鲁兰酶1.0%、作用温度47℃、作用时间49 h,pH 4.0,在最优糖化条件下,扔糟中还原糖含量4 564.14 mg/100g,扔糟中淀粉水解率49.8%。并在此条件下,进行接种发酵试验,结果表明,相较于单一酶制剂处理扔糟的发酵工艺,由复合酶制剂处理后扔糟的淀粉出酒率提高了23.0%,作用效果明显。扔糟二次发酵,一定程度上提高了衡水老白干酿酒工艺中的淀粉出酒率。
由于扔糟中含有较多白酒香味物质或前体物质,酯类是白酒香味物质的重要组成部分,它是由乙醇和有机酸通过酯化作用形成的,本实验将扔糟中残余淀粉转化为一定量的乙醇,为进一步探索扔糟中酯类物质的催化合成和提取奠定了基础。

