尾静脉注射miR-214抑制剂对小鼠急性肺损伤的预防作用
李立,郭星云,石秀霞
(承德市中心医院,河北承德067000)
急性肺损伤(ALI)是重症医学科最常见的急危重症之一,后期可发展为急性呼吸窘迫综合征(ARDS)。炎性反应失控是ALI的根本原因,其致病因素有多种,其中内毒素致脓毒症时,ALI的发生率高达83%~100%[1]。肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1β和IL-6是临床常用的炎症指标。10 号染色体上缺失的磷酸酶与张力蛋白同源物(PTEN)基因是一种新发现的抑癌基因,具有磷酸酯酶的活性。PTEN蛋白可通过拮抗酪氨酸激酶等磷酸化酶的活性而抑制肿瘤的发生、发展。近年来ALI/ARDS病死率仍居高不下[2],因此寻找针对ALI病因的基因治疗手段意义重大。miR-214在炎症的发生、发展中起重要作用[3~5],起促炎因子的作用。Cai 等[6]研究发现包括miR-214在内的多个miRNAs在脂多糖(LPS)诱导的ALI模型小鼠肺组织中表达明显升高,然而至今miR-214在ALI发生中的可能作用及相关机制尚未见相关研究报道。2017年4月~2017年8月,本研究通过LPS建立ALI小鼠模型,观察下调miR-214表达对ALI小鼠ALI的预防作用,并探讨其可能作用机制。
1 材料与方法
1.1 动物、试剂及仪器 健康雄性SPF级8~10周C57BL/6小鼠30只,体质量21~25 g,购自北京维通利华动物实验中心。LPS购自美国Sigma公司;miR-214抑制剂antagomiR-214购自广州锐博生物科技公司;TRIzol试剂购自Invitrogen公司;miR-214和U6引物设计合成由上海吉凯基因化学技术有限公司完成。
1.2 小鼠分组、ALI模型制备及antagomiR-214给予方法 小鼠随机分为对照组、模型组、干预组,每组10只。模型组、干预组小鼠参考文献[7,8]方法制备ALI模型:小鼠支气管内缓慢滴注LPS溶液(5 mg/kg)后缝合伤口。对照组小鼠支气管内缓慢滴注等量生理盐水。干预组小鼠在制备ALI模型前3 d开始给予尾静脉注射antagomiR-214(80 mg/kg),1次/天,连续注射3 d;模型组和对照组予尾静脉注射等量生理盐水。参照美国胸科协会ALI模型的作用条件[9]:造模24 h时完整取出肺组织。在气管叉处结扎右侧主支气管,应用注射器经气管缓慢注入冷PBS 2 mL行左肺支气管肺泡灌洗,用注射器轻轻缓慢冲洗左肺3 遍,回收支气管肺泡灌洗液(BALF),重复3次。BALF 4 ℃、2 000 r/min离心10 min,离心后取上清液置于-20 ℃低温冰箱保存备用。冰面上取得右肺下叶置于液氮中速冻后置于-80 ℃低温冰箱保存备用。
1.3 BALF蛋白含量、细胞总数检测 取BALF离心后上清液,按照BCA蛋白浓度测定试剂盒的操作说明检测三组BALF蛋白浓度。将BALF离心后的细胞团重新悬浮,应用血细胞计数板计算细胞总数。实验重复3次,取平均值。
1.4 肺组织损伤情况观察 采用苏木精-伊红(HE)染色法测算肺损伤病理评分。取右肺上叶组织,4%多聚甲醛固定,常规酒精脱水、二甲苯透明,石蜡包埋后切5 μm厚石蜡切片,经过脱蜡、浸泡等常规处理后HE染色,二甲苯透明,中性树胶封片,光镜下观察肺组织的病理学结果,参考文献[10]依据肺泡间隔增宽、肺泡腔渗出、肺泡腔出血、中性粒细胞浸润等四个方面的严重程度对ALI进行肺损伤病理评分:正常0分;轻度1分;中度2分;重度3分。实验重复3次,取平均值。
1.5 肺组织水肿程度测算 采用肺组织湿质量/干质量(W/D)比值法。取右肺中叶组织,滤纸沾干表面水分,置入干燥洁净的小玻璃瓶中称湿重,75 ℃恒温烘箱中烘烤24 h至恒重,称肺组织干重,计算W/D比值,评估肺组织的水肿程度。实验重复3次,取平均值。
1.6 肺组织和BALF中TNF-α、IL-1β和IL-6含量检测 采用ELISA法。取右肺下叶组织100 mg匀浆,离心收集上清液。同时取出低温保存的BALF上清液,严格按照TNF-α、IL-1β和IL-6 ELISA试剂盒说明书进行操作测算TNF-α、IL-1β和IL-6含量。
1.7 肺组织中miR-214检测 采用Real-time PCR法。取右肺下叶组织100 mg匀浆,TRIzol试剂提取总RNA,利用紫外分光光度计测定总RNA浓度,逆转录合成cDNA。以cDNA为模板,参照All-in-OneTMmiRNA qPCR Kit试剂盒说明书配置Real-time PCR体系后,进行qPCR,反应条件:95 ℃,10 min;95 ℃,10 s,60 ℃,20 s,72 ℃,10 s,45个循环。配置PCR反应体系,按如下条件进行PCR反应:94 ℃预变性2 min,94 ℃变性20 s,60 ℃退火延伸30 s,扩增40个循环。以U6作为内参基因,以2-△△Ct代表miR-214的相对表达量。实验重复3次,取平均值。
1.8 肺组织PTEN蛋白检测 采用Western blotting法。取右肺下叶组织100 mg,RIPA裂解,离心取裂解上清液,BCA法进行蛋白定量。所有操作均严格按照试剂说明书进行。ECL显像曝光后采集图像,Quality one扫描分析图像,应用GADPH作为内参。以目的蛋白的灰度值与内参蛋白灰度值之比作为目的蛋白的相对表达量。实验重复3次,取平均值。
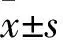
2 结果
三组BALF蛋白浓度、BALF蛋白浓度细胞总数、肺损伤病理评分、W/D比较见表1。
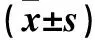
表1 三组BALF蛋白浓度、BALF细胞总数、肺损伤病理评分、W/D比较
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
对照组小鼠肺组织表面呈淡红色,光镜下可见肺组织结构完整,未见明显损伤表现;模型组小鼠肺组织表面呈暗红色并伴有明显渗出,光镜下可见肺组织结构严重破坏,肺泡壁水肿、肺泡间隔明显增宽、肺泡腔渗出并伴有大量红细胞和炎性细胞浸润等病理学改变;干预组小鼠肺组织表面渗出减少,光镜下病理性改变较LPS模型组减轻。
三组肺组织和BALF中TNF-α、IL-1β和IL-6含量比较见表2。
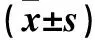
表2 三组肺组织和BALF中TNF-α、IL-1β和IL-6含量比较
注:与对照组比较:aP<0.05;与LPS模型组比较:bP<0.05。
对照组、模型组、干预组miR-214相对表达量分别为1.01±0.03、8.47±0.20、0.40±0.17。与对照组比较,模型组miR-214相对表达量升高(P<0.05);与模型组比较,干预组miR-214相对表达量降低 (P<0.05)。
对照组、模型组、干预组PTEN蛋白相对表达量分别为1.12±0.09、0.22±0.10、2.98±0.21。与对照组比较,模型组PTEN蛋白相对表达量降低(P<0.05);与模型组比较,干预组PTEN蛋白相对表达量升高 (P<0.05)。
3 讨论
2012年柏林会议将ARDS分为轻、中、重度,其中轻型ARDS即以往所说的ALI。ALI本质上是机体失控激活和自我放大的炎症反应所导致肺组织损伤,因此研究如何从基因水平抑制炎症反应及级联放大效应,对减慢ALI的进程,降低病死率,具有重要意义。miRNA是一类长19~24 nt的小分子非编码RNA,其可以通过与靶基因mRNA的3'UTR区特异性结合,在转录后水平对靶基因的表达调控,参与机体多种重要的生理及病理过程,如炎症反应、免疫应答及细胞增殖、分化、凋亡等[11]。Guo等[12]近期在研究中发现miR-125b在ARDS患者血清及LPS诱导的ALI小鼠血清及肺组织中表达明显降低,升高ALI小鼠肺组织中miR-125b的表达能够明显抑制炎症反应,从而改善LPS诱导的ALI。国内学者[13]也分别报道了敲减miR-7或者提高miR-155的表达能够有效减弱LPS所致小鼠ALI炎症反应。miR-214是miRNA重要的成员之一,在细胞生长发育、凋亡及肿瘤等方面发挥着重要的作用[14]。miR-214在LPS诱导的ALI小鼠模型肺组织中表达明显升高,提示miR-214可能作为促炎因子与LPS诱导的ALI存在着密切关系[6]。本研究发现,与对照组比较,LPS模型组BALF蛋白含量和细胞总数、肺损伤病理评分、W/D比值、肺组织和BALF中的TNF-α、IL-1β和IL-6含量明显增高,提示ALI小鼠模型建模成功,miR-214在LPS诱导的ALI模型小鼠肺组织中表达增高。miR-214在活化的T细胞中表达明显增高,通过抑制PTEN促进T细胞的增殖,从而维持T细胞的活化[4]。并且miR-214可以通过靶向抑制PTEN,减弱PTEN对PI3K/AKT信号通路的抑制,从而延缓炎性细胞的凋亡起着促炎作用[3]。miR-214是否通过对PTEN的调控参与LPS所致ALI尚未见研究报道。本研究中,模型组小鼠肺组织PTEN蛋白相对表达量下降,提示miR-214可能通过下调PTEN的表达参与ALI的发生发展。
PTEN基因位于染色体10q2313上,全称为10 号染色体上缺失的磷酸酶与张力蛋白同源物基因,PTEN是PI3K/Akt 通路主要的负性上游调节基因[3],PTEN功能丢失可激活PI3K/Akt信号传导通路。PI3K/Akt通路是机体炎症反应的最重要通路之一,PI3K-Akt信号通路的激活,可以促使NF-κB/IκB蛋白磷酸化,从而促使炎性因子大量生成[12]。PI3K/Akt通路可调节肺脏的炎症反应,调节肺损伤的发生,阻断该信号通路中的相关分子的表达能够阻断ALI的发生[14~16]。
本研究发现,与模型组比较,干预组BALF蛋白含量和细胞总数明显减少,肺损伤病理评分和W/D比值明显降低,并且肺组织和BALF中的促炎因子TNF-α、IL-1β和IL-6含量明显降低,提示下调miR-214的表达可以减轻LPS诱导的小鼠的急性肺组织损伤,抑制炎症反应。并且我们进一步发现,与模型组比较,干预组PTEN蛋白相对表达量增高,进一步证实下调miR-214对LPS诱导的ALI小鼠的保护作用可能是通过上调PTEN的表达实现的。
综上所述,下调miR-214表达可预防小鼠ALI,其机制可能与其促进PTEN蛋白的相对表达量有关。

