乌司他丁预处理对肝缺血再灌注大鼠急性肾损伤的预防作用
崔龙海,李浩,韩龙哲,李哲浩
(延边大学附属医院,吉林延吉133000)
肝脏缺血-再灌注(I/R )损伤是全身性的炎症反应,其机制尚未完全阐明。肝移植及肝癌切除术中常需阻断肝脏血流降低术中大出血的风险,但常影响肝脏及肺脏、心脏、肾脏、小肠、胰腺等远端器官的功能[1,2]。I/R时肝脏及门静脉可产生酸性代谢产物、内毒素、过氧化产物、肿瘤坏死因子(TNF-α)和其它炎症介子[3,4]等有害介质,肝血流恢复后有害介质可导致远端器官发生急性功能损害。I/R 导致的肾脏损伤严重影响患者手术效果及生存率[5]。谷胱甘肽(GSH )、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)活性和肌酐(Cr)、尿素氮(BUN)含量以及尿量是评估肝肾功能的指标,谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)是常用的氧化应激指标。乌司他丁(UTI)是从健康成年男性尿液中提取纯化得到的一种广谱蛋白酶抑制剂,能同时抑制胰蛋白酶、磷脂酶A2、弹性蛋白酶等多种酶的活性、抑制炎性介质过度释放、清除氧自由基,对重要脏器缺血性损伤具有保护作用[6,7]。白细胞介素18(IL-18)是一种致炎因子,缺血性组织中常表达升高,过度表达可导致局部组织继发性损伤[8]。研究[9]发现,血清IL-18和急性肾损伤(AKI)危重患者的住院死亡率有关,IL-18是AKI早期特异性的生物标志物之一。本课题组前期研究发现,肝脏I/R损伤模型大鼠血清IL-18水平与ALT、AST活性均升高,尿量降低,但其具体作用机制尚不明确。本研究观察了UTI预处理对肝I/R大鼠急性肾损伤的保护作用,并探讨其可能作用机制。现将结果报告如下。
1 材料与方法
1.1 动物、试剂及仪器 清洁级Wistar大鼠30只(延边大学实验动物中心提供),雌雄各半,体质量(300±20)g。IL-18、TNF-α试剂盒为武汉博士德生物工程有限公司产品,UTI注射针剂为广州天普生化医药股份有限公司产品。
1.2 大鼠分组及UTI给药方法 大鼠在IVC饲养系统适应性饲养1周后,随机分为假手术 (SO)组、I/R组、UTI组。UTI组造模前30min预处理 3万 U/kg UTI(2 mL无菌生理水溶解,右侧隐静脉给药),SO组和I/R组给予等体积生理盐水。I/R组、UTI组采用Pringle法制备大鼠肝脏I/R损伤模型:所有实验动物术前禁食12 h、10%水合氯醛麻醉、常规消毒、隐静脉置管。取腹部正中于尖突下0.5 cm处纵向切约3 cm长的切口,暴露肝门。I/R组和UTI组参照Pringle法阻断肝脏血流30 min,再灌注2 h。SO组仅解剖分离肝十二指肠韧带。
1.3 观察指标 造模后复流2 h,处死各组大鼠,下腔静脉采集血液、低温离心分离血清、-80 ℃保存。取肝脏、肾脏组织,采用比色法检测血清和肝肾组织Cr、BUN、ALT、AST、GSH、GSH-Px、SOD、MDA。采用ELISA法测定血清和肾组织IL-18、TNF-α。行膀胱穿刺并收集测算三组尿液体积,HE染色法观察肝、肾脏组织病理学改变。

2 结果
2.1 三组血清ALT、AST活性和BUN、Cr含量变化 见表1。
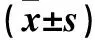
表1 三组血清ALT、AST活性和BUN、Cr含量变化
注:与SO组比较,*P<0.05;与I/R组比较,#P<0.05。
2.2 三组血清和肾组织IL-18、TNF-α含量及尿量比较 见表2。
2.3 三组清SOD和肾组织、GSH-Px、GSH、MDA含量变化 见表3。
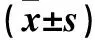
表2 三组血清和肾组织IL-18、TNF-α含量及尿量比较
注:与SO组比较,*P<0.05;与I/R组比较,#P<0.05。
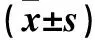
表3 各组大鼠血清SOD和肾组织、GSH-Px、GSH、MDA含量变化
注:与SO组比较,*P<0.05;与I/R组比较,#P<0.05。
2.4 三组肝脏、肾脏组织形态学变化 SO组肝脏组织细胞索排列有序,组织结构和细胞形态基本正常。I/R组肝脏组织细胞索排列无序,有明显的细胞坏死灶,炎性细胞聚集成团。UTI组肝脏病变明显轻于I/R组。见图1。SO组肾脏组织细胞形态基本正常。I/R组肾脏组织肾小球及肾间质水肿,肾小管上皮水肿、扩张、变形。UTI组肾脏病变程度轻于I/R组。见图2。

注:箭头处为坏死灶
图1三组肝脏组织病理学变化(×100)
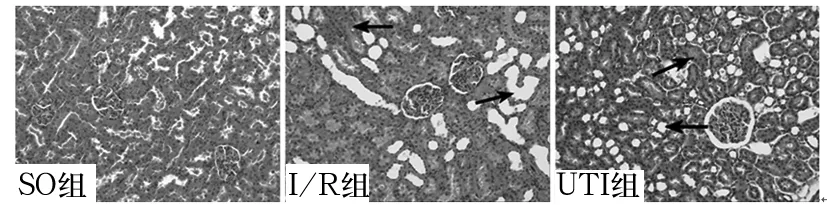
注:箭头处为坏死灶
图2三组肾脏组织病理学变化(×100)
3 讨论
肝I/R损伤是肝脏外科手术、休克、创伤以及器官移植中常见的病理过程,缺血期钙超载、氧自由基的大量产生、生物膜的破裂、各种酶的漏出和炎性介质大量释放等均与其有关[10],其中氧化应激与炎症反应在I/R损伤过程中起重要的作用。灌流不足可导致肾脏缺血,肾小球滤过率降低,从而发生急性肾功能障碍。肝I/R损伤可引起再灌注后综合征,急性肾损伤是其中的一个重要并发症[11,12]。Kupffer 细胞是肝内数量最多的定居巨噬细胞,在Toll 样受体的参与下Kupffer 细胞激活炎症反应细胞因子,其中TNF-α对触发炎症级联反应起重要作用,TNF-α附着于肝细胞表面受体,诱导产生大量的嗜中性粒细胞趋化因子、活性氧族及NF-κB等,直接造成肝损伤。而且聚集细胞间黏附因子(ICAM-1)、血管细胞黏附因子(VCAM-1),并激活中性粒细胞进入缺血后的肝脏,损伤肝细胞[13]。IL-18具有多种组织免疫活性,肝I/R时由肝脏Kuffer 细胞以及肝外巨噬细胞产生,缺血性组织中表达升高[14]。IL-18的过度表达可延迟移植肾的功能恢复[15],IL-18是少尿型急性肾损伤早期特异性的生物标志物。本研究中,I/R组大鼠血清和肾组织IL-18、TNF-α表达明显高于SO组,且随IL-18含量升高而尿量减少。镜下可见I/R组大鼠肝组织存在明显肝细胞坏死灶,并伴有大量的炎性细胞浸润,肾小球水肿以及肾小管上皮水肿、变形、扩张。表明IL-18、TNF-α等炎症因子的过度产生及IL-18、TNF-α等诱导产生的各种细胞毒性可能是造成肝I/R后继发急性肾损伤的直接原因。
肝脏I/R时由于组织细胞缺血缺氧和ATP分解增加,以及其分解产物在缺血组织内大量堆积,使氧自由基在短时间内爆发性增多,引起生物膜脂质过氧化。由于脂质过氧化使细胞膜和细胞质膜的完整性受到破坏,改变膜的流动性和通透性,造成微循环障碍,导致细胞坏死。体内抗氧化系统包括细胞内抗氧化酶和非酶性抗氧化剂,SOD和GSH-Px 是内源性抗氧化酶,其活性高低反映组织清除氧自由基的能力。GSH是人类细胞质中自然合成的一种肽,在过氧化物酶的作用下,通过巯基氧化分解体内的超氧基团,中和氧自由基对组织的损害,并能转化成容易代谢的酸性物质,加速自由基的排泄[16]。MDA是氧自由基攻击生物膜引发脂质过氧化反应的产物,组织中的含量可反映脂质过氧化程度。本实验结果I/R组大鼠血清和肾组织SOD、GSH-Px 活性和GSH含量均低于SO组,MDA含量高于SO组。表明抗氧化物质的减少和氧自由基的大量产生是肝I/R后急性肾损伤的重要原因,后者过度产生会加重组织继发性损伤。
UTI是肝脏分泌的一种机体内源性蛋白酶抑制剂,具有广泛的抑酶谱,能够抑制蛋白酶活性,抑制IL-1、IL-6、IL-10、TNF-α、血小板活化因子等细胞因子的释放,稳定溶酶体膜,减轻微循环障碍和全身炎症反应综合征,维持氧化-抗氧化系统的平衡从而减轻缺血性组织损伤,改善肾小球滤过功能和肾小管重吸收[17~19]。有临床观察报道,UTI对急性肾损伤有较好的疗效,缩短ICU住院时间,降低死亡率[20]。有细胞实验研究报道,UTI通过促进细胞增殖加快受损细胞的修复,减少毛细血管通透性,减少血管内液向组织转移,减轻组织水肿[21]。本研究中,与I/R组比较,UTI组大鼠血清和肾组织中IL-18、TNF-α 表达下调,ALT、AST酶活性和BUN、Cr、MDA含量降低,尿量和SOD、GSH-Px、GSH含量增多,肝肾组织病理学改变明显减轻。表明UTI对肝I/R后继发肾损伤具有保护作用。猜测其可能作用机制为,UTI通过减弱肝I/R对Kuffer细胞的刺激,下调IL-18、TNF-α水平及增加尿量等途径减轻肝I/R后急性肾损伤。 同时UTI可抑制IL-18诱导T细胞、NK细胞、中性粒细胞等各类炎症因子的过度产生和释放;阻断IL-18、IL-6、NF-κB、FN-γ、TNF-α 等炎症因子的级联效应;提高机体抗氧化能力、改善微循环及增加尿量等途径减轻肝I/R后急性肾损伤。
综上所述,UTI预处理可有效减轻大鼠肝I/R后急性肾损伤,其机制可能与UTI抑制IL-18、TNF-α等表达,促进GSH 、GSH-Px、SOD表达有关。

