薏苡仁油脂质体理化性质和稳定性研究
李 亮 吴文慧
(1.宜春市食品稽查支队,江西 宜春 336000;2.江西省食品药品安全监控中心,江西 南昌 330029)
脂质体自20世纪70年代开始作为药物载体应用以来,由于具有制备简单,对人体无害,无免疫原性反应,易实现靶向性,可提高和延长药物疗效,缓和毒性,避免耐药性和改变给药途径等优点备受重视。脂质体在储存过程中,由于药物渗漏、粒子的聚集以及磷脂在液态下的氧化水解等原因易被破坏使得脂质体的应用范围极大程度的受到其稳定性的限制。本研究以粒径、Zeta电位、电导率、pH值等为主要指标研究液态薏苡仁油脂质体在储藏过程中理化性质和稳定性变化[1][2]。
1 材料与设备
紫外一可见分光光度计(UV一1700):岛津UV一1700;旋转蒸发(RE-52AA):上海亚荣生化仪器厂;激光动态散射仪:英国Malvern公司;气相色谱仪;Agilent6890型;数控超声波清洗器(S KQ5200DB):昆山市超声仪器有限公司;精密pH计(pHS-3C):上海雷磁;电子天平:北京赛多利斯仪器系统有限公司;离心机TGL—16C:上海飞鸽。
大豆卵磷脂:上海源聚生物科技有限公司;胆固醇BR级:上海政翔化学试剂研究所;薏苡仁油:广州合诚实三生物有限公司;PBS(pH值分别为 6.8和7.4,按《中华人民共和国药典》2015版标准 自制);重蒸馏水;其余试剂:国产分析纯。
2 方法与结果
2.1 离心实验
用蒸馏水将薏苡仁油脂质体稀释,把不同稀释度的薏苡仁油脂质体以4500r/min离心不同时间,观察是否分层,并观察离心后的分层情况。
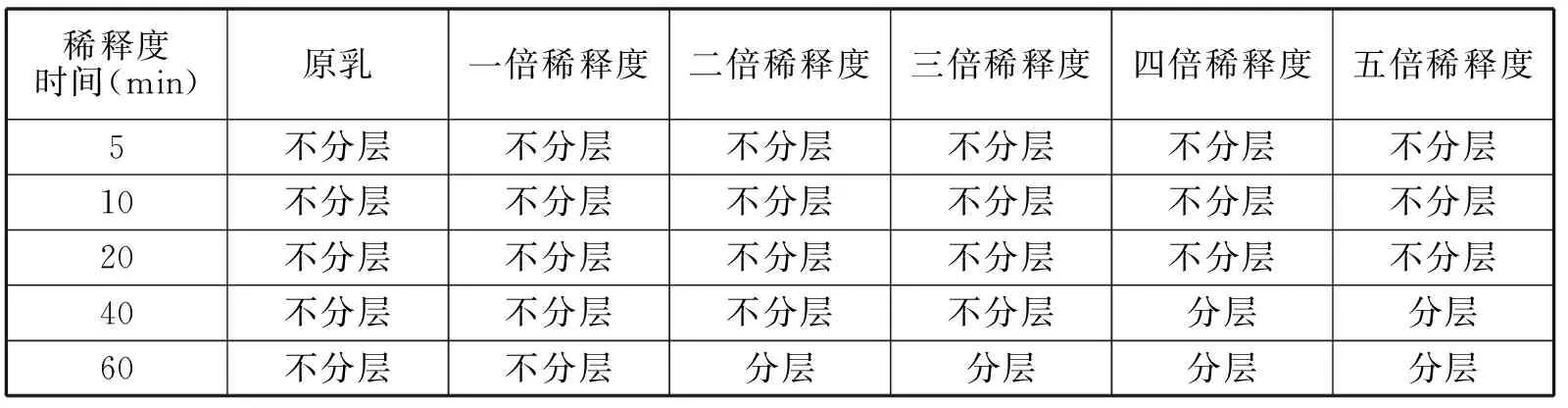
表1 不同稀释倍数薏苡仁油脂质体离心稳定实验
(1)分层的薏苡仁油脂质体都分为上、中、下三层:
滤纸扩散面积:上﹤中﹤下
视野下脂质体粒子数目:上>中>下
浊度:上>中>下
粒径:上>中>下(差距不大)
(2)将已经分层的各层物质再混合在一起,依然混合得很均匀,且在显微镜下观察和分层前没有区别,粒径也没有很大变化。离心实验说明脂质体液被稀释的倍数越高,粘度越小,越易分层(离心提高重力加速度,脂质体粒子与水相比重差加大,促进分层)。说明液态脂质体在未加入增稠剂的情况下不稳定,易分层[5]。
2.2 不同储藏温度条件下的稳定性考察
将新制备的脂质体置于4℃、35℃、45℃的恒温环境下20天,每4天定时测定黏度值、pH值、电导率结果如下。
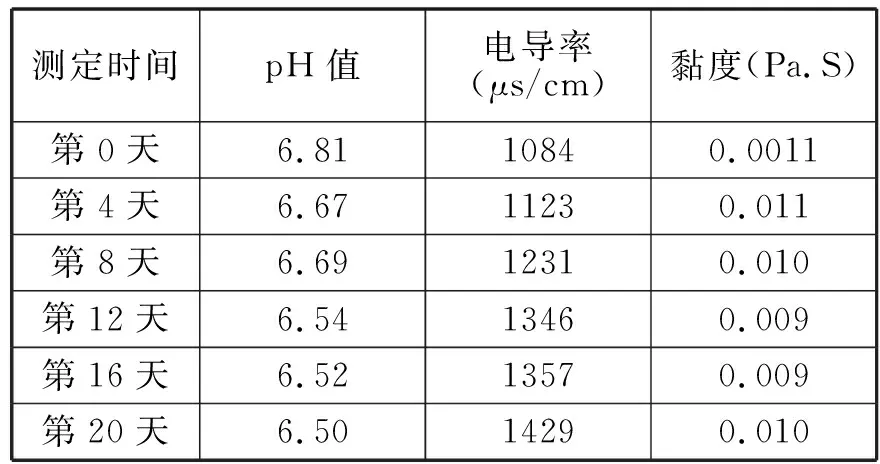
表2 4℃储藏稳定性实验
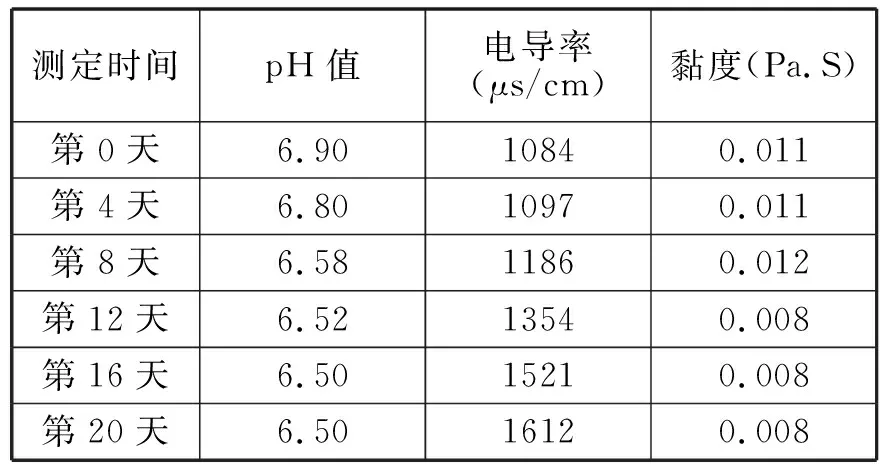
表3 35℃储藏稳定性实验
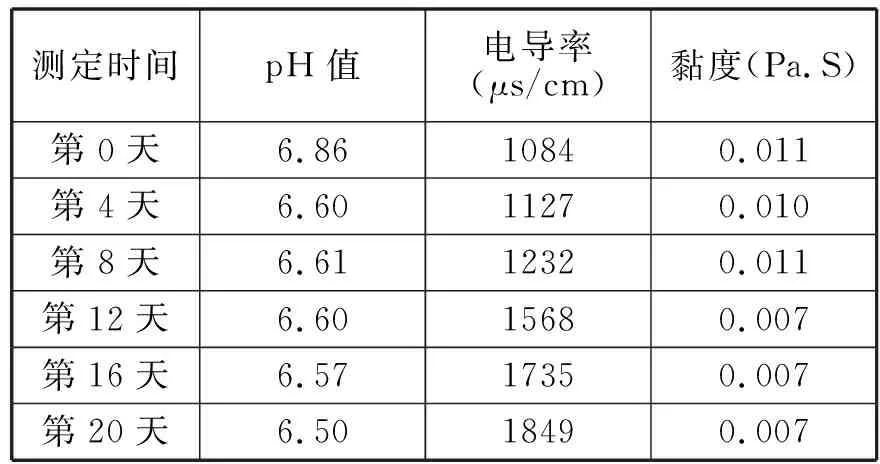
表3 45℃储藏稳定性实验
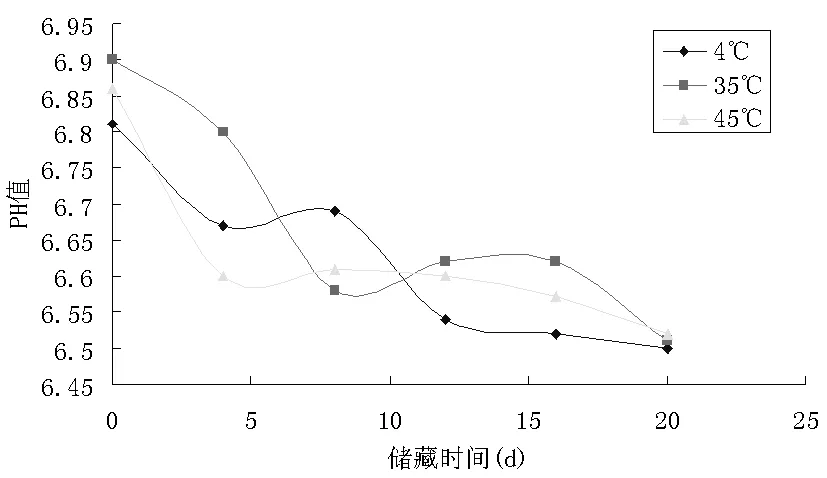
图1 不同储藏温度下脂质体PH值随时间变化规律
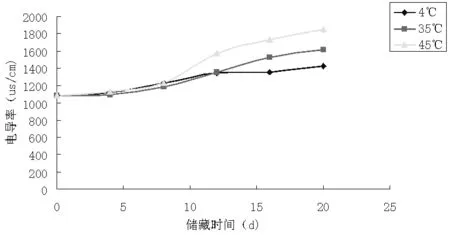
图2 不同储藏温度下脂质体电导值随时间变化规律

图3 不同储藏温度下脂质体黏度随时间变化规律
2.3 4℃下脂质体粒度与Zeta电位随时间的变化规律
zeta电位是一个表征分散体系稳定性的重要指标。由于带电微粒吸引分散系中带相反电荷的粒子,离颗粒表面近的离子被强烈束缚着,而那些距离较远的离子形成一个松散的电子云,电子云的内外电位差就叫作Zeta电位。测定悬浮颗粒的Zeta电位求得其绝对值,以其大小来表征悬浮稳定性。当悬浮微粒表面的电荷密度较高(大于30mV)时,即有绝对值较高的Zeta电位,微粒表面的高电荷密度使微粒间产生较大的静电排斥力,使得悬浮液保持较高的稳定性。而当Zeta电位的绝对值小于25mV时,微粒之间的静电斥力 液体系的不稳定,电位值的高低与悬浮液的浓度没有关系[5]。
选取4℃储藏的脂质体,考察其粒度与Zeta电位随时间的变化规律。每10天为一个测定点,结果如下:

图4 脂质体储藏的第1天的粒度与Zeta电位
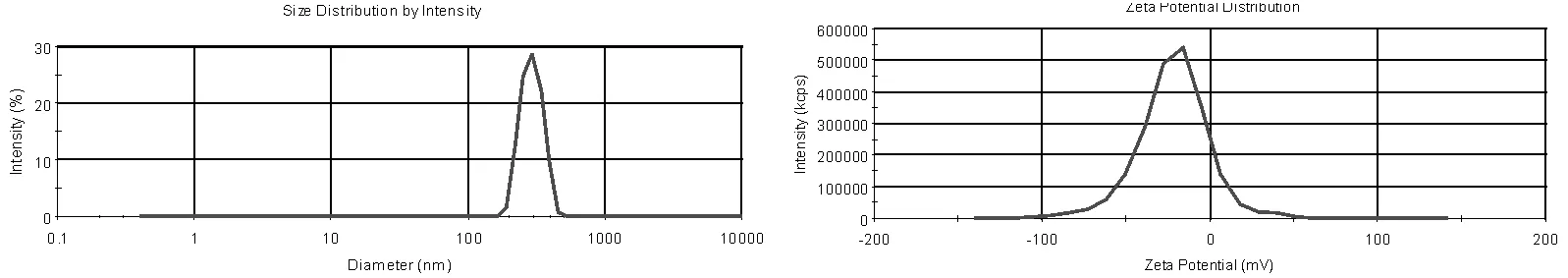
图5 脂质体储藏第10天的粒度与Zeta电位
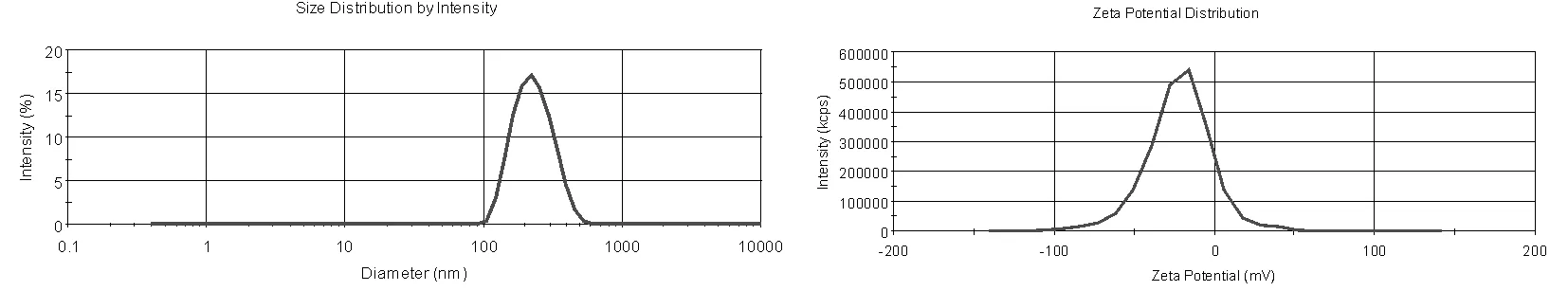
图6 第20天的粒度与Zeta电位
从上图可知第1天测量的平均粒度303.8nm,Zeta电位为-28.57mV;第10天测量的平均粒度为296.6nm,Zeta电位为-22.2mV;第20天测量的粒度为222.5nm,Zeta电位为-19.34mV。 三次所测粒度的平均数值分别为:303.8nm,296.6nm,222.5nm及粒度的平均值依次减小,这说明随着时间的推移,脂质体中的较大颗粒或杂质已凝聚或沉降,剩下的脂质体颗粒粒度较小。本制剂所带电荷为负电且其绝对值小于30mV说明,制备的脂质体不够稳定所以才会凝聚导致粒度下降。三次所测的zeta平均电位分别为:-25.57mV,-22.2mV,-19.34mV,电位值逐渐减小,可能是由于磷脂水解产生大量的带正电荷的离子的原因[5]。
本制剂所带电荷为负电且其绝对值小于30mV说明,制备的脂质体不够稳定所以才会凝聚导致粒度下降。三次所测的zeta平均电位分别为:-25.57mV,-22.2mV,-19.34mV,电位值逐渐减小,可能是由于磷脂水解产生大量的带正电荷的离子的原因[5]。
2.4 液态薏苡仁油脂质体中的油酸、亚油酸在储藏过程中的变化
采用气相柱为CP-Sil 88熔融石英毛细管柱(100m×0.25mm,Chrompack,Bridgewater,NJ),H2为载气,燃烧气体为H2、N2和空气。升温程序为:45℃/4min—(13℃/min)—175℃/27min—(4℃/min)—215℃/35min,测定时间为86min;气相的进样品条件:进样口温度250℃,压力24.52psi。气相柱的柱压为24.52psi,柱内流速为1.8ml/min。检测器的温度:250℃。FID检测器氢气流速为30.0ml/min;空气流速为300ml/min;氮气流速为30.0mL/min[2]。
考察乙醇注入—超声法制备的液态薏苡仁油脂质体,在4℃的条件下储藏过程中油酸与亚油酸含量变化如下:
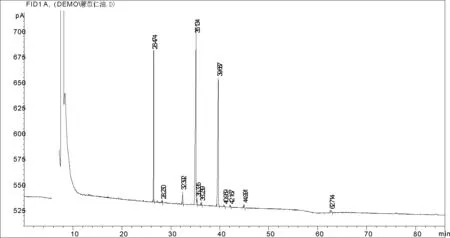
图7 新制备好的薏苡仁油脂质体中的气相谱图
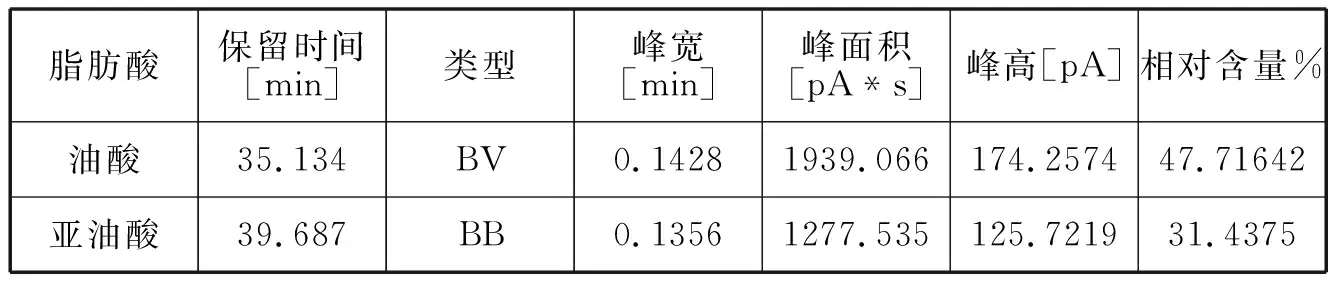
脂肪酸保留时间[min]类型峰宽[min]峰面积[pA*s]峰高[pA]相对含量%油酸35.134BV0.14281939.066174.257447.71642亚油酸39.687BB0.13561277.535125.721931.4375

图8 放置10天后薏苡仁油脂质体的气相谱图
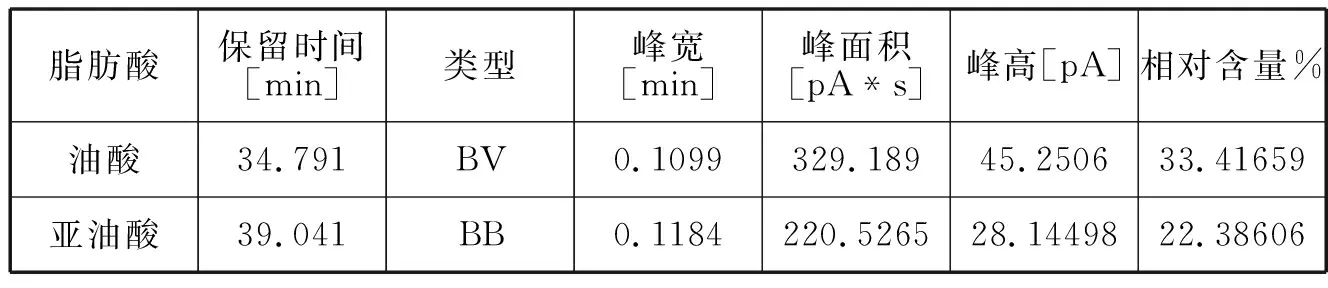
脂肪酸保留时间[min]类型峰宽[min]峰面积[pA*s]峰高[pA]相对含量%油酸34.791BV0.1099329.18945.250633.41659亚油酸39.041BB0.1184220.526528.1449822.38606
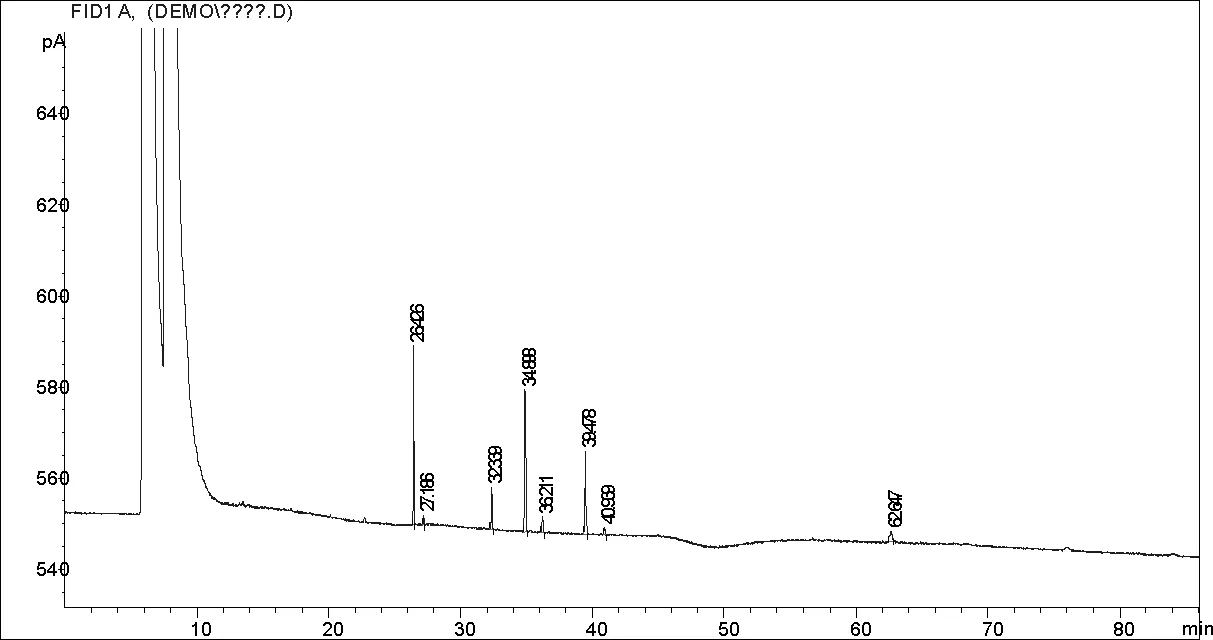
图9 放置20天后薏苡仁油脂质体中谱图
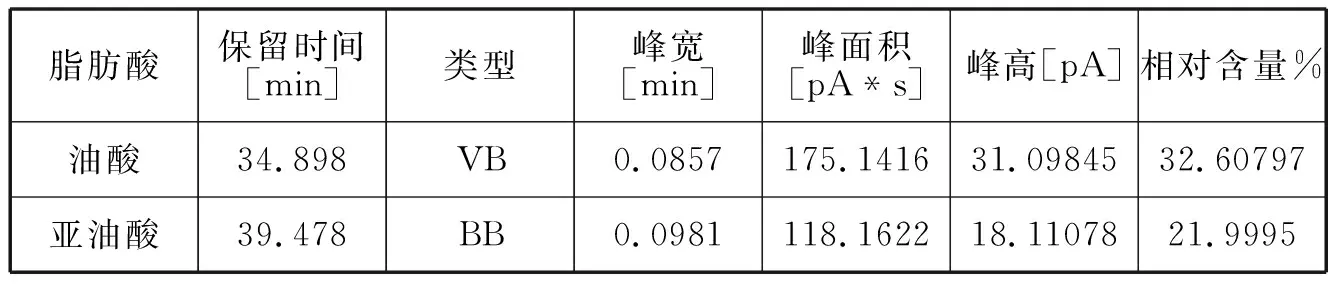
脂肪酸保留时间[min]类型峰宽[min]峰面积[pA*s]峰高[pA]相对含量%油酸34.898VB0.0857175.141631.0984532.60797亚油酸39.478BB0.0981118.162218.1107821.9995
油酸与亚油酸是薏苡仁油的主要功能性成分,对比新制备的薏苡仁油脂质体和放置10天与20天之后的脂质体中的的油酸和亚油酸含量发现,油酸和亚油酸含量比较稳定,经过二十天后减少得比较少。可见脂质体能够比较好的保护其中的薏苡仁油不被氧化[5]。
3 结论与讨论
从脂质体离心实验可以看出液态脂质体不稳定,要稳定保存液态脂质体,必须加入增稠剂或尽可能的减小脂质体的粒度。
实验所设计的三个温度段中,脂质体的pH值均下降了,是由于磷脂的水解产生了H+离子。从而使缓冲溶液的pH值下降了。从储藏终点的pH值可以看出,磷脂稳定的最适pH值为6.5。所以在脂质体储藏过程中可以调节好磷酸缓冲溶液的pH值使其为6.5,通过这一途径可以在一定程度上抑制磷脂的水解,避免其产生过氧化物、丙二醛、脂肪酸及溶血卵磷脂等。实验所设计的三个温度段中,电导值随时间的推移都明显增大,说明脂质体在有水存在的情况下很不稳定,磷脂水解产生大量的带电离子。由此可见将液态脂质体干燥的必要性质。温度越高,电导值增加得越多。对比其电导率增大的速率得出4℃时,为其储藏较稳定温度。
实验所设计的三个温度段中,4℃时的脂质体粘度值随时间的推移基本保持恒定,35℃、45℃时的脂质体粘度值随时间推移会略有下降。温度越高,粘度值下降得越多。黏度数据同样说明了在4℃时液态脂质体相对较稳定。这说明脂质体双分子层的稳定性与贮藏温度有密切的关系,温度升高,脂质体双分子层中的酰基从有序变为无序排列,膜由凝胶态转变为液晶态,流动性增加,包封的薏苡仁油出现泄漏[3]。
由于脂质体表面形成扩散双电层,在双电层的滑动面上产生电动电位,称为Zeta电位。荷电的脂质体能够减少脂质体微粒间的聚集和融合,增加脂质体的稳定性。制备的液态薏苡仁油脂质体zeta电位值小于30mV不够稳定所以会凝聚导致粒度下降。三次所测的zeta平均电位分别为:-25.57mV,-22.2mV,-19.34mV,电位值逐渐减小,是由于磷脂水解产生大量的带正电荷的离子的原因。
——有效的抗弓形虫药物靶标

