BeH2与小分子间双氢键的NPA、AIM分析
冯 璐
(辽宁石化职业技术学院,辽宁 锦州 121000)
采用MP2/6-311++g(3df,2p)方法和B3LYP/6-311++g(3df,2p)方法计算出的BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系,通过几何结构与相互作用能分析可知,BeH2与HY(Y=CH3,C2H3,C2H,CN,NC)形成的复合物,其能量的变化趋势为BeH2…CH4BeH2…C2H4BeH2…C2H2BeH2…HCNBeH2…HNC,H…H距离的变化规律与能量变化趋势相反,即键能越大H…H距离越小。BeH2…CH4和BeH2…C2H4体系存在弱的范德华相互作用;BeH2…C2H2、BeH2…HCN、BeH2…HNC体系的键能和H…H间距离都符合双氢键的定义,且形成的双氢键体系为直线型[1-3]。
1 计算方法
采用MP2/6-311++g(3df,2p)方法和B3LYP/6-311++g(3df,2p)方法计算BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系的电荷布居分析(NPA),亦采用键临界点的拓扑数据(AIM)研究了BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系的成键情况。
2 电荷布居分析(NPA)和AIM拓扑分析
BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系的电荷布居分析(NPA)列于表1中,从中我们可以发现到:
(1)无论是MP2方法还是B3LYP方法,复合物的NPA数据与相应单体的NPA数据是完全不同的,这很明显是由于化学环境的变化和双氢键的形成,如MP2方法下BeH2单体分子中H原子的NPA数据和相应的双氢键体系BeH2…C2H2中的NPA数据分别为-0.622和-0.642,这表明形成双氢键体系后,有电子转移到BeH2分子中的H原子上。十分有趣的是,形成双氢键体系后,金属氢化物分子BeH2带有正电荷,而HY(Y=CH3,C2H3,C2H,CN,NC)分子带有负电荷,这说明电荷从BeH2分子转移到HY分子。
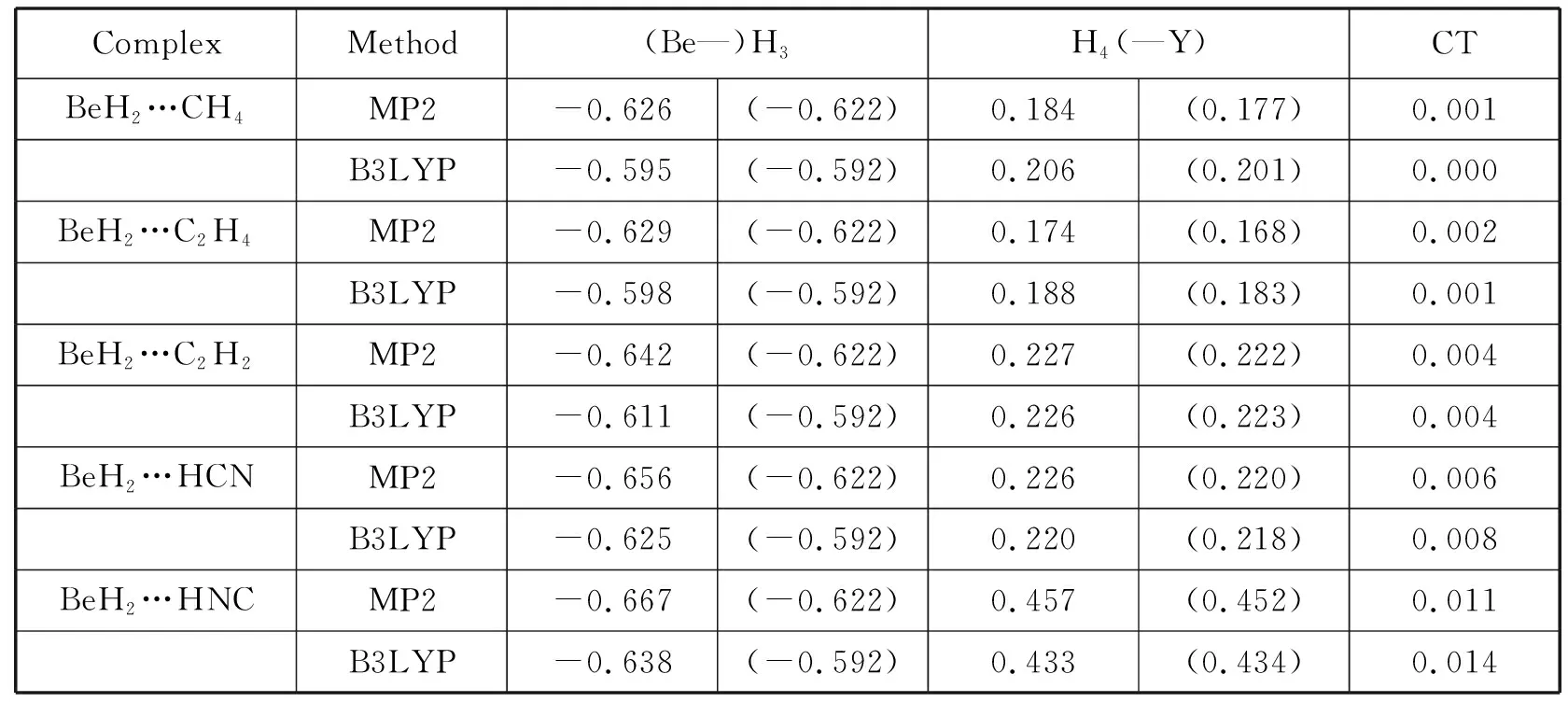
表1 BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系的电荷布居分析(NPA)数据。CT—从质子受体转移到质子供体的电荷。所有计算都是在6-311++g(3df,2p)基组下进行。
a相互作用体系中原子的编号:H2—Be1—H3…H4—Y5
MP2/6-311++g(3df,2p)方法下,BeH2…C2H2,BeH2…HCN和BeH2…HNC这三个双氢键体系电荷的转移量分别为0.004,0.006和0.011。
(2)MP2和B3LYP方法计算出的BeH2…C2H2,BeH2…HCN和BeH2…HNC体系内BeH2分子中参与形成双氢键的H原子上的负电荷都是递增的,例如MP2方法计算的H原子上的电荷值分别为-0.642、-0.656和-0.667,而HY(Y=CH3,C2H3,C2H,CN,NC)分子中参与形成双氢键的H原子上的正电荷(MP2方法)数值分别为0.227,0.226和0.457。以上的计算结果无疑导致了键能的变化规律为BeH2…C2H2BeH2…HCNBeH2…HNC。
(3)与MP2方法相比较,虽然B3LYP方法给出了同样的变化规律,比如形成双氢键体系后电荷的变化,但两种方法所得到的结果中依然存在着一些差异。例如,双氢键体系中金属氢化物分子BeH2中各原子的电荷用B3LYP方法计算出的值要略小于MP2方法的值,这表示采用B3LYP方法时,电子在金属周围的聚集以及金属氢化物的离子性特征都不明显。
表2 BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系以及相应单体中键临界点的电子密度c(e/a03)和电子密度的Laplacians 2c (e/a05)。所有计算在6-311++G(3df,2p)水平进行。
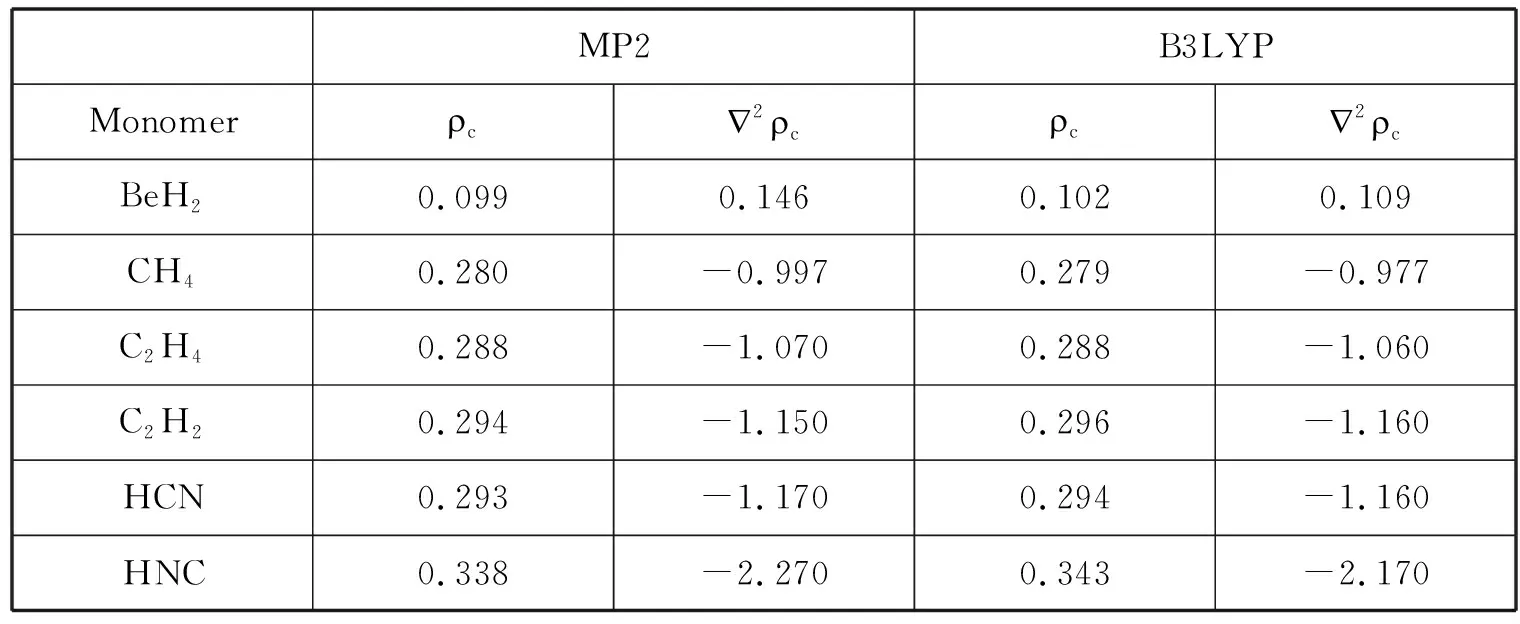
表2 BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系以及相应单体中键临界点的电子密度c(e/a03)和电子密度的Laplacians 2c (e/a05)。所有计算在6-311++G(3df,2p)水平进行。
MP2B3LYPMonomer〠c2〠c〠c2〠cBeH20.0990.1460.1020.109CH40.280-0.9970.279-0.977C2H40.288-1.0700.288-1.060C2H20.294-1.1500.296-1.160HCN0.293-1.1700.294-1.160HNC0.338-2.2700.343-2.170
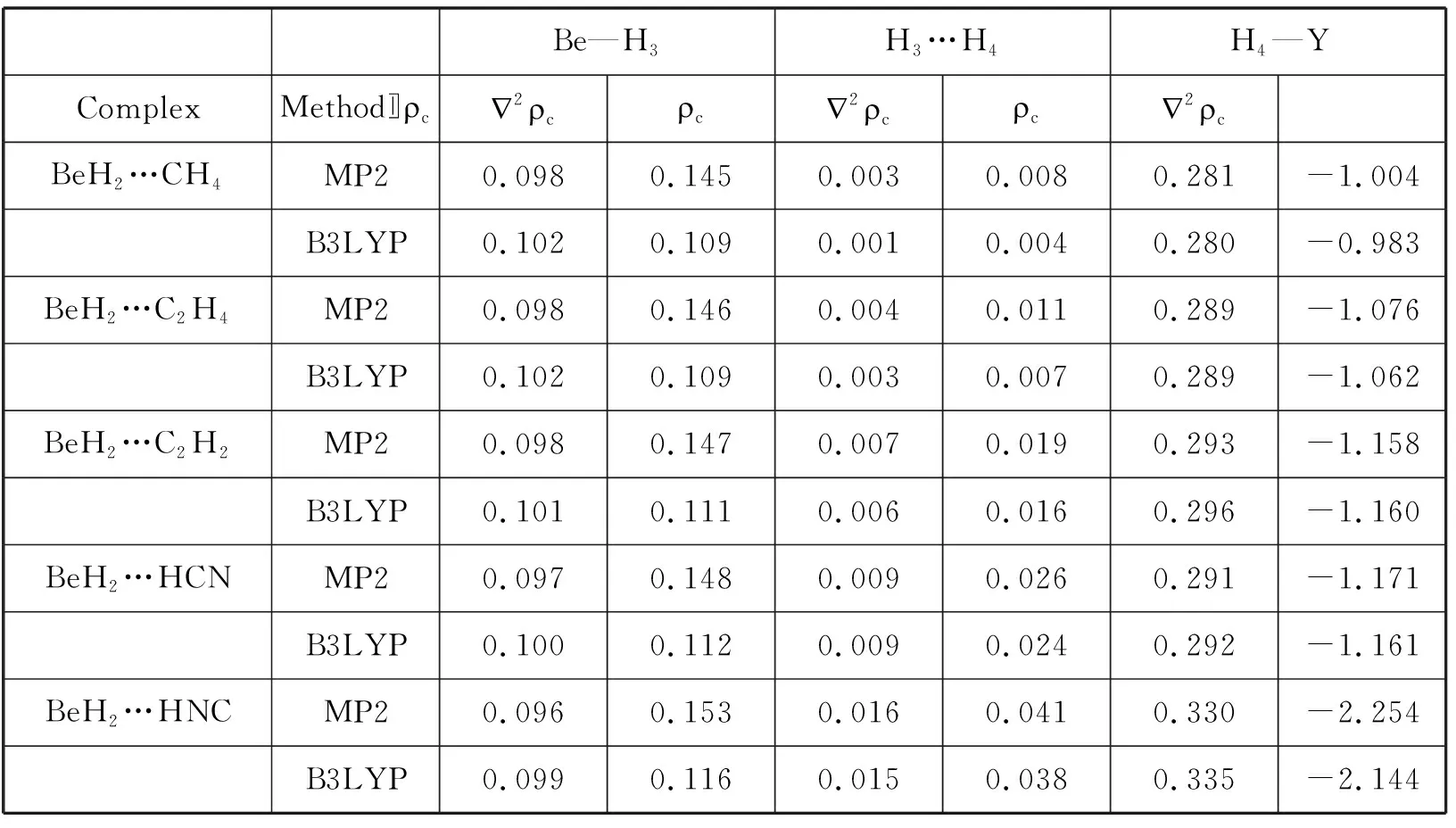
Be—H3H3…H4H4—YComplexMethod〛〠c2〠c〠c2〠c〠c2〠cBeH2…CH4MP20.0980.1450.0030.0080.281-1.004B3LYP0.1020.1090.0010.0040.280-0.983BeH2…C2H4MP20.0980.1460.0040.0110.289-1.076B3LYP0.1020.1090.0030.0070.289-1.062BeH2…C2H2MP20.0980.1470.0070.0190.293-1.158B3LYP0.1010.1110.0060.0160.296-1.160BeH2…HCNMP20.0970.1480.0090.0260.291-1.171B3LYP0.1000.1120.0090.0240.292-1.161BeH2…HNCMP20.0960.1530.0160.0410.330-2.254B3LYP0.0990.1160.0150.0380.335-2.144
我们也采用键临界点的拓扑数据研究了BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系的成键情况,表2中列出了H—Y、H…H及直接与H—Y作用的Be—H键的键临界点(bond critical points)的电子密度(c)和Laplacians量(2c),相应单体中H—Y、Be—H键的键临界点的电子密度(c)和Laplacians量(2c)也列于表中。按照Bader的AIM(Atoms in molecules)理论,常规氢键的电子密度(c)在0.002-0.04之间,电子密度的Laplacians量(2c)在0.024-0.15之间。从表中数据我们可以看出,对我们所研究的BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系,只有BeH2…C2H2、BeH2…HCN和BeH2…HNC体系中H…H的电子密度(c)和Laplacians量(2c)都在Bader定义的常规氢键范围内(BeH2…C2H2中的2略小于0.024),这也说明我们所研究BeH2…C2H2、BeH2…HCN和BeH2…HNC双氢键复合物体系在强度上相当于常规氢键。
由表2还可知对于BeH2…HY(Y=CH3,C2H3,C2H,CN,NC)体系,其H…H的电子密度(c)和Laplacians量(2c)随着键能的增加而增大。由以上讨论可知能量的变化趋势为BeH2…CH4BeH2…C2H4BeH2…C2H2BeH2…HCNBeH2…HNC,MP2方法计算出的相应的电子密度(c)数值为0.003、0.004、0.007、0.009和0.016;Laplacians量(2c)为0.008、0.011、0.019、0.026和0.041。
3 结论
BeH2与HY(Y=CH3,C2H3,C2H,CN,NC)形成的复合物,其能量的变化趋势为BeH2…CH4BeH2…C2H4BeH2…C2H2BeH2…HCNBeH2…HNC,H…H距离的变化规律与能量变化趋势相反,即键能越大H…H距离越小。进一步的NPA计算表明,双氢键体系内HY分子中参与形成双氢键的H原子上的正电荷是递增的,双氢键体系中受体H原子上的负电荷具有相同的变化规律。H…H间的拓扑数据亦说明BeH2…C2H2、BeH2…HCN、 BeH2…HNC体系形成的双氢键在强度上相当于常规氢键,H…H键临界点的电子密度和Laplacians值都与双氢键强度成线性关系,即双氢键键能越大H…H键临界点的c和2c数值越大。

