TAK242干预早期LPS诱导小鼠急性呼吸窘迫综合征的机制研究
姜 芸, 吴 莉
(新疆医科大学附属肿瘤医院综合内二科, 乌鲁木齐 830011)
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是由肺内或肺外原因引起的急性肺间质性炎和肺泡-毛细血管膜损伤,最终造成血氧过低、肺动脉高压及肺内微血栓的形成并导致严重的呼吸衰竭[1],近年来越来越多的研究表明炎症细胞的过度活化和促炎-抗炎介质的稳态失衡是ARDS发病的主要机制[2-3]。脂多糖(lipopolysaccharides, LPS)可通过刺激单核/巨噬细胞产生并释放大量炎症因子引发机体炎性损伤[4],其中Toll样受体4(toll-like receptor 4, TLR4)是介导LPS应答的主要受体之一,细胞膜受体识别并结合LPS后分别激活下游NF-κB和JNK/SAPK激活下游TLR4信号通路造成相关信号分子的异常表达[5-6]。另一方面,肺内炎症细胞分泌大量细胞因子,形成瀑布效应,进一步加剧肺内和全身的炎性反应,深入研究多种炎症因子及抗炎因子在炎性反应中的变化规律有助于发现药物治疗的新靶点。TLR4信号抑制剂TAK242能特异性阻断TLR4细胞内结构域TIR Toll/IL-1受体,而TAK242在LPS诱导ARDS小鼠相关炎性介质级联反应中尚未见报道,本研究通过注射LPS模拟脓毒血症致小鼠ARDS的发病过程,初步探究TAK242对体内细胞因子和炎性介质表达变化的影响,为临床靶向治疗ARDS提供新的依据。
1 材料与方法
1.1材料无特定病原体(specific pathogens free, SPF)级6~8周龄成年雄性BALB/c小鼠45只,均购自新疆医科大学动物实验中心,饲养及实验取材过程中严格遵守实验动物伦理保护等相关规定;LPS(Sigma);TAK242(Med Chem Express);TLR4(ab22048)、肿瘤坏死因子-α(TNF-α)(ab6671)、白细胞介素-6(IL-6)(ab100712)抗体均购自Abcam公司,辣根酶标记山羊抗小鼠IgG(AB-2305)购自北京中杉金桥生物技术有限公司;TNF-α、IL-6 ELISA试剂盒均购西安英杰生物科技有限公司;TRIzol(Invitrogen);反转录试剂盒及荧光定量PCR试剂盒(TAKARA);RIPA裂解液、BCA蛋白定量试剂盒均购自英杰生物科技有限公司,检测引物由大连宝生物工程有限公司设计合成,引物序列见表1。

表1 引物序列
1.2建立LPS诱导小鼠ARDS模型及评估
1.2.1 ARDS模型建立 取45只小鼠随机分为3组,每组15只,分别为未行尾静脉注射的对照组,尾静脉注射5 μg/g LPS的ARDS组,尾静脉给予与ARDS组等体积无菌生理盐水的假手术组,诱导小鼠产生脓毒血症,分组依据及建模方法参照文献的方法。建模后行动脉血气分析,检测动脉血氧分压(PaO2)及吸入氧浓度(FiO2),以PaO2/FiO2<300 mmHg为建模成功[7]。
1.2.2 肺组织HE染色评估ARDS模型 造模完成后,立即在等同的时间点取3组小鼠左侧肺组织置于4%多聚甲醛溶液(4℃,pH7.4)中固定6~8 h后以石蜡包埋,冠状面切片(5 μm),经HE染色后在显微镜下观察肺部形态,参照美国胸科协会(American thoracic society, ATS)对急性肺损伤的评定系统[8],分别从肺泡充血、出血、肺泡腔或血管壁中性粒细胞浸润或聚集、肺泡增厚或透明膜形成等4个方面检测肺组织损伤情况,通过小鼠生存状态及病理切片等指标评估ARDS模型建立的有效性。
1.2.3 TAK242对ARDS模型小鼠的影响 基于LPS诱导雄性BALB/c小鼠ARDS模型,取45只小鼠随机分为3组,每组15只,分别为尾静脉给予5 μg/g LPS的ARDS组,尾静脉给予5 ng/g TAK242+5 μg/g LPS的TAK242+ARDS组以及尾静脉给予等体积无菌生理盐水的空白对照组。造模成功立即同时分别取各组小鼠肺、肺泡灌洗液进行下一步实验检测。
1.3酶联免疫吸附实验(ELISA)测定肺泡灌洗液中TNF-α、IL-6含量沿小鼠腹部前正中线打开胸腔并结扎右肺门,以外径2 mm头皮针剪去部分作为气管导管插入暴露的左主支气管内,缓慢推注约2 mL常温生理盐水对小鼠肺部灌洗3次,每次以回收液体体积>1 mL为灌洗回收标准,收集的肺泡灌洗液4℃ 4 000 r/min低速离心10 min,取上清采用TNF-α、IL-6 ELISA试剂盒检测含量,ELISA检测操作严格参照试剂盒说明书进行。
1.4Real-timePCR检测相关mRNA表达取各组小鼠右肺上叶组织剪碎,加入液氮充分研磨后加入TRIzol,参照TRIzol试剂说明书提取肺组织总RNA,经逆转录后获得cDNA,参照荧光实时定量PCR试剂盒说明书定量检测TLR4、TNF-α、IL-6相关mRNA表达变化。设置反应条件如下:95℃预变性5 min,随后按95℃变性1 min,55℃退火2 min,72℃延伸1 min的程序设置40次循环,循环完成后设置95℃ 15 s,60℃ 1 min,95℃ 15 s做溶解曲线。每个样品均配3个副孔,实验重复3次,同时做阴性对照组排除PCR污染及引物二聚体干扰。以采集到的荧光信号值(Ct值),计算2-△△Ct值分析相关mRNA在各组细胞中表达水平的变化。
1.5Westernblot检测相关蛋白表达取各组小鼠肺组织50 mg,加入含1 mmol/L PMSF的RIPA裂解液,置于冰上采用组织匀浆器充分匀浆,裂解20 min,4℃12 000 r/min离心15 min,收集上清。经BCA蛋白定量试剂盒定量检测蛋白含量后各取50 μg蛋白1:1加入1×SDS上样缓冲液煮沸变性蛋白。行10%SDS-PAGE凝胶电泳,电泳结束后将上述蛋白转至PVDF膜,抗体孵育后至凝胶成像仪显色曝光,检测目的蛋白条带。
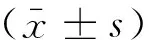
2 结果
2.1LPS诱导ARDS模型有效性造模过程中,对照组及假手术组小鼠精神状态正常,呼吸平稳,无异常活动表现;ARDS组小鼠精神状态紊乱,出现呼吸急促,活跃程度减弱等病症现象。解剖过程中肉眼可见模型组小鼠肺组织出现明显肿胀,颜色暗红。HE染色切片观察如图1,ARDS组小鼠较正常对照组小鼠和假手术组小鼠肺组织炎症反应明显,肺泡及肺泡隔的结缔组织内均可见大量炎性细胞浸润。ARDS组肺组织病理现象符合ARDS动物模型标准,证明模型建立有效。
对照组

假手术组

ARDS组
图1HE染色观察LPS诱导小鼠ARDS模型肺组织病理表现
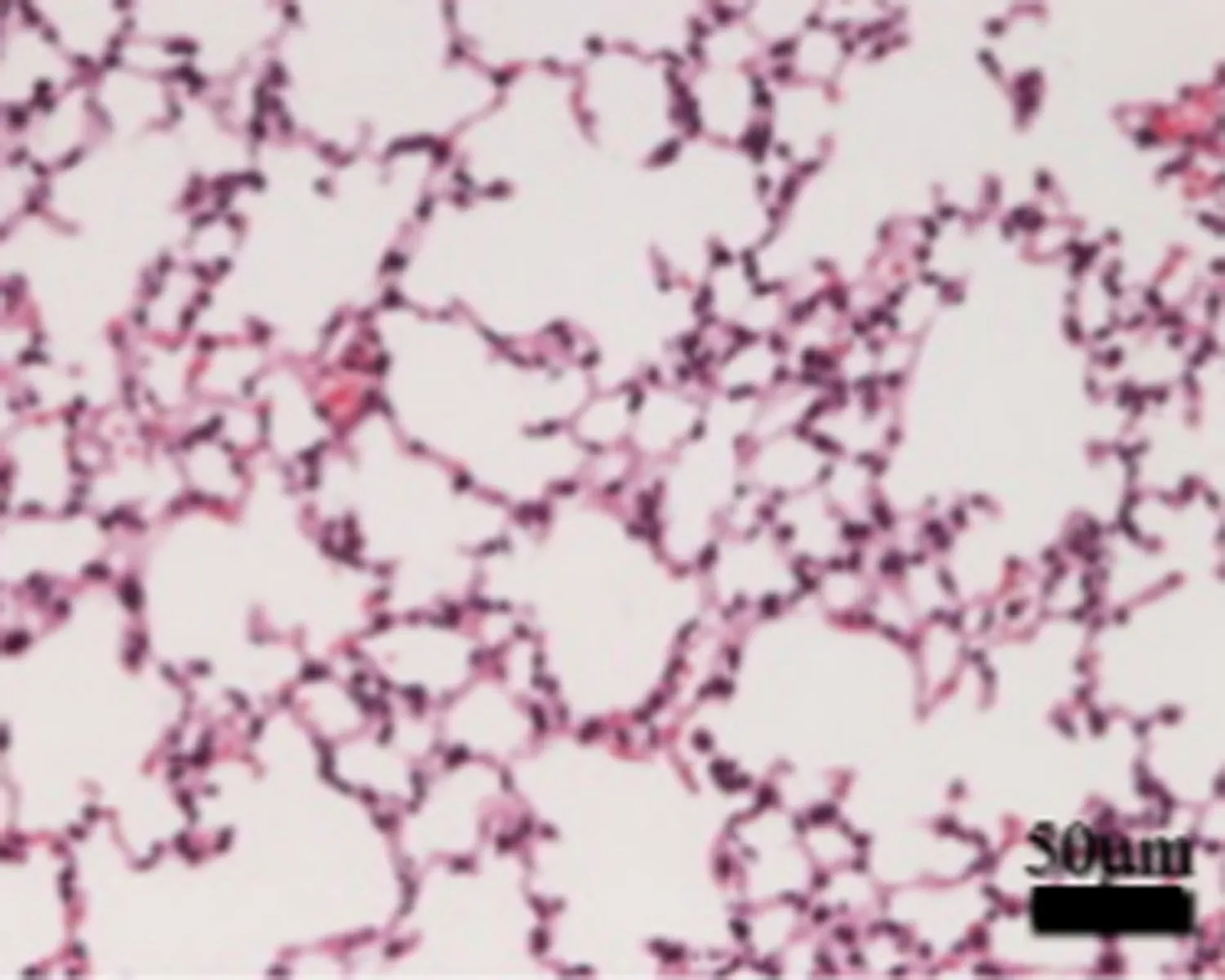
2.2TAK242抑制LPS诱导的小鼠ARDS疾病模型给予TAK242诱导后小鼠肺组织中细胞因子表达发生明显变化,ARDS组小鼠肺组织中TLR4、TNF-α、IL-6 mRNA及蛋白表达量均明显高于对照组(P<0.05),给予TAK242治疗后相关细胞因子表达量相应减少(图2、3)。给予TAK242组别的小鼠较ARDS组小鼠TNF-α、IL-6含量明显降低(P<0.05)(表2)。HE染色显示TAK242有效地缓解了LPS诱导的小鼠肺组织炎症反应,肺泡及肺泡隔的结缔组织内炎性细胞浸润减少,ARDS小鼠肺组织病理状态出现退行性改善,见图4。
3 讨论
ARDS是世界性的公共卫生难题,截至2015年, 其死亡率已高达55%,目前的治疗手段常包括机械通气治疗与非机械通气治疗两大类[9-10],仍缺乏特效治疗措施。 近年来的研究显示炎症反应在ARDS的发生、发展中发挥重要作用,肿瘤坏死因子(tumor necrosis factor, TNF)、白细胞介素(interleukin, IL)、集落刺激因子(colony stimulating factor, CSF)等促发瀑布式炎症级联反应,炎性细胞和炎性介质构成了ARDS炎性反应和免疫调节的“细胞因子网络”[11-13]。除了有效的抗感染外,精确的调控平衡ARDS发病过程中的炎性介质,下调过度炎症反应,减少炎症细胞及炎症介质对肺组织结构和细胞的破坏,维持呼吸系统功能在ARDS的治疗中显得尤为重要。其中TLR4信号通路是目前发现的重要的炎性通路之一,其特异性拮抗剂与LPS诱导ARDS小鼠模型相关炎性介质级联反应未见报道,故开展上述研究。

表2 3组小鼠肺泡灌洗液中TNF-α、IL-6含量比较
注:与对照组比较,*P<0.05; 与ARDS组比较,#P<0.05。
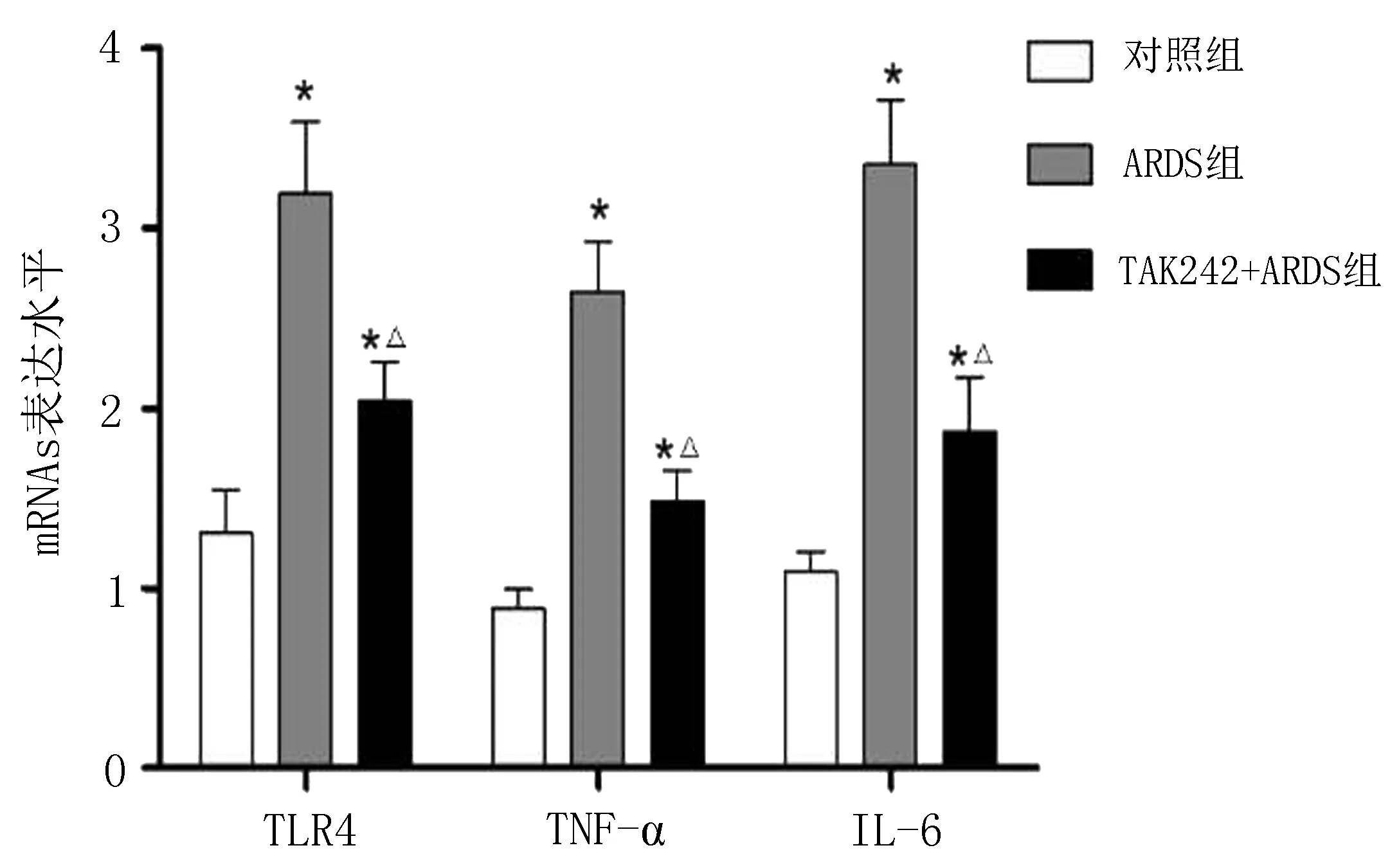
图2 RT-PCR检测肺组织中相关mRNAs表达变化
注: 与对照组比较,*P<0.05;与ARDS组比较,△P<0.05。

图3 WB检测肺组织中相关蛋白表达变化

对照组

ARDS组
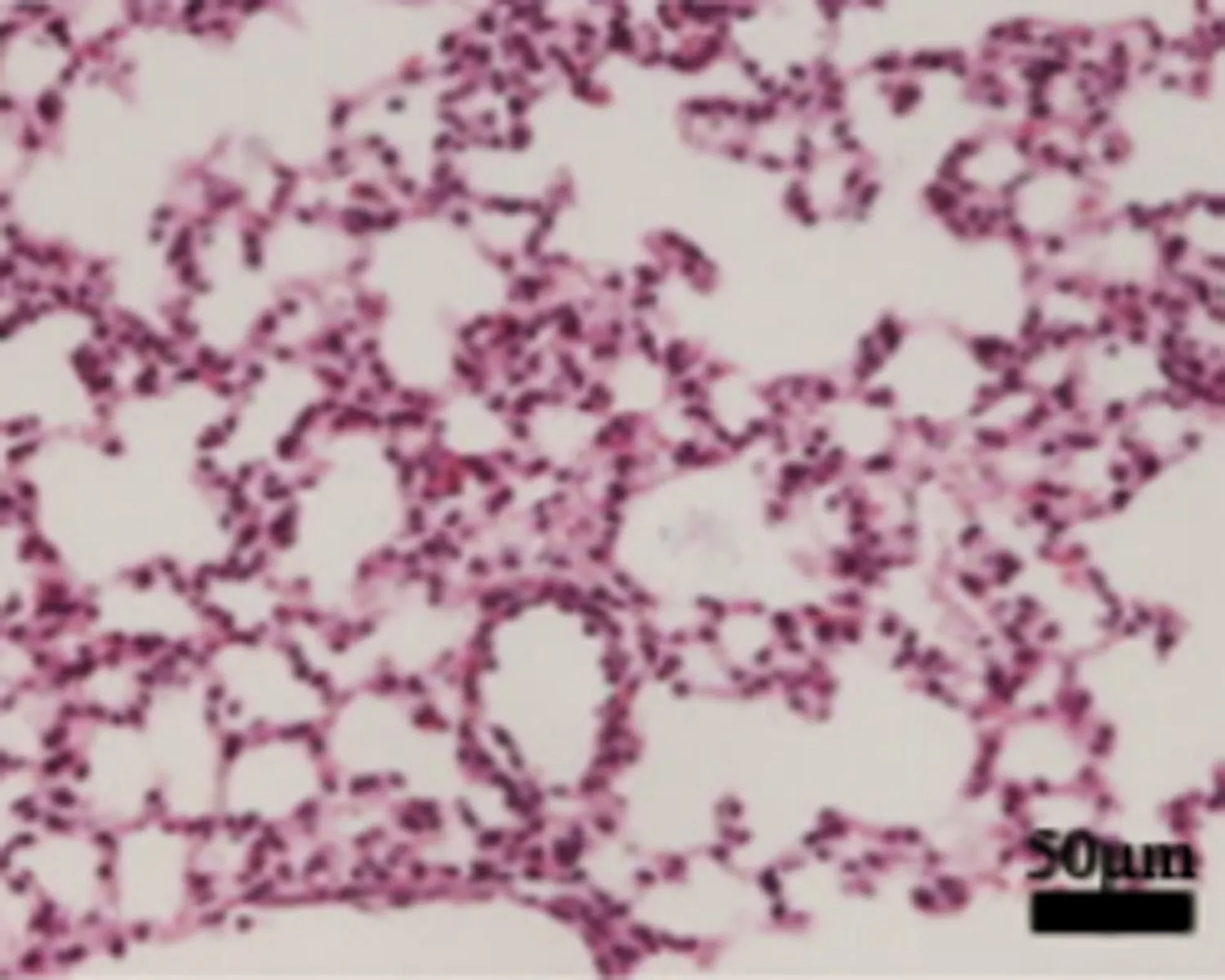
TAK242+ARDS组
图4HE染色观察TAK242对LPS诱导ARDS小鼠肺组织病理状态的改变
本研究首先通过LPS诱导构建ARDS小鼠模型,通过小鼠生存活动状态、动脉气血分析、肺组织形态及HE染色等方法验证建模有效性。通过给予ARDS小鼠TLR4抑制剂TAK242进一步验证TLR4信号通路与下游炎性介质级联反应在ARDS小鼠中的作用。研究发现,给予TAK242后小鼠肺组织中TLR4 mRNA及蛋白水平较模型组明显减少,同时TNF-α、IL-6 mRNA及蛋白表达随之降低(P<0.05)。同时,通过ELISA检测小鼠肺灌洗液中TNF-α、IL-6的含量,本研究发现给予TAK242后小鼠肺灌洗液中TNF-α、IL-6等炎症因子含量较ARDS组明显降低(P<0.05),该结果提示,TAK242可能通过特异性阻断胞内TIR受体阻断TLR4受体下游信号传导,继而影响LPS诱导的炎症反应的激活。其作用机理主要是由于作为首要的模式受体家族成员之一,TAK242对TLR4抑制主要通过减少由其介导的含Toll白介素1受体域衔接蛋白(TIRAP)、粘附分子(ICAM-1)及TRAM的表达,抑制下游转化生长因子β激活激酶1(TAK1)的激活,进而抑制p38、胞外信号调节激酶(ERK1/2)等重要转录因子的激活[14-15],削弱体内炎症反应进程,最终达到对LPS诱导的ARDS小鼠病理状态的改变。另一方面,TLR4、TNF-α、IL-6等细胞因子表达的减少,肺泡和肺泡隔的结缔组织内炎性细胞浸润也会随之减弱,在一定程度上对LPS诱导的ARDS小鼠病理状态改变起到促进作用。
综上所述,本研究发现TAK242对治疗LPS诱导的ARDS小鼠具有一定的积极作用,这种作用可能通过靶向TLR4下调TNF-α、IL-6等炎症因子实现,TAK242可能作为有效的抑制剂在ARDS发挥重要作用。但与此同时,生物体内的炎症级联反应是一个复杂多样生物学过程,仍需要从整体、器官、细胞、分子多多水平多层次进行考虑,综合分析多种动态易感因素的影响,最终达到对ARDS早期干预和治疗的目的。

