人非小细胞肺癌微血管内皮细胞原代培养方法改进
张 峤, 郝少欢, 吴 梅, 帕提古丽·阿尔西丁
(1新疆医科大学附属肿瘤医院肺癌一病区, 乌鲁木齐 830011; 2新疆喀什地区第一人民医院肿瘤科, 新疆 喀什 844000)
肿瘤抗血管治疗是目前肺癌治疗的热点之一,血管内皮细胞(ECs)是覆盖于血管内表面的单层扁平上皮细胞,与其下层的结缔组织共同构成血管内膜层,具有接受、传递信息和分泌血管活性物质等功能[1-2]。在肿瘤微环境作用下,肿瘤血管内皮细胞与正常血管内皮细胞在基因表达、生物学行为上具有明显差异[3]。因此体外构建人非小细胞肺癌微血管内皮细胞(human non-small lung cancer-microvascular endothelial cells,HNSCLC-MECs)模型,对深入研究肿瘤微环境下肺癌微血管内皮细胞的生物学行为,基因表达调控等均具有重要意义。
本实验通过筛网法、组织块贴服法、胰酶消化法等方法组合对原代HNSCLC-MECs进行分离、培养、纯化并鉴定,为后续体外研究HNSCLC-MECs在肺癌血管发生中的作用提供细胞平台。
1 材料与方法
1.1取材收集新疆医科大学附属肿瘤医院2017年3月-2017年6月胸外科非小细胞肺癌手术组织标本。
1.2主要试剂及仪器M199内皮细胞培养基、胎牛血清(Gibco公司),IV胶原酶、胰蛋白酶(Sigma公司),Factor Ⅷ抗体(Abcam公司),CD34 抗体与二抗、辣根过氧化物酶(HRP)标记的羊抗兔IgG-HRP 抗体,兔抗人GAPDH多克隆抗体(北京博奥森生物技术有限公司),倒置显微镜(Olympus )等。
1.3主要试剂配制完全培养液:含医用肝素100 U/mL,终浓度为10×104U/L青霉素/链霉素于含20%胎牛血清M199培养基。
1.4标本的保存人非小细胞肺癌组织标本经无菌取材后置于4℃、M199培养液低温条件下30 min内送至细胞培养室。
1.5人非小细胞肺癌微血管内皮细胞原代培养无菌条件下组织标本经预冷PBS 液反复冲洗至无血液残留,玻璃匀浆器研磨后无菌200 目钢筛网过滤收集沉淀。0.25%胰蛋白酶常温消化90 min,200 目钢筛网再次过滤收集沉淀。0.5%胶原酶常温消化90 min,无菌500目钢筛网过滤后收集血管薄膜样组织块。将组织块置入含M199完全培养基的培养皿中,保持组织块与培养皿底部接触,培养基刚没过组织块。37℃、5% CO2培养60 h,移出组织块,选择周围细胞贴壁且血细胞较少的培养皿继续培养5~7 d。每2~3天更换培养液,共培养7~10 d,倒置显微镜观察HNSCLC-MECs的生长情况。
1.6HNSCLC-MECs的纯化及传代显微镜下标记纤维样细胞生长区域, 0.25%胰蛋白酶消化30 s~1 min,观察细胞形态及脱壁,加入完全培养基终止消化,吹打标记部位,M199培养基漂洗后加入适量完全培养基继续培养。当细胞融合度>80%时可进行传代,应用0.25%胰蛋白酶常温消化2~3 min,待细胞变圆、贴壁运动时加5~8 mL完全培养基终止消化,吹打细胞层,1 200 r/min离心3 min,收集细胞混悬液置新的培养皿中,加入适量完全培养液重悬细胞,吹打混匀。
1.7人非小细胞肺癌血管内皮细胞的鉴定
1.7.1 形态学观察 倒置显微镜下观察细胞生长情况及形态。
1.7.2 细胞表面标志物免疫组织化学染色 将HNSCLC-MECs接种至盖玻片上,37℃,5%CO2培养24 h,4%多聚甲醛室温固定10 min,PBS清洗 3次,每次5 min。加入Factor Ⅷ抗体与CD34 抗体(稀释比例1∶200), 4℃孵育过夜。PBS清洗3次,加入羊抗兔IgG-HRP 抗体,兔抗人GAPDH多克隆抗体(稀释比例1∶500),37℃避光孵育1 h。PBS清洗3次,5 μg/mL的DAPI细胞核染色5 min,PBS清洗3次后终止显色,激光共聚焦显微镜下观察。
1.8主要观察指标人非小细胞肺癌微血管内皮细胞形态学改变及内皮细胞标志物Factor Ⅷ和CD34免疫组织化学染色。
2 结果
2.1倒置显微镜下观察原代培养人非小细胞肺癌微血管内皮细胞HNSCLC-MECs原代培养24~48 h后可见极少量细胞从组织块中爬出,形态不一,部分细胞聚集成团。约60 h后可见少量贴壁细胞,培养5 d后贴壁细胞数量较前增加,细胞呈三角形,多边形、短梭型,形态不一。培养7~10 d后贴壁细胞数量明显增多,部分细胞可见圆形细胞核,胞质较前饱满,细胞呈三角形,梭型,棍状。传代培养后细胞生长速度明显加快,传代9~10 d后细胞数量>80%,细胞呈短梭型,胞体大,折光性强,单层细胞呈典型“铺路石”样改变,可见接触抑制现象,见图1。
2.2人非小细胞肺癌微血管内皮细胞鉴定结果选择2~5代的HNSCLC-MECs,应用激光共聚焦显微镜观察HNSCLC-MECs内皮细胞特异性抗体Factor Ⅷ及CD34免疫组织化学染色结果,可见Factor Ⅷ及CD34抗体表达于细胞膜,CD34呈红色荧光,Factor Ⅷ呈绿色荧光;DAPI表达于细胞核,呈蓝色荧光,表达阳性率>95%,见图2。
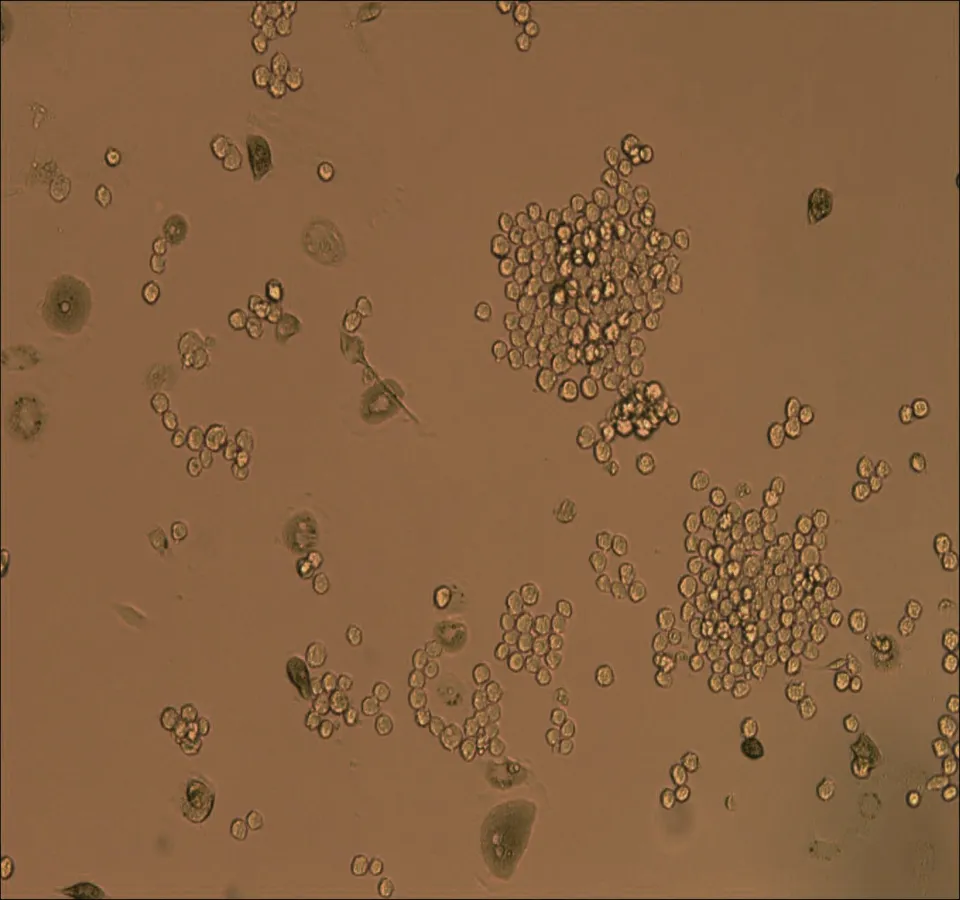
细胞培养3 d

细胞培养5 d
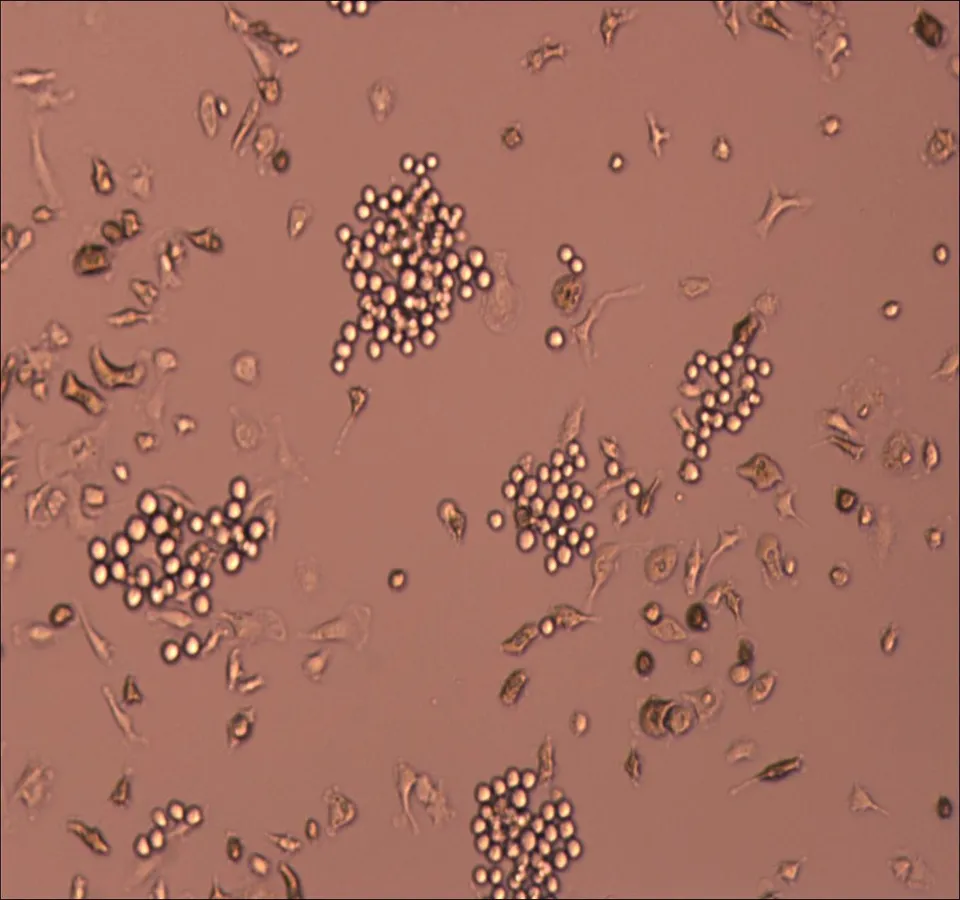
细胞培养7 d
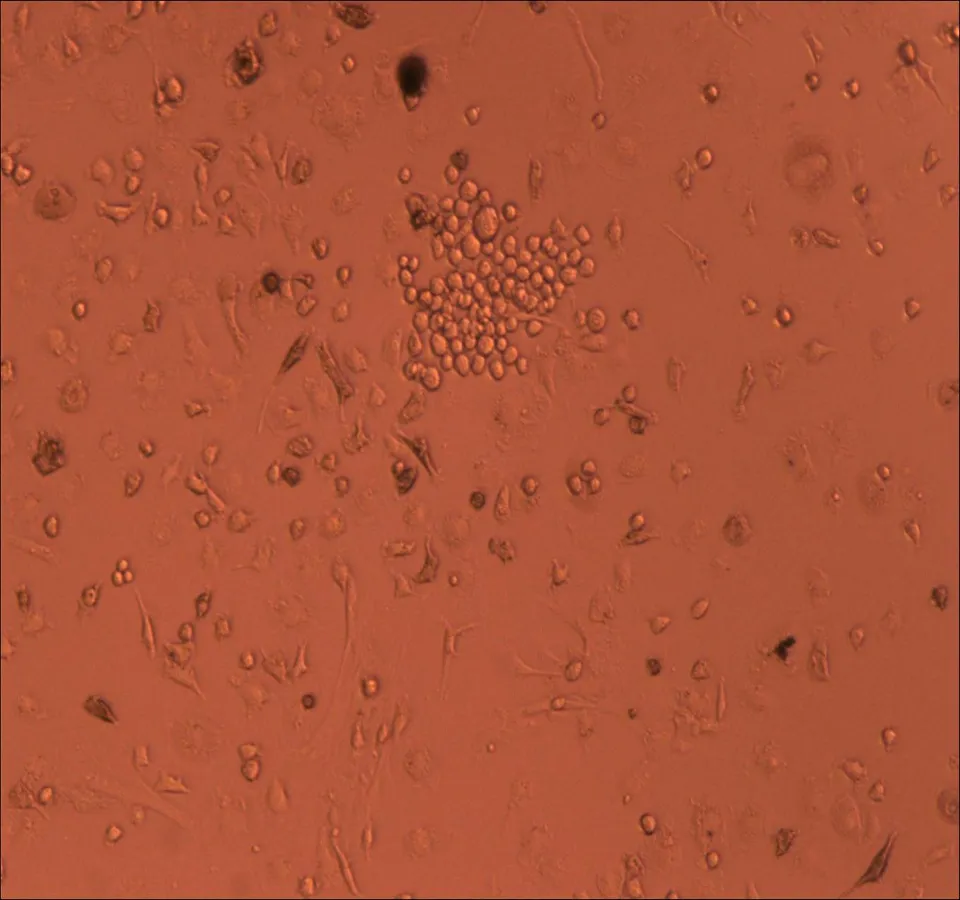
细胞培养10 d

细胞传代后10 d
图1体外培养人非小细胞肺癌微血管内皮细胞形态学观察(×100)

DAPI

CD34
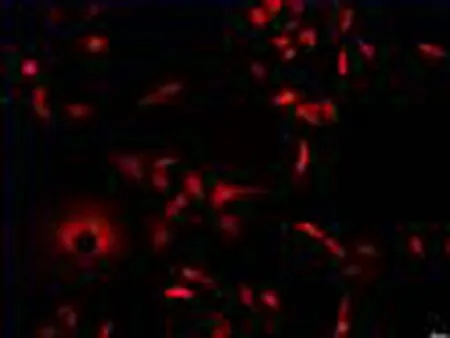
CD34
CD34和DAPI混合染色

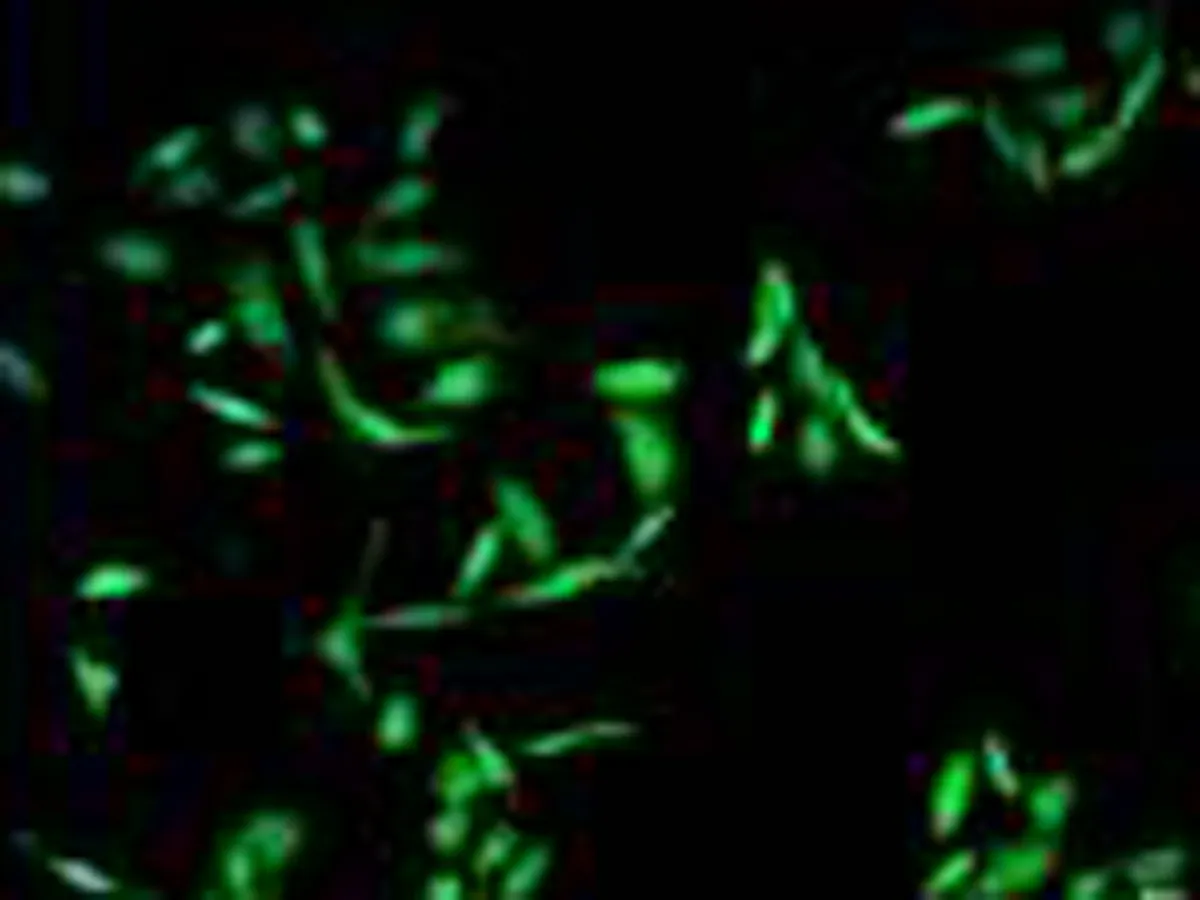
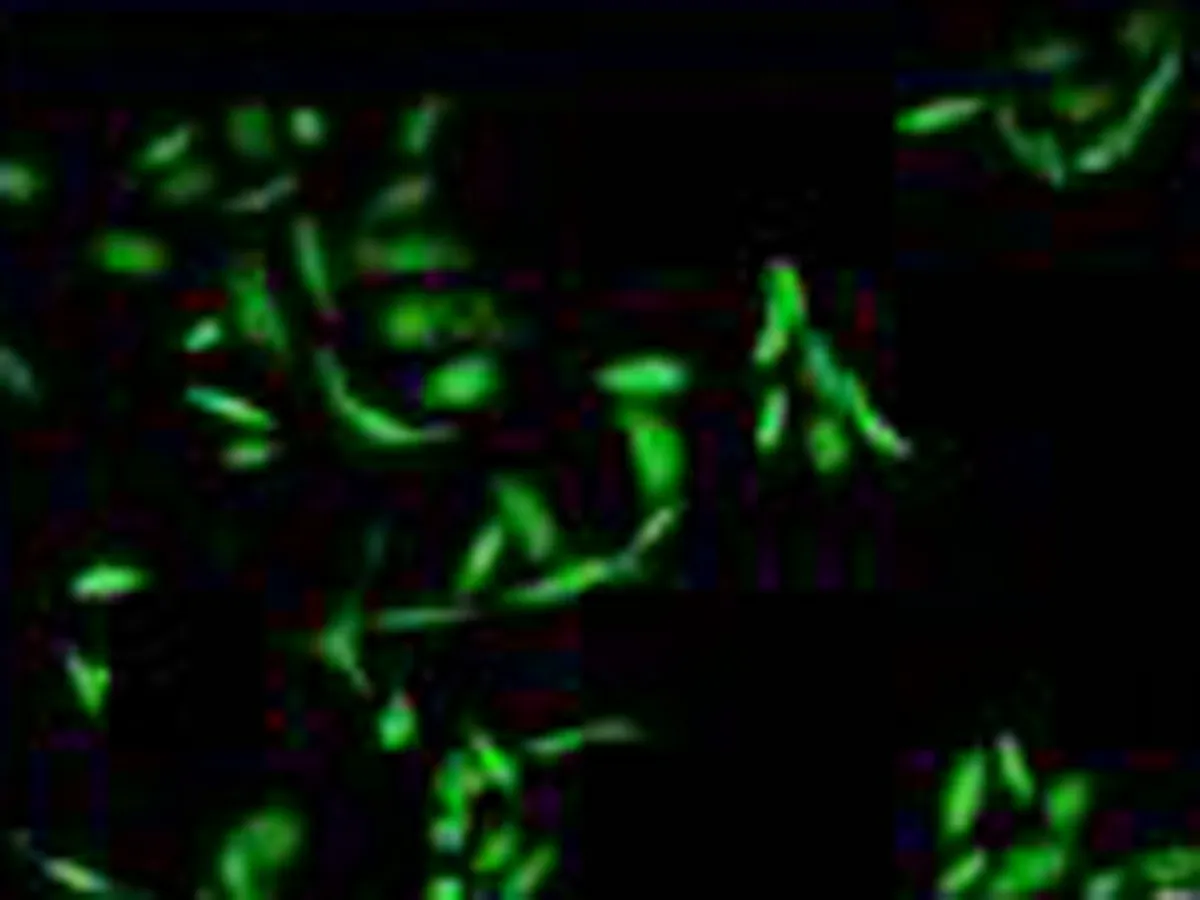
Factor Ⅷ
DAPI Factor Ⅷ Factor Ⅷ和DAPI混合染色
图2激光共聚焦显微镜下观察人非小细胞肺癌血管内皮细胞内皮抗体FactorⅧ及CD34的表达(×400)
3 讨论
肿瘤新生血管网是肿瘤侵袭及转移的基础,血管内皮细胞是构成肿瘤新生血管的主要成分,具有分泌血管活性物质,参与炎症、免疫反应,调节肿瘤细胞粘附等作用[4-7]。在肿瘤相关微环境作用下,血管内皮细胞表现出异常的增殖、迁移等生物学行为,分泌特定的血管生成因子,参与新生血管的发生。因此培养获得肿瘤血管内皮细胞对研究肿瘤血管发生具有重要意义。
常用的血管内皮细胞分离方法有免疫磁珠分选法[8]、酶组织消化法[9]、梯度离心法[10-11]、组织块贴壁法[12-13]等。免疫磁珠分选法是利用细胞表面抗原与带有特异性抗体的磁珠发生抗原抗体反应,从而在外磁场中分离细胞。该方法获得内皮细胞较为纯净,但细胞损伤大。酶组织消化法指根据不同酶消化速率的不同而组合消化分离细胞的方法。该方法对细胞消化时间要求准确,易污染,多次传代后细胞脱落死亡比例高。梯度离心法是在PercoⅡ密度梯度分选法基础上根据不同细胞沉降系数差异经多个PercoⅡ密度梯度获得内皮细胞。组织块贴壁法是利用内皮细胞贴壁生长的特点,将小的组织块平铺在培养皿底部,从组织边缘爬出的细胞为原代细胞。该方法应用广泛,操作方法简便易行,多与其他方法联用。
本实验为寻找简便易行的人非小细胞肺癌血管内皮细胞培养方法,选择筛网法、组织块贴服法与酶组织消化法相结合获得原代细胞,经2~3次传代后可获得纯度>80%的人非小细胞肺癌微血管内皮细胞。在原代培养的过程中我们发现:血细胞通常在24 h内从组织块游出,内皮细胞在48 h后逐渐从组织块中爬出,成纤维细胞约为72 h。传统的做法是将肺组织剪碎至1 mm3的小块,贴于铺有1%明胶的培养瓶底部,60 h后移出组织块,通过换液及传代去除漂浮的血细胞。但实际情况是部分纤维细胞会在60 h内爬出组织块,因成纤维细胞生长速度快于HNSCLC-MECs,5~7 d后成纤维细胞会覆盖HNSCLC-MECs,且细胞爬出数量少,培养周期长。因此本研究将组织块经玻璃匀浆器研磨至近糊状,经筛网过滤后选择薄膜样组织贴于培养瓶底部,培养基加至组织块刚好与培养皿接触。这样细胞爬出速度及数量明显增多,但更为细小的组织块更易干燥卷曲。其次本研究对比了组织块直接贴服培养与经0.25%胰蛋白酶、0.5%胶原酶消化后贴壁培养原代细胞爬出速度,比较可见经酶消化后内皮细胞爬出速度加快,数量增多。内皮细胞的纯化是本实验的一个重点,结合成纤维细胞较内皮细胞对胰酶更敏感,脱壁速度快的特点,采用了短时局部消化法和差速粘附法进行纯化。操作过程中应注意手法轻柔及无菌操作。同时我们发现HNSCLC-MECs原代细胞生长缓慢,并没有典型的“铺路石”样改变,但传代后生长速度明显加快,细胞形态逐渐趋于一致。
目前微血管内皮细胞的鉴定最常用的标志物为CD31、CD34、F8RA/Vwf、Tie2,研究显示目前没有一种标志物可以完全显示不同时期的肿瘤微血管或单一的内皮细胞。相较于CD31和F8RA/Vwf,CD34对较早期的不成熟微血管或内皮细胞更为敏感[5,7,14],F8RA/Vwf是最早发现的血管内皮细胞标志物[15-16],广泛存在于血管内皮细胞,肝、脾血窦内皮组织,淋巴管内皮及血小板表面。因此本实验选择CD34及Factor Ⅷ 互相验证共同鉴定所培养细胞是否为血管内皮细胞,激光共聚焦显微镜观察可见CD34及Factor Ⅷ均表达于细胞表面,成绿色荧光。
综上所述,本实验在传统培养方法基础上多次实践,应用组织块贴壁法、筛网法配合胰酶的短时少量应用,成功获得人肺微血管内皮细胞,通过细胞形态及标志物鉴定符合血管内皮细胞性质,实验重复性好,操作简便,为体外研究肺癌血管内皮细胞生物学特性及相关分子机制提供了新的途径。

