外源性精胺对缺氧诱导乳鼠心肌细胞凋亡的影响及其机制*
袁 迪, 王跃虹, 袁 辉, 邵毅英, 范玉琪, 邵小婷, 扈 敬, 魏 璨, 徐长庆
(哈尔滨医科大学病理生理学教研室, 哈尔滨 150086)
急性心肌梗死(acute myocardial infarction,AMI)作为严重缺血性心脏病,常伴发心律失常、休克和心脏衰竭等,致死率极高。研究证实,细胞凋亡是心肌细胞死亡的主要形式[1]。细胞氧化损伤可通过活性氧(reactive oxygen species, ROS)过量聚集,激活线粒体通路和死亡受体通路导致细胞凋亡,在心肌缺血性损伤、心力衰竭等疾病中发挥重要作用[2]。因此,抑制氧化应激所致的心肌细胞凋亡对AMI的预防和治疗至关重要。
多胺(腐胺,精脒和精胺)对细胞存活十分重要,其代谢紊乱参与多种心血管疾病的发生发展[3]。其中,精胺(spermine, Sp)具有最高的生物活性,可保护细胞免受氧化损伤[4],但是其对AMI的作用尚未被完全阐明。本实验旨在观察外源性精胺对缺氧所致的乳鼠心肌细胞凋亡的影响,并探讨其机制,为AMI的防治提供新的理论依据。
1 材料与方法
1.1 实验用品
动物:Wistar乳鼠(2~3 d),由哈尔滨医科大学实验动物中心提供。试剂:精胺(Sigma),CCK-8(cell counting kit)检测试剂盒(Dojindo),Hoechst33342染液、ROS检测试剂盒(Beyotime),DMEM培养液(Hyclone),总超氧化物歧化酶(total-superoxide dismutase, T-SOD)、丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione,GSH)测定试剂盒(南京建成),鸟氨酸脱羧酶(orinithine decarboxylase, ODC)、SSAT单克隆抗体(Santa)等。仪器:高速低温离心机(Beckman),荧光显微镜(Leica),Western blot电泳槽(美国Bio-Rad),培养箱MCO-17AICO2(SANYO),S-1300-U净化工作台等。
1.2 原代心肌细胞培养
处死乳鼠,用70%酒精浸泡消毒乳鼠,开胸取心,D-Hank's液清洗2次,剪碎心肌放入10 ml离心管中;加入5倍心肌体积的0.25%胰酶,置37 ℃水浴中消化12 min,消化4~5次;除首次外,每次收集细胞悬液,放入等体积高糖DMEM培养液终止消化,1 500 r/min离心15 min,弃上清,用含10%胎牛血清的高糖培养液将沉淀吹打为单细胞悬液,经200目筛网过滤去除未消化组织块。采用差速贴壁分离法去除成纤维细胞,将纯化心肌细胞计数后,以5×106cells/cm2接种于培养皿中,置37 ℃、5% CO2条件下孵育培养,隔天换液。取第4天的第一代细胞进行实验。
1.3 心肌细胞缺氧损伤模型的建立及分组
1.3.1 缺氧模型的建立 将含10%胎牛血清的高糖DMEM培养液换为pH6.8的Hanks'平衡盐溶液,并通入高纯度氮气(N2)饱和8 min,驱除氧气。再放入37 ℃、5% CO2及95% N2孵箱中缺氧培养24 h。
1.3.2 实验分组 将培养的乳鼠心肌细胞随机分为3组(n=10):(1)正常对照组(Control):正常细胞培养,不做任何处理;(2)缺氧组(Hypoxia):按照上述缺氧模型方法缺氧培养24 h;(3)精胺干预组(Hypoxia +Sp):在缺氧培养的同时加入Sp(5 μmol/L)[5]。
1.4 Western blot检测蛋白质表达情况
取各组培养的心肌细胞,用 PBS 洗涤,加入全细胞裂解液,置冰上处理10 min,4 ℃、12 000 r/min离心15 min,取上清进行蛋白质定量测定。取50 μg总蛋白样品作10%变性聚丙烯酰胺凝胶电泳,随后转印至PVDF膜,用10%无脂肪牛奶封闭后,分别用1∶1000稀释的一抗(ODC、SSAT)4 ℃孵育过夜。再用二抗(碱性磷酸酶标记,稀释度1∶500)室温孵育1 h,最后用Western blue stabilized substrate for AP(Promega)显色,光吸收扫描半定量分析显影条带。
1.5 CCK-8观察细胞活力
细胞以3×103cells/孔的数量接种于96孔板中,并按分组进行处理。每孔中加入10 μl CCK-8,置37 ℃孵育2 h,用紫外分光光度计测定吸光度(Absorbance, A)值。
1.6 Hoechst 33342染色观察细胞凋亡
将1/10培养液体积的Hoechst 33342染料加入到培养细胞中,37 ℃培养20 min,再用PBS洗涤两次。用荧光显微镜观察细胞,激发波长350 nm、发射波长460 nm。
1.7 T-SOD与Caspase-3/-9活力,MDA和GSH水平的测定
取各组细胞(或培养液),按试剂盒说明书操作,测定T-SOD、caspase-3/-9活力、MDA和GSH水平。在紫外分光光度计上读出吸光度(A)值,以正常组细胞作为1,计算其他各组细胞的SOD和caspase-3/-9相对活力、MDA和GSH相对水平。
1.8 DFCH-DA染色观察细胞内活性氧生成
将细胞接种于12孔板中,进行缺氧等处理。去除培养液,加入10 μmol/L DFCH-DA(二氯荧光黄双乙酸),37 ℃孵育20 min,洗涤细胞。使用荧光显微镜观察细胞荧光强度的变化,激发波长488 nm,发射波长525 nm。
1.9 统计学分析
2 结果
2.1 Western Blot检测ODC和SSAT蛋白质表达的变化
分别以ODC和SSAT与GAPDH的比值为参数,与Control组相比:Hypoxia组ODC表达量从0.61±0.02下降为0.24±0.01(P<0.05),而SSAT表达由0.21±0.01增加为0.40±0.01(P<0.05, 图1)。
2.2 CCK-8检测心肌细胞活力
以正常组心肌细胞活力为100%。与Control组相比:Hypoxia组心肌细胞活力降低(P<0.05);与Hypoxia组相比,精胺处理可使心肌细胞活力增加(P<0.05,表1)。

Fig.1Changes of key enzymes of polyamine metabolism between control and hypoxia groups (n=4)
2.3 Hoechst 33342染色检测细胞凋亡情况
正常情况下,荧光染料Hoechst 33342只有少量能透过细胞膜进入细胞,使其染上淡蓝色。但是当细胞发生凋亡时,细胞膜通透性增强,因此进入凋亡细胞中的Hoechst 33342比进入正常细胞多,产生的荧光强度要比正常细胞高。本实验结果显示:Control组:正常的细胞核呈圆形,淡蓝色;Hypoxia组:凋亡的细胞核呈分叶或碎块状,致密浓染,呈高亮度荧光,细胞凋亡率增加(P<0.05);Hypoxia+Sp组:细胞凋亡率较Hypoxia组减少(P<0.05,图2,表1)。


GroupCell abilityApoptosis rate (%)Control1.00±0.1710.53±1.78Hypoxia0.46±0.04*60.31±3.32*Hypoxia+Sp0.73±0.16#37.51±3.74#
Hypoxia+Sp: Hypoxia+spermine
*P<0.05vscontrol group;#P<0.05vshypoxia group
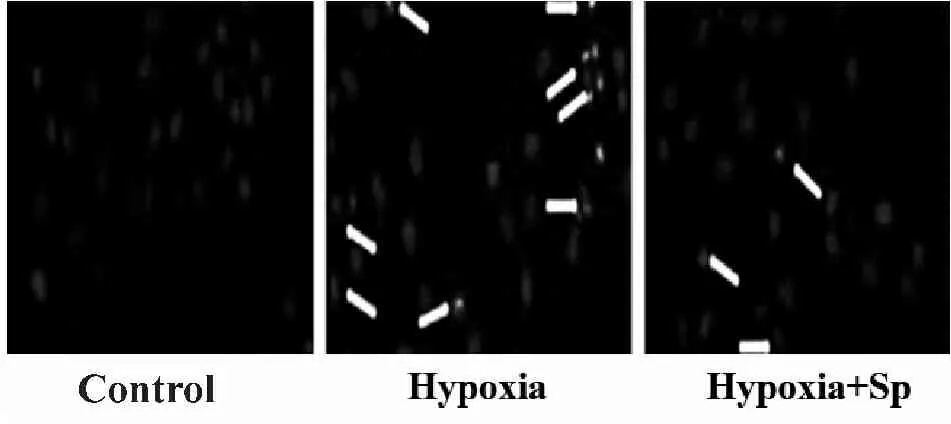
Fig.2Cell apoptosis detected by Hoechst 33342 staining (400×,n=10)
Hypoxia+Sp: Hypoxia+spermine
2.4 Caspase-3与Caspase-9活力的变化
以对照组的活力为1。与Control组相比,Hypoxia组caspase-3与caspase-9活力明显增高(P<0.05);与Hypoxia组相比,精胺处理可减轻上述变化(P<0.05,表2)。
2.5 T-SOD活性、GSH与MDA含量的变化
与Control组相比,Hypoxia组T-SOD、GSH水平明显降低,而MDA含量明显增加(P<0.05);与Hypoxia组相比,精胺处理使MDA含量降低,而T-SOD、GSH水平增加(P<0.05, 表2)。
2.6 细胞内活性氧生成的变化
与Control组(平均荧光强度19.5±7.0 a.u. )相比,Hypoxia组细胞的平均荧光强度明显增强,为73.4±6.4 a.u.(P<0.05);与Hypoxia组相比,精胺使心肌细胞的平均荧光强度降低为45.5±6.6 a.u.(P<0.05,图3)。
Tab. 2 Changes of caspase-3/-9,T-SOD activity and GSH, MDA content in cell n=10)
Hypoxia+Sp: Hypoxia+spermine
*P<0.05vscontrol group;#P<0.05vshypoxia group

Fig.3Changes in intracellular reactive oxygen species in each group (400×,n=10)
Hypoxia+Sp: Hypoxia+spermine
3 讨论
本实验通过模拟乳鼠心肌细胞缺氧复制AMI细胞模型,检测心肌细胞多胺代谢关键酶、细胞凋亡和活性氧相关指标变化,探讨外源性精胺的心肌保护机制。
本课题组在以往研究中,复制了心肌缺血/再灌注以及缺氧/复氧等模型,并揭示外源性精胺对心肌缺血/再灌注损伤的保护作用[6-8]。然而,外源性精胺对较长时间心肌缺血有无保护作用尚不清楚,本实验对此进行了观察。
多胺由腐胺(两价)、精脒(三价)和精胺(四价)组成,ODC和SSAT分别是多胺合成和分解代谢的关键酶。SSAT不仅能调节精胺含量稳定,而且直接参与药物反应、细胞凋亡和氧化应激等过程的调控[9,10]。本研究观察到,缺氧可使培养的乳鼠心肌细胞SSAT表达增加,ODC表达降低。结合课题组前期研究结果[5],多胺的合成减少而分解增加,势必导致细胞内多胺代谢池尤其精胺含量降低。因此,给予外源性精胺有利于维持心肌细胞的多胺稳态。
急性心肌梗死过程存在细胞坏死和细胞凋亡, 后者的发生可能与缺血缺氧使活性氧大量产生、钙超载等直接或间接激活细胞凋亡的信号途径,启动凋亡相关基因的表达有关[1]。
本实验采用CCK-8染色和Hoechst 33342染色分别检测细胞活力和细胞凋亡。CCK-8是基于WST-8在电子耦合试剂存在的情况下,可被线粒体内的脱氢酶还原生成高度水溶性的橙黄色甲产物,其颜色深浅与细胞增殖活性成正比,与药物细胞毒性成反比,是目前检测细胞活力常用的方法。Hoechst 33342是一种可穿透通透性增加的细胞膜并对细胞核DNA染色的蓝色荧光染料,可与凋亡细胞的DNA有效结合,从而使蓝色荧光增强。本实验结果显示,乳鼠心肌细胞缺氧后细胞活力明显下降,同时细胞核浓集呈亮蓝色、分叶或碎片状,表明缺氧使心肌细胞发生明显的细胞损伤和凋亡。
细胞凋亡又称为程序化细胞死亡,是细胞接受某种信号后或受到某些因素剌激后发生的一种主动的,由一些凋亡相关基因相互作用致所的细胞死亡过程[11]。胱天冬酶等一系列信号途径的活化可引起细胞凋亡。caspase-9是细胞凋亡线粒体途径启动的关键酶,其活化可触发caspase-3凋亡级联反应[12]。caspase-3作为 caspase级联反应的最后通路,在执行细胞凋亡中起关键作用[13]。本实验观察到,心肌细胞缺氧使caspase-3、-9活力明显增加,表明触发了线粒体细胞凋亡通路。
活性氧是由分子氧转化而来且具有比分子氧更活泼的化学反应性的一类含氧物质。在生理状态下,ROS维持在一个稳定范围内,在抗炎、抗菌等方面发挥有益作用。ROS产生过剩则可造成细胞损伤[14]。我们用荧光探针DCFH-DA观察了缺氧过程中ROS产生的变化。DCFH-DA本身无荧光,其进入细胞后可被细胞内的酯酶水解生成DCFH,细胞内的ROS可以氧化无荧光的DCFH生成有荧光的DCF,故检测DCF的荧光强度可以反映细胞内ROS水平。本实验观察到,乳鼠心肌细胞在缺氧后DCF荧光强度明显增强,提示缺氧使乳鼠心肌细胞内ROS产生明显增加。
T-SOD活性可反映机体清除自由基的能力,MDA含量可反映氧自由基产生和组织的损伤程度,GSH是体内重要的抗氧化剂和自由基清除剂[11,15]。本研究显示,与正常对照组相比,Hypoxia组培养液中MDA含量明显增加,而T-SOD活性与GSH含量显著降低。以上结果表明缺氧性心肌损伤、细胞凋亡增加与自由基生成增多、清除能力降低有关。
综上所述,缺氧使培养乳鼠心肌细胞多胺分解代谢关键酶SSAT表达增加,而多胺合成代谢关键酶ODC表达降低,细胞内精胺含量降低。给予外源性精胺处理,缺氧乳鼠心肌细胞的细胞凋亡率、MDA含量、细胞内ROS减少,同时T-SOD活性、GSH含量增加,说明了精胺可以发挥ROS清除剂样作用,清除氧自由基,减轻细胞凋亡。
综上所述,外源性精胺可减轻缺氧引起的乳鼠心肌细胞损伤和凋亡,其机制与维持多胺稳态和清除活性氧有关。这有望为AMI等缺血性心脏病的预防提供新靶点和新方法。

