植酸酶工程菌产酶条件优化研究
杨俊慧,公维丽,杨艳,孟庆军,史建国
( 齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东省生物传感器重点实验室,山东 济南 250014)
在植物种子中植酸(肌醇六磷酸)是磷的主要储存形式,占磷总量的60%~80%,但是单胃动物不能直接降解利用植酸中的磷,需要外源添加磷以补充磷元素的缺乏,这不但增加了饲养行业的成本,而且未被吸收的植酸被排出体外可以进一步被土壤微生物降解产生磷,不仅造成磷的流失,而且严重污染环境[1]。同时植酸是强螯合剂,可以螯合Ca2+、 Zn2+和 Fe2+等多种重要金属离子,也可以作为抗营养因子在酸性或碱性条件下与蛋白或氨基酸形成复合物,这也导致部分营养物质不能被充分吸收利用[2]。
植酸酶(EC 3.1.3.8,EC 3.1.3.26,EC 3.1.3.72,肌醇六磷酸磷酸水解酶)是催化植酸或植酸盐中磷酸基团逐步释放的一类酶分子,研究显示将植酸酶添加到单胃动物(如猪、家禽和鱼类)饲料中可以提高其利用磷和营养元素的效率。 Simons等[3]研究发现将微生物植酸酶粗酶液加到猪饲料中可以使磷的吸收效率提高24%,而排泄物中磷可以降低35%,类似的结果也相继在多项研究中得到证实。
植酸酶广泛存在于自然界中,在动物、植物和微生物中都有分布,但是科学研究所用的植酸酶通常为无花果曲霉(Aspergillusficuum)、梨形毛霉(Mucorpiriformis)和枝孢属(Cladosporiumspecies)等丝状真菌来源的,首次投入市场的植酸酶分离自AspergillusnigerNRRL 315 (ATCC 66876)。从植酸酶作为动物饲料添加剂得到广泛应用以来,还在水产养殖、人类营养等方面得到广泛关注。天然来源的植酸酶通常在热稳定性、pH耐受范围和比活力等方面有一定的局限性,通过遗传分子改造和转基因方法将植酸酶基因在酵母等细胞内异源表达已经证明是一种获得性质优良酶分子的有效方法[4],但是工程酵母菌的产酶量会受多种因素影响,为探究影响植酸酶酵母工程菌的产酶因素,优化发酵工艺,本研究以摇瓶发酵对酵母工程菌产植酸酶的最佳甲醇诱导量、诱导时间等因素进行了深入分析。
1 实验材料和仪器
1.1 试剂
酵母粉、蛋白胨、无氨基酵母氮源YNB(含硫酸铵)、生物素、丙烯酰胺、四甲基乙二胺(TEMED)、十二烷基苯磺酸钠(SDS)、过硫酸铵(生工生物工程(上海)股份有限公司)、葡萄糖、磷酸二氢钾、磷酸氢二钾、甲醇、甘油、钒酸铵、钼酸铵、硝酸、乙酸、乙酸钠(国药集团化学试剂北京有限公司)、植酸钠(美国Sigma公司)。
1.2 菌种、培养基和终止显色溶液
毕赤酵母GS115产植酸酶工程菌(山东省科学院生物传感器实验室构建);毕赤酵母GS115原始菌株(上海柯雷生物科技有限公司)保存在-20 ℃、20%甘油管中。
YPD培养基(1 L):10 g酵母粉,20 g蛋白胨,10 g葡萄糖。
BMMY培养基(1 L):13.4 g 无氨基酵母氮源YNB,11.8 g磷酸二氢钾,2.9 g磷酸氢二钾,10 g酵母粉,10 g蛋白胨,2 mL 0.2 mg/mL生物素,5 mL甲醇。
BMGY培养基(1 L):13.4 g 无氨基酵母氮源YNB,11.8 g磷酸二氢钾,2.9 g磷酸氢二钾,10 g酵母粉,10 g蛋白胨,2 mL 0.2 mg/mL生物素,10 mL甘油。
钼酸铵溶液(100 g/L): 称取10 g钼酸铵溶于适量去离子水中,加入1 mL氨水,定容到100 mL。
钒酸铵溶液(2.35 g/L):称取0.235 g钒酸铵溶于适量蒸馏水中,60 ℃水浴2 h后,边快速搅拌边缓缓加入2 mL硝酸溶液,定容至100 mL。
1.3 仪器
Mini-PROTEAN Tetra小型垂直电泳仪(美国Bio-rad公司);摇床(上海知楚仪器有限公司);TECAN酶标仪(瑞士TECAN公司)。
2 实验方法
2.1 酵母菌株平板培养方法
将保存在甘油管中的毕赤酵母GS115产植酸酶工程菌和毕赤酵母GS115原始菌株菌液用接种环在YPD平板上划线,30 ℃培养24 h。
2.2 摇瓶培养方法
从平板培养基上分别挑取酵母单克隆接种于5 mL YPD液体培养基中,在30 ℃,200 r/min条件下培养24 h; 取200 μL 24 h培养菌液转接于30 mL BMGY液体培养基中,于30 ℃,200 r/min培养至OD600=1.6;4 830 r/min,离心5 min, 去上清,用BMMY液体培养基重悬菌体OD600=1.0,然后全部转移到300 mL BMMY液体培养基中,在30 ℃,200 r/min,振荡培养,每隔24 h分别补加0.5%、1.0%、1.5% 和2.0% 甲醇(3 mL),连续培养5 d,每天补加甲醇前取样。
2.3 酶液透析方法
分别取20 mL发酵酶液加入透析袋中,置于0.2 mol/L Tris-HCl (pH7.0)缓冲液中透析,透析时间分别设定为2 h、4 h、6 h、8 h。
2.4 蛋白及酶活测定方法
蛋白测定采用考马斯亮蓝染色法[5],利用1 mg/mL牛血清白蛋白测定标准曲线,样品测定反应体系为100 μL发酵液加1 mL考马斯亮蓝,在室温(25 ℃),反应10 min,于595 nm测定吸光度值;
酶活测定采用钼钒酸铵法[6],利用50 mmol/L 磷酸二氢钾溶液制作标准曲线,酶活测定反应方法见表1。

表1 基于国标标准测定植酸酶酶活方法(小体系)Table 1 Determination of phytase activity according to national standard (small reaction system)
2.5 SDS-PAGE检测蛋白表达方法
SDS-PAGE[7]检测蛋白表达方法中分离胶(12%,5 mL)配制方法为:2.1 mL H2O,1.5 mL 40% 丙烯酰胺,1.3 mL 1.5 mol/L Tris-HCl(pH 8.8),0.05 mL 10% SDS,0.05 mL 10% 过硫酸铵,0.002 mL TEMED;浓缩胶(1 mL)配制方法为:0.725 mL H2O,0.125 mL 40% 丙烯酰胺,0.13 mL 1.5 mol/L Tris-HCl(pH6.8),0.01 mL 10% SDS,0.01 mL 10% 过硫酸铵,0.001 mL TEMED;电泳过程样品上样量为20 μL。
2.6 甘油含量测定方法
甘油含量测定采用甘油铜比色法[8],取硫酸铜溶液(0.05 g/mL)1 mL与碱液(0.05 g/mL)3.5 mL,摇匀,加入待测酶液样品,振荡12 min,离心过滤,后在波长为630 nm处测定吸光度,并以0.002 g/mL、0.004 g/mL、0.006 g/mL、0.008 g/mL、0.010 g/mL和0.012 g/mL甘油做标准曲线。
2.7 还原糖、乳酸含量测定方法
利用本实验室自主研发的SGD还原糖测定仪测定发酵液中还原糖含量;SBA-4D型生物传感器测定乳酸含量。
3 结果与分析
3.1 菌体培养
为确定植酸酶工程菌的产酶能力,本研究首先选用毕赤酵母GS115原始菌株(图1a)和植酸酶工程菌株(图1b)分别进行诱导产酶培养。从图1可以看出无论是随着培养时间增加、 直接在BMGY培养基中加入甲醇诱导还是将BMGY培养到一定菌浓度转接到BMMY培养基加入甲醇诱导,毕赤酵母GS115原始菌株都不能分泌植酸酶(图1c1、1c2、1c3、1c6、1c7、1c8),而植酸酶工程菌明显可以分泌植酸酶(图1c4、1c5、1c10)。这说明我们的植酸酶工程菌构建成功,具有植酸酶产酶能力。同时,从图1c4、1c5、1c9、1c10可以看出,直接在BMGY培养基中加入甲醇诱导时,BMGY培养基中的残留甘油会使植酸酶产生延迟,而且植酸酶产酶量随着诱导时间增加逐渐积累。

a YPD固体培养基培养毕赤酵母GS115原始菌株;b YPD固体培养基培养植酸酶工程菌株;c SDS-PAGE检测利用BMGY和BMMY培养基对两株菌诱导产酶培养结果。图1 毕赤酵母GS115原始菌株和植酸酶工程菌株平板培养及诱导产酶效果比较Fig.1 Comparison of plate culture and phytase production between original strain and engineered strain of Pichia pastoris GS115
3.2 生化培养参数测定
菌体在产酶过程中会通过消耗碳源(甲醇、甘油、还原糖等)代谢产生乳酸、植酸酶等产物,通过对不同浓度甲醇连续诱导培养5 d条件下甘油、还原糖及乳酸含量测定,发现甘油含量随着培养时间延长逐渐降低(图2a、 2b),而培养基中基本没有还原糖存在(图2c),且产生的乳酸量也较低(图2d)。

a甘油含量检测标准曲线图;b培养基中甘油含量随培养时间变化;c 100 mL培养基中还原糖质量随培养时间变化;d 100 mL培养基中乳酸质量随培养时间变化。图2 时间序列培养植酸酶工程菌关键生化培养参数测定Fig.2 Determination of key biochemical culture parameters of engineered phytase production strain under time-course cultivation
3.3 植酸酶工程菌不同浓度甲醇诱导酶活测定
国标法测定植酸酶酶活是通过酶解植酸钠底物产生的磷酸量反映,但是在BMGY和BMMY培养基中存在大量磷酸根离子,这一部分磷酸根可以与显色剂发生颜色反应,产生强烈的背景色导致酶与植酸钠产生的磷酸根被掩盖,无法对植酸酶酶活准确测定。因此,本研究采用透析法去除培养基中的磷酸根,并对可以较完全去除磷酸根的透析时间进行探索。如图3a所示,随着透析时间延长,磷酸根的量逐渐降低,透析6 h磷酸根量基本达到稳定,因此后续酶活测定采用透析6 h酶液。
利用透析6 h酶液测定酶活结果显示(图3b),当以1.5% 甲醇诱导时,测定的酶活最高,到第2天酶活就可以达到约1 100 U/mL,并且此后酶活基本保持稳定。当以0.5%、1%甲醇诱导时,酶活随着培养时间延长逐渐增加,到第4天基本稳定,但是最高酶活仅约为290 U/mL。而以2% 甲醇诱导时,酶活最高可达280 U/mL,且在前2天较高,随后逐渐降低。

a 利用透析方法有效去除植酸酶酶液中背景磷酸根时间;b 植酸酶酶活测定。图3 透析去除植酸酶酶液中磷酸根及植酸酶酶活测定Fig.3 Removal of phosphate root in phytase solution by dialysis and determination of phytase activity
3.4 SDS-PAGE检测植酸酶产量
利用SDS-PAGE对不同浓度甲醇时间序列诱导植酸酶工程菌产酶量检测,发现甲醇的浓度、诱导培养时间都会对植酸酶诱导产量产生重要影响。其中利用0.5%、1%、1.5% 甲醇诱导,产酶量都会随时间延长逐渐累积,0.5% 甲醇诱导在第3天才明显检测到酶条带,而1% 和1.5% 甲醇诱导在第2天可以检测到明显酶条带,但是1.5% 甲醇诱导产酶量较1%甲醇诱导产生的大,而以2% 甲醇诱导可在第2天检测到酶条带,但随着时间延长,条带逐渐减弱,说明酶量逐渐降低。综合比较结果表明,1.5% 甲醇可以快速、高效诱导植酸酶工程菌产酶,到第3天基本达到稳定酶量,SDS-PAGE蛋白谱结果和酶活测定结果一致(图4)。
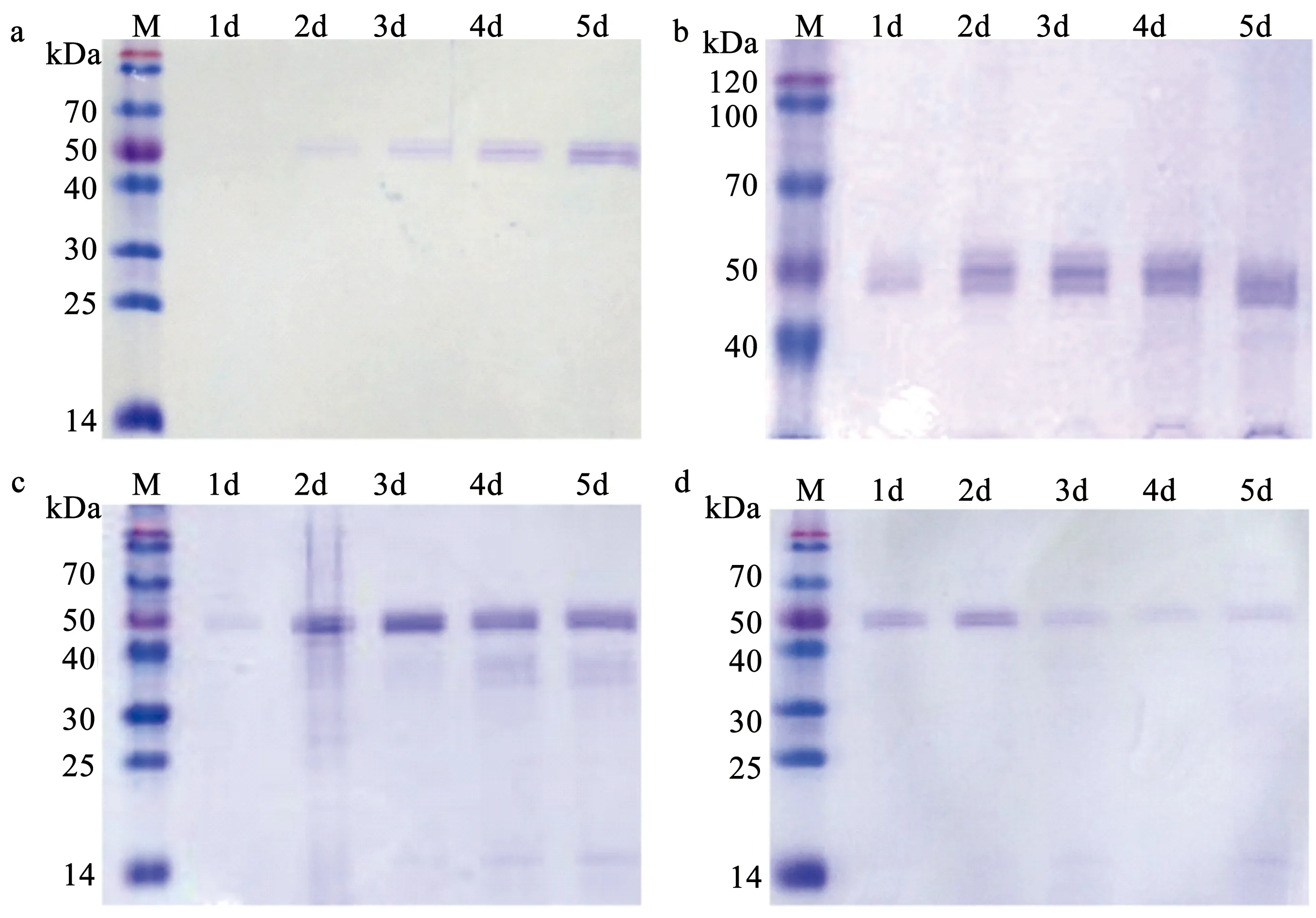
a 0.5%甲醇诱导培养;b 1%甲醇诱导培养;c 1.5%甲醇诱导培养;d 2%甲醇诱导培养。图4 SDS-PAGE检测不同浓度甲醇时间序列诱导植酸酶工程菌产酶量Fig.4 Time-course detection of phytases produced by engineered strain induced with different concentrations of methanol by SDS-PAGE
4 讨论
从1991年Gist Brocades公司首次将植酸酶产品投入饲料市场以来,许多公司试图通过构建植酸酶基因工程菌获得种类更多的植酸酶产品[9],但是当前市场上可获得的仅有少数几种,目前普遍面临的问题是如何最大限度地提高植酸酶工程菌发酵产量,前期一些研究结果显示菌体自身特性如启动子强度、密码子偏好性等因素会影响植酸酶产量,同时发酵条件对植酸酶产量也有重要影响[10]。
本研究利用摇瓶发酵,对构建的植酸酶毕赤酵母工程菌最佳甲醇诱导剂添加量、诱导培养时间等因素进行探讨,结果显示,1.5% 甲醇添加量具有最佳诱导效果,大部分甲醇酵母的表达载体中都含有甲醇酵母醇氧化酶基因(AOX1),在该基因的启动子(PAOX1)作用下,外源基因得以表达,当甲醇浓度太低时,对启动子启动效果不强;但当甲醇浓度太高时,对甲醇的代谢不完全,导致甲醇累积,对菌体产生毒性,部分菌死亡、细胞裂解,蛋白酶等內溶物释放可能将产生的少量植酸酶酶解,所以检测到SDS-PAGE上蛋白条带减弱。同时酶蛋白的产生是逐渐累积的过程,到第3天蛋白量基本达到稳定,但继续通过条件优化使蛋白产量在最短时间内达到最高产量,可在植酸酶生产上大大节省人力、物力。
目前高密度发酵工艺已成为生物技术中进行中试生产的主要发酵工艺[11],本研究实验结果为植酸酶工程菌高密度发酵条件优化奠定了基础。

