DC-CIK联合化疗对晚期肺癌的免疫疗效观察
王 玲 邱志敏 傅颖媛
肺癌是发病率和死亡率均位居前列的恶性肿瘤。免疫治疗作为1种新的治疗技术,是通过调动和激发机体免疫系统,从而增强机体对抗肿瘤的能力。DC是目前被认为功能最强的抗原提呈细胞,CIK是一群异质细胞,不仅具有T 淋巴细胞强大的抗瘤活性而且还具有NK 细胞的非MHC限制性杀瘤作用。本研究通过收集60例晚期肺癌病人,按治疗方法分为联合治疗组和单纯化疗组,回顾性分析联合治疗组和单纯化疗组在近期临床疗效及治疗前后外周血T细胞亚群变化、不良反应等方面的差异,综合评价DC-CIK联合化疗能否提高晚期肺癌病人的免疫功能,同时希望找到1种更有效的治疗方案来治疗晚期肺癌患者。
1 资料与方法
1.1 一般方法
选自我院内科2014年8月至2016年4月收治的晚期肺癌患者,并且所有患者均通过细胞学或组织病理学确诊,共计60例。 KPS评分≥70分;预期生存期>3个月;年龄在18~75岁;骨髓造血功能无明显异常:心脏、肝脏、肾脏功能可以耐受化疗;自愿遵守研究规定;需要签署知情同意书。具有以下情况将排除出本次研究:T细胞淋巴瘤、合并艾滋病、高度过敏体质或有严重过敏史(尤其对各种细胞因子过敏者)、严重细菌、病毒感染、妊娠期哺乳期、器官移植后需要长期服用免疫抑制药的患者或者正在使用免疫抑制药物的自身免疫性疾病的患者。两组患者治疗前的基本情况比较无显著性差异(表1)。

表1 两组患者治疗前基本情况比较/例
1.2 治疗方法
入组患者中,鳞癌采用吉西他滨+顺铂方案化疗。腺癌采用培美曲塞+顺铂方案化疗。腺鳞癌采用多西他赛+顺铂方案化疗。小细胞癌采用伊立替康+顺铂方案化疗。联合治疗组患者病人均在化疗前1~2 d采集外周血,在体外通过添加多种细胞因子诱导培养出成熟的DC和CIK,并对DC和CIK进行病原学检测、细胞表型和细胞数检测,检测合格后静脉回输至患者体内。单次回输DC细胞的数量要>1×107个。单次回输CIK细胞的数量要>1×109个。DC细胞和CIK细胞间隔输入。1个疗程的DC-CIK细胞免疫治疗包括3次DC细胞回输和5次CIK细胞回输。细胞免疫治疗疗程视患者的具体情况而定,一般间隔2个化疗周期进行1个疗程的细胞免疫治疗。每个治疗周期结束后均对患者的免疫功能进行检测和评价。每2个化疗周期后对患者进行临床疗效评价。
1.3 观察指标
1.3.1 临床疗效评价 所有入组的患者治疗前均要行CT或MRI基线检查,如果有远处转移的加做对应部位的检查如MRI等来了解肿瘤情况。在第2个化疗结束后,第3个化疗周期开始前复查CT或MRI,并对比治疗前和治疗后指标,用来评价临床疗效,包括完全缓解(CR);部分缓解(PR);疾病稳定(SD);疾病进展(PD);疾病控制率(DCR)=(CR+PR+SD)/总病例数×100%。客观有效率(objective response rate,ORR)=(CR+PR)/总病例数×100%。
1.3.2 免疫学功能评价 联合治疗组患者分别于化疗前1~2 d采集外周血和免疫细胞回输结束后第7天,采集患者外周血2 ml送医院检验科,应用流式细胞仪进行检测外周血淋巴细胞亚群,并对比分析免疫治疗前后的淋巴细胞亚群变化情况。
1.4 统计分析
数据应用SPSS 20.0软件进行统计学分析,计量资料以均数±标准差表示,两组病人治疗前后外周血淋巴细胞亚群的变化采用配对t检验进行比较。对于计数资料率的比较采用Pearson卡方检验。P<0.05认为差异有统计学意义。
2 结果
2.1 临床疗效
两组患者均无CR病例,联合治疗组患者PR 5例,SD 16例,PD 9例;而单纯化疗组患者PR 5例,SD 11例,PD 14例(表2),联合治疗组与单纯化疗组DCR分别是70.0%和53.3%;其对应两组的ORR均为16.7%,两组间的DCR和ORR差异均无统计学意义,P>0.05(表2,3)。

表2 联合治疗组与单纯化疗组临床疗效比较/例

表3 联合治疗组与单纯化疗组的DCR和ORR比较(例,%)
2.2 T淋巴细胞亚群比较
联合治疗组患者治疗后CD3+、CD4+、CD8+水平较治疗前明显升高,且差异有统计学意义,P<0.05。CD4+/CD8+比值治疗后较治疗前有升高趋势,但P>0.05,差异无统计学意义。单纯化疗组患者治疗后CD3+、CD8+水平较治疗前有所升高,CD4+、CD4+/CD8+比值治疗后较治疗前有下降趋势,但P>0.05,差异均无统计学意义。联合治疗组与单纯化疗组治疗前CD3+、CD4+、CD8+、CD4+/CD8+比值比较差异无统计学意义,具有可比性。治疗后联合治疗组CD3+、CD4+、CD8+水平均比单纯化疗组升高,差异有统计学意义,P<0.05。CD4+/CD8+比值虽略有升高,但P>0.05,差异无统计学意义,见表4。
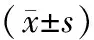
表4 两组患者治疗前后外周血T淋巴细胞亚群检测结果比较
注:#为与治疗前同指标比较,P<0.05;*为与单纯化疗组治疗后同指标比较,P<0.05。
2.3 不良反应发生情况比较
两组患者不良反应发生情况比较,恶心呕吐发生率联合治疗组明显低于单纯化疗组,P<0.05。白细胞减少、肝肾功能异常和骨髓抑制发生率联合治疗组均低于单纯化疗组,但差异无统计学意义,P>0.05,见表5。

表5 两组患者不良反应发生情况比较(例,%)
注:*为与单纯对照组治疗后同指标比较,P<0.05。
3 讨论
肺癌在全世界的发病率及死亡率都非常高。据数据统计,肺癌在全球新发肿瘤中占13%,在死亡肿瘤患者中,肺癌约占23%,因肺癌死亡的人数已超过乳腺癌、前列腺癌及结肠癌等死亡人数的总和。由于早期症状不典型,加之目前医疗水平的局限性,肺癌患者早期确诊率低,约65%~70%肺癌病人来就诊时已处于晚期[1],丧失了最佳的手术机会,而放化疗便成了这一类患者的主要治疗方法。但目前治疗效果仍不尽人意,5年总生存率仅为8%~14%[1]。肿瘤免疫学认为,肿瘤的发生和进展与机体的免疫功能密不可分[2],肿瘤患者由于免疫功能低下,控制和杀灭肿瘤细胞的能力减弱,肿瘤细胞大量增殖促使肿瘤进展,而肿瘤进展又使患者的免疫功能进一步恶化,两者相互影响,相互促进,影响肿瘤的预后。而肿瘤细胞免疫治疗就是是通过调动和激发机体免疫系统,从而增强机体对抗肿瘤的能力。目前临床上应用最广的肿瘤过继细胞免疫治疗就是树突状细胞和细胞因子诱导的杀伤细胞。
DC和CIK在体外共同培养,不仅可以促进DC细胞成熟,而且可以增强CIK对肿瘤细胞的杀伤作用[3]。DC-CIK抗肿瘤效应的作用机制主要通过:①DC细胞表面高度表达HLA-DR、CD40、CD80与CIK细胞高表达的共刺激分子受体结合,增加IL-12、IL-2及IFN-r等细胞因子分泌量,促进CIK细胞大量增殖。②降低具有较强免疫抑制作用的调节性T细胞CD4+CD25+Treg细胞及IL-10的分泌量,增强抗肿瘤作用。③抑制hTERT蛋白表达,降低端粒酶活性,抑制肿瘤细胞的增殖。
在本次研究中,联合组治疗后与治疗前相比,CD3+、CD4+、CD8+T淋巴细胞数量均显著上升,P<0.05。说明DC-CIK细胞免疫治疗能有效提高晚期肺癌病人的CD3+T淋巴细胞数、CD4+T淋巴细胞数、CD8+T淋巴细胞数。此结果与赵明明等[4]研究结果相似。然而,分析比较对照组治疗后与治疗前相比,差异均无统计学意义(P>0.05)。此研究结果与毕书婷等研究结果相似[5]。从临床疗效结果来看,联合治疗组的疾病控制率高于单纯化疗组,但P>0.05。两组的治疗有效率相同可能与本次研究的样本数太少有关。此研究结果与郭卫东等[6]研究结果相似。但治疗有效率和疾病控制率均高于我们本次的研究结果,考虑可能和患者的病理类型、年龄、KPS评分、肿瘤分期及采用的化疗方案不同有关。近年来随着肿瘤免疫治疗的开展,肿瘤免疫治疗能否提高患者的临床疗效备受关注。使用传统的临床疗效评价体系能否客观评价肿瘤免疫治疗的疗效也备受争议。Patel等[7]提出发现新的病灶并不能排除 ipilimumab 治疗可使患者整体肿瘤负荷缩小。与传统化疗相比,免疫治疗产生明显疗效往往需要较长的时间[8]。有报道已评定为病情进展的患者仍继续接受免疫治疗后延迟出现病情改善[9]。正是因为这种延迟效应,肿瘤免疫治疗的疗效可能会出现比化疗药物略低的客观缓解率。针对肿瘤免疫治疗的此种特点,有研究学者提出对现有的 WHO标准进行修改,从而制定一系列新的免疫治疗疗效评价标准。Wolchok教授对这项新的评价标准(immune-related respone criteria,irRC)进行了详细阐述,在采用ipilimumab免疫治疗晚期黑素瘤患者的试验中,使用irRC进行疗效评价,同时探讨irRC的临床意义及其可行性。但该项评价体系仍在试验中,尚未被广泛使用。联合治疗组和单纯化疗组出现的主要不良反应均为化疗药物所致的不良反应如白细胞减少,血小板减少,骨髓抑制,肝肾功能损害和恶心呕吐等。联合治疗组恶心呕吐发生率显著低于单纯化疗组,P<0.05。
综上所述,DC-CIK细胞免疫治疗具有高效、低毒等特点,作为1种新型肿瘤免疫治疗的方法,与化疗相结合,能有效提升机体因化疗受损的免疫细胞,且不良反应少,可望作为晚期肺癌患者的1种新的治疗方法。

