大鼠右冠状动脉右缘支结扎制备心动过缓模型
汤依群,冯 凯,梁时雨,吴启权,潘奕彤,刘婷婷
(中国药科大学基础医学与临床药学学院,江苏南京 211198)
心动过缓是临床常见疾病,多见于老年或心脏有疾病的患者,可出现眩晕、心绞痛,甚至导致心衰[1]。目前心动过缓造模方法主要有以下几类:①直接给予心脏抑制性药物,如乙酰胆碱和普萘洛尔等[2-4]。此类方法造模方便,但动物种属差异性大,与临床心动过缓发病机制不同。②化学物质损伤法,即将甲醛或NaOH等注射至右心房,造成窦房结局部损伤[5],模拟病窦发生。此类方法操作较复杂,损伤程度难控制,重现性差。③刺激迷走神经干引起心率减慢[6]。此法动物心率减慢程度与受刺激动物的种属及刺激频率相关,多用于制备急性模型,较少用于心动过缓发病机制的研究。制备与临床发病机制相关且重现性好的心动过缓动物模型,是研究心动过缓发病机制及评价干预措施疗效的关键。
临床数据显示,心肌梗死患者易发生心动过缓[7]。左冠状动脉结扎术可以引起心肌缺血、心肌重构、诱发心率失常和心衰,是本实验室常用的动物模型[8]。Goldstein等[9]发现,右冠状动脉阻塞导致心肌梗死患者易发生心动过缓。本研究通过结扎大鼠右冠状动脉分支,引起右心房供血障碍,损伤窦房结细胞,建立大鼠缺血性心动过缓模型。
1 材料与方法
1.1 动物、试剂和仪器
雄性SD大鼠,SPF级,体质量250~300 g,购自南京市青龙山动物养殖场,动物许可证号为SCKX(浙)2014-0001。动物饲养条件符合中国药科大学实验动物福利伦理委员会的要求,大鼠实验前适应性饲养1周,温度23~25℃,湿度50%~70%,明暗交替12 h饲养,每天更换垫料。
Trizol和BCA试剂盒,碧云天生物技术有限公司;ECL显色剂,上海生工生物有限公司;兔抗大鼠GAPDH多克隆抗体(A00227-1)和HRP-羊抗兔lgG多克隆抗体(BA1054),博士德生物有限公司;兔抗大鼠超极化激活环核苷酸门控阳离子通道亚型4(hyperpolarization activated cyclic nucleotide gated cation channel 4,HCN4)蛋白多克隆抗体(bs-1691R),北京博奥森生物技术有限公司;兔抗大鼠钠钙交换蛋白1(sodium calcium exchanger 1,NCX1)单克隆抗体(ab177952),美国abcam公司。
TE124S电子天平(万分之一),德国Sartorius公司;Versamax光吸收型酶标仪,美谷分子仪器(上海)有限公司;Bioshine Chemi Q4600mini化学发光成像仪,上海欧翔科学仪器有限公司;HX-300S动物呼吸机、BL-420S生物信号采集与分析系统和PT-100压力转换器,成都泰盟软件有限公司;TGLM20高速低温离心机,凯达科学仪器有限公司。
1.2 动物分组及手术
动物适应性饲养1周后,ip水合氯醛300 mg·kg-1麻醉,将BL-420S生物信号采集与分析系统的白色,黑色和红色电极分别插入大鼠右前肢,右后肢和左后肢的皮下,测量Ⅱ导联心电图,将心电图正常大鼠随机分成3组:左冠状动脉结扎组,右冠状动脉结扎组和假手术组,每组6只。
左冠状动脉结扎[8]:大鼠麻醉后记录Ⅱ导联心电图(麻醉方法同上)。连接呼吸机(潮气量:13 mL,呼吸比:2∶1,呼吸频率:70 min-1),左胸皮肤纵向切开,分离胸肌,在第4肋间打开胸腔隔膜和心包膜。轻微挤压胸部使心脏露出胸腔。左冠状动脉左前降支(left anterior descending,LAD)起始部位下约2 mm处,用5-0缝合线结扎。心电图Ⅱ导联中ST段抬高,认定结扎成功。心脏放回胸腔,排出空气。对大鼠肌肉和皮肤逐层缝合。缝合完毕后,除去呼吸机。整个手术过程注意无菌操作,避免伤口感染带来的大鼠死亡或心率等指标的改变。
右冠状动脉结扎:动物麻醉及开胸方法同前,用蚊式钳分离胸肌并且在第4肋间打开胸腔隔膜和心包膜,轻微挤压胸部使心脏露出胸腔。右冠状动脉的右缘支(right marginal artery,RMA)位于右心耳下缘及心尖中点处,用5-0缝合线结扎右缘支起点处。心电图Ⅱ导联中ST段抬高,为结扎成功标志。后续动物处理同左冠状动脉结扎。
假手术组:动物麻醉及开胸方法同前,在大鼠左、右冠状动脉相应位置穿线后,将心脏放回胸腔,之后同法缝合,处理。
各组动物手术全过程,以及术后第5天(d5),d10和d15记录Ⅱ导联心电图。术后d16进行血流动力学实验以测量心功能,剪取心脏组织,部分放置于4%甲醛溶液中为组织学实验做准备,其余放在-80℃冰箱冻存进行分子生物学实验。
1.3 大鼠心功能测定
大鼠术后d16,麻醉,分离右侧颈总动脉,聚乙烯导管插入颈总动脉,连接PT-100压力转换器。通过观察显示器波形变化,将插管从颈动脉推入大鼠左心室内,记录4个心脏血流动力学指标衡量大鼠心功能状态:左心室内压最大下降速率(maximal rate of decline of ventricular pressure,-dp/dtmax),左心室内压最大上升速率(maximal rate of rise of ventricular pressure,+dp/dtmax),左心室终末舒张压(left ventricular end-diastolic pressure,LVEDP)和左心室收缩压(left ventricular systolic pressure,LVSP)。
1.4 HE和Masson染色进行病理组织学检查
术后d16,大鼠处死,暴露心脏,在体原位寻找大鼠右侧上腔静脉,沿上腔静脉远端与心脏相连的大血管根部离断血管,取下完整心脏,剪下右心房及与之相连的上腔静脉,分离并去除上腔静脉周围的结缔组织,进一步修剪取下来的组织,去除多余部分,以上腔静脉与右心房交界区为中心,上下各1.5 cm处横断上腔静脉与右心房,取下的组织部分包含窦房结。剪取1/2用于病理组织学检测。剩余组织冻存于-80℃冰箱,用于分子生物学测定。将包含窦房结的右心房组织放置于4%甲醛中固定48 h,脱水,包埋,切片(5 μm),固定于载玻片上,晾干备用。进行HE染色和Masson染色,显微镜下观察,拍照。HE观察组织中细胞是否排列整齐,组织间隙是否发生炎性浸润。Masson染色观察组织间隙是否发生纤维化。每张切片在显微镜(200倍)下选取3个视野,使用Image-Pro Plus 6.0统计炎性浸润,纤维化和整个组织切片的面积。炎性浸润和纤维化百分比为炎性浸润和纤维化面积与组织切片面积的比值,取3个视野的平均值。
1.5 Western蛋白质印迹法检测HCN4和NCX1蛋白表达
取组织30 mg,加入RIPA裂解液,剪碎,放入匀浆器中磨碎,冷冻离心(12000×g,4℃,15 min)。BCA法测定蛋白质浓度。各样品组织加入等量的5×SDS加样缓冲液均匀混合,煮沸5 min,使蛋白质充分变质。采用10%SDS-PAGE分离蛋白质,120 V,60 min转膜。将转好的PVDF膜置于封闭液(5%脱脂奶粉TBST混合液)中1 h,取出PVDF膜于TBST中洗净,进行一抗(GAPDH:1∶5000,HCN4:1∶5000,NCX1:1∶3000)孵育,4℃过夜。用TBST溶液洗膜,重复3次,每次10 min。二抗(1∶5000)室温孵育2h。TBST重复洗膜3次,每次10min。最后加入ECL显色剂后放入Bioshine Chemi Q4600mini化学发光成像仪中显影,Chemi Capture软件拍照成像,用Image J图像分析软件进行分析。目标蛋白相对表达水平用积分吸光度(integrated absorbance,IA)目标蛋白/IAGAPDH比值表示。
1.6 统计学分析
本研究采用SPASS 11.0系统对数据进行统计分析,实验结果数据均以±s表示,多组间比较用单因素方差分析,两两比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 右冠状动脉结扎对SD大鼠心电图的影响
SD大鼠心电图结果显示(图1),与正常组大鼠心电图相比,假手术组无明显改变,左、右冠状动脉结扎组大鼠ST段升高。对ST段进行分析,结果显示(图1B),与假手术组相比,左、右冠状动脉结扎均可引起大鼠心电图ST段显著升高(P<0.01);但右冠状动脉结扎组大鼠ST段升高较左冠脉动脉结扎大鼠ST段上升幅度小(P<0.01),提示右冠状动脉结扎导致大鼠右心房缺血程度较轻。
2.2 右冠状动脉结扎对SD大鼠心率的影响
结果显示(图2),假手术组大鼠实验过程中心率平稳,无较大波动;左冠状动脉结扎组大鼠心率在术后d5上升(P<0.05),术后d15回落至正常水平;右冠状动脉结扎组大鼠,在术后d10心率显著降低(P<0.05)。提示右冠状动脉结扎可诱导大鼠心动过缓,导致心率显著降低。
2.3 右冠状动脉结扎对SD大鼠心功能的影响
心功能结果显示(图3),与假手术组相比,左冠状动脉结扎组SD大鼠的-dp/dtmax显著下降(P<0.01),LVEDP显著上升(P<0.01)。右冠状动脉结扎组SD大鼠上述参数无显著差异,提示右冠状动脉结扎未造成SD大鼠心功能受损。提示右冠状动脉结扎并未通过损伤大鼠心功能导致心率降低。
2.4 右冠状动脉结扎对SD大鼠右心房组织形态的影响
组织形态学实验结果显示(图4),左、右冠状动脉结扎SD大鼠的右心房都有较为明显的炎症浸润(HE染色)和纤维化变化(Masson染色),说明2种结扎方法均可引起SD大鼠右心房组织形态改变。对炎性浸润(图4A白色区域)和纤维化(图4A蓝色区域)区域面积进行统计,结果显示(图4B和4C),与左冠状动脉结扎组相比,右冠状动脉结扎组SD大鼠炎性浸润(P<0.01)和纤维化(P<0.01)变化更明显,提示右冠状动脉结扎对SD大鼠右心房损伤更严重。
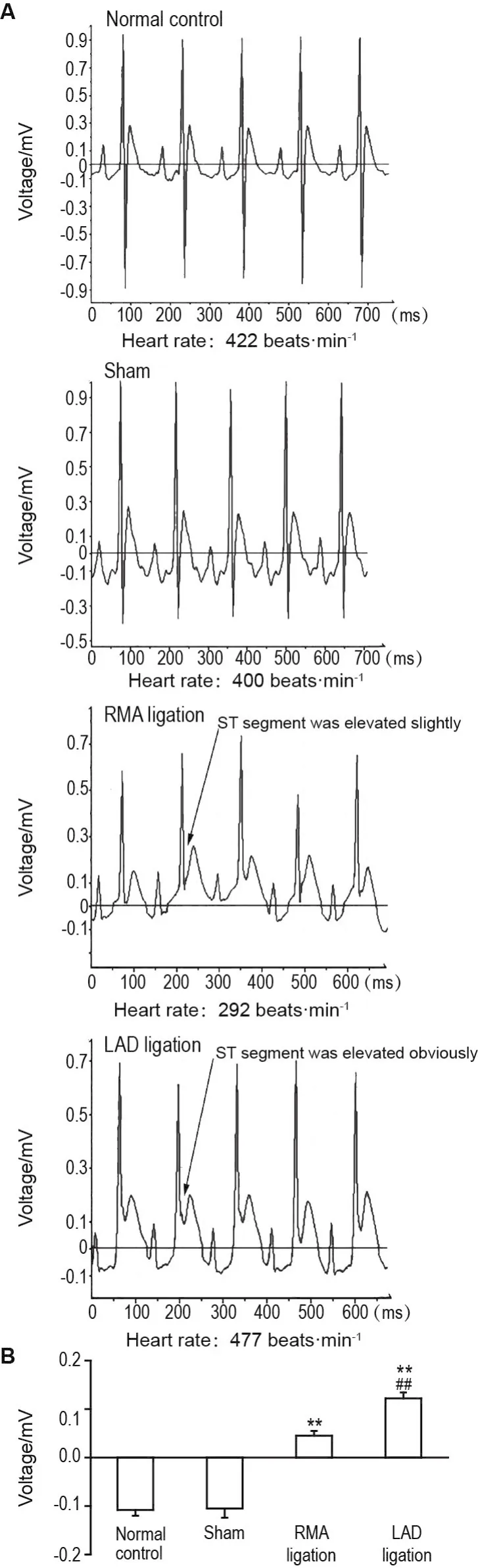
Fig.1 Representative traces of electrocardiogram(ECG)after coronary artery ligations.Eighteen male SD rats were divided into left anterior descending(LAD)ligation group,right marginal branch of right coronary artery(RMA)ligation group,and sham-operated group.Chests of six rats per group were opened after being anesthetized with 10%chloral hydrate(ip,300 mg · kg-1).Then LAD and RMA were ligated while moni⁃tored.The ECG was recorded on the 5thday(d5),d10 and d15 after surgery.B was quantitative analysis of ST segment in A.Arrows in A show ST segments were elevated obviously in LAD ligation group and slightly in RMA ligation group,respectively.±s,n=6. **P<0.01,compared with sham group;##P<0.01,compared with RMA ligation group.

Fig.2 Effect of LAD and RMA ligation on heart rate from d0 to d15.See Fig.1 for the rat treatment.±s,n=6.*P<0.05,compared with d0 after surgery.

Fig.3 Effect of LAD and RMA ligation on maximal rate of decline of ventricular pressure(-dp/dtmax)(A),maximal rate of rise of ventricular pressure(+dp/dtmax)(B),left ventricular end-diastolic pressure(LVEDP,C)and left ventricular systolic pressure(LVSP,D)on d16 after surgery.See Fig.1 for the rat treatment.1 mmHg=0.133 kpa.±s,n=6.**P<0.01,compared with sham group.
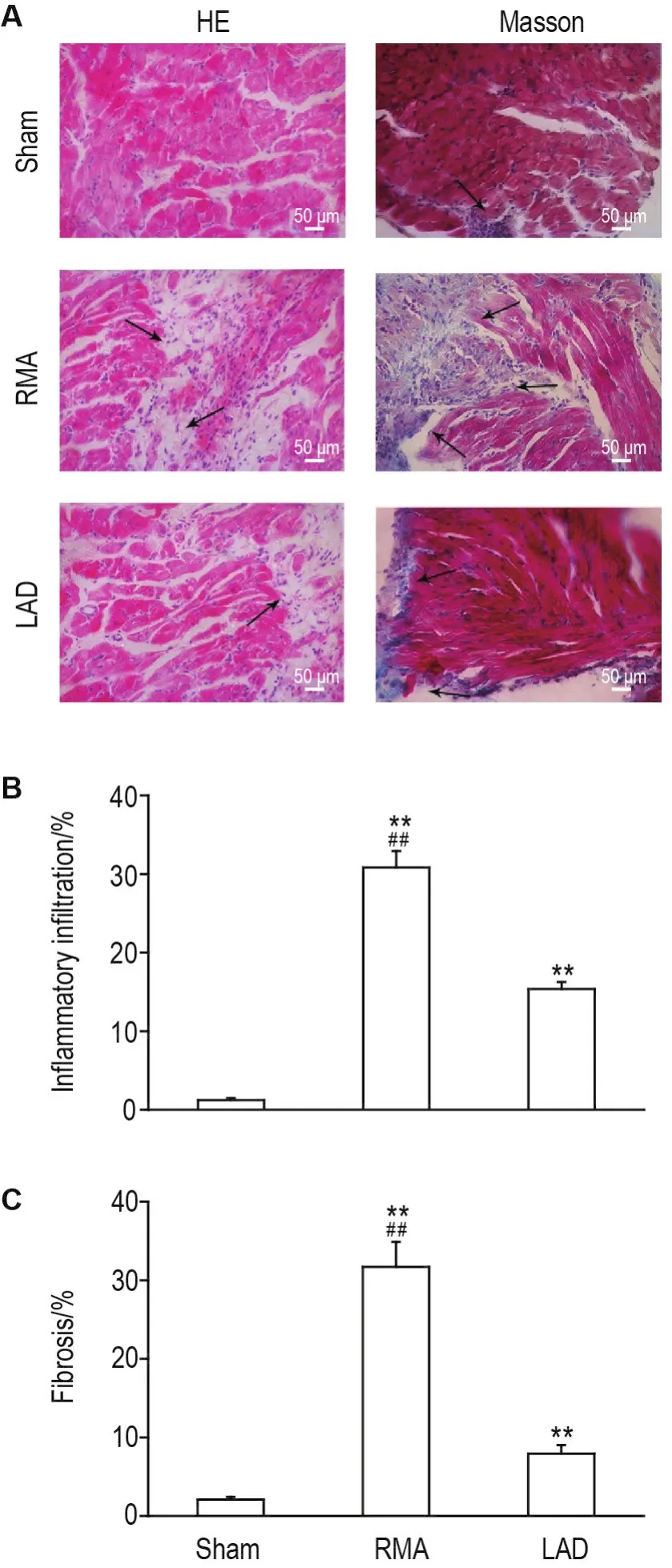
Fig.4 Histopathological changes on auricula dextra of rats by HE and Masson staining.See Fig.1 for the rat treatment.B:quantitative result of fibrosis in A;C:quantitative result of inflammatory cells infiltration in A.The arrows indicate inflammatory cell infiltration and fibrosis.± s,n=3. **P<0.01,compared with sham group;##P<0.01,compared with LAD ligation group.
2.5 右冠状动脉结扎对大鼠窦房结起搏相关通道蛋白表达的影响
Western蛋白印迹结果显示(图5),与假手术组相比,左冠状动脉结扎组SD大鼠的HCN4和NCX1蛋白表达水平无明显改变,右冠状动脉结扎组SD大鼠HCN4和NCX1蛋白表达水平显著性降低(P<0.05),提示右冠状动脉结扎可抑制SD大鼠HCN4和NCX1蛋白的表达。

Fig.5 Sodium calcium exchanger 1(NCX1)and hyper⁃polarization activated cyclic nucleotide gated cation channel 4(HCN4)protein expression after surgery by Western blotting.See Fig.1 for the rat treatment.IA:integrated absorbance.B was semi-quantitative results of A.±s,n=3.*P<0.05,compared with sham group.
3 讨论
窦房结是哺乳动物心脏正常节律的起搏点。窦房结由4种细胞组成:具有起搏功能的P细胞,过渡细胞(T细胞),浦肯野细胞以及普通心肌细胞。窦房结细胞4期自动除极速率是心脏自律性的基础,主要由HCN、NCX、L型Ca2+通道、T 型Ca2+通道和Na+-K+泵等参与[10]。其中L型和T 型Ca2+通道及Na+-K+泵已有许多研究者进行了大量研究。本研究以NCX和HCN为研究对象,观察其在心动过缓模型中的改变。NCX在动作电位4相,可通过调节胞外Ca2+内流,协助自动除极而影响心率[11]。NCX1是心脏NCX的主要亚型。HCN在窦房结细胞中选择性地高密度分布,激活后可使窦房结起搏细胞去极化,引起膜电位逐渐升高至接近阈值,从而产生周而复始的电活动。与HCN相关的门控通道亚单位主要有HCN1,HCN2和HCN4,在窦房结起搏通道中占主要支配的成分是HCN4亚型[12]。起搏电流(funny current,I)f是HCN阳离子电流,由Na+和K+混合而成,主要在窦房结细胞的舒张去极化的早期起除极的作用,HCN4含量的减少导致If减弱,Na+内流减少,严重阻碍了起搏细胞自动去极化的速度,减慢大鼠心率。窦房结细胞的去极化早中期的Ca2+内流促进肌浆网兰尼碱受体的局部Ca2+释放,触发INCX,INCX以排出1个Ca2+和转入3个Na+的正向模式形成内向电流,降低膜电位负值达阈电位水平约-40 mV时,激活ICa-L,大量Ca2+内流通过Ca2+诱导的Ca2+释放激发全细胞肌浆网钙释放至胞质形成钙瞬变,产生动作电位的上升支。NCX1含量降低,使Ca2+内流减少,缓慢形成动作电位上升支,动作电位周期延长,导致心率降低。
冠状动脉右分支是右心房供血的重要来源之一,结扎SD大鼠右冠状动脉分支,右心房供血受损,窦房结供血不足。左冠状动脉分支是左心室的主要供血来源,左冠状动脉结扎,心室供血障碍,可引起心功能严重受损。实验结果显示,结扎左、右冠状动脉,心电图ST段均升高,提示结扎成功,均造成心脏缺血损伤。窦房结主要由右冠状动脉供血,右冠状动脉结扎导致窦房结供血不足,使得窦房结细胞损伤,易引发心动过缓。ST段升高幅度显示,右冠状动脉结扎引起的心脏缺血程度显著低于左冠状动脉结扎,说明右冠状动脉结扎对心脏的损伤较轻,有利于提高SD大鼠存活率。对SD大鼠心率进行统计,结果显示右冠状动脉结扎10 d后,SD大鼠心率明显降低,且术后15 d心率保持较低水平,说明右冠状动脉结扎成功诱导了SD大鼠心动过缓,并且我们认为右冠状动脉结扎10~15 d,是建立心动过缓模型比较合适的时间。为了排除SD大鼠心功能对心率的影响,术后15 d,对SD大鼠进行了血流动力学指标的检测,结果显示,左冠状动脉结扎组SD大鼠-dp/dtmax显著降低,LVEDP显著升高,提示心功能明显受损。此结果与张颖等[13]左冠状动脉结扎实验结果一致。右冠状动脉结扎组SD大鼠的主要血流动力学指标(-dp/dtmax,+dp/dtmax,LVEDP和LVSP)与对照组数值无明显差异。因此猜测,左冠状动脉结扎未能引起心率降低,术后出现的心率升高,估计与心室供血障碍引起心功能降低,反馈性心率变化所致。右冠状动脉结扎对左心室功能影响小,心率的平稳降低可能与右心房缺血性损害有关。为此进行了SD大鼠右心房组织形态学检查,结果显示,右冠状动脉结扎SD大鼠右心房组织纤维化程度比左冠状动脉结扎组明显增高,炎症浸润更为严重。心房纤维化可引起心肌细胞静息电位超极化,抑制细胞兴奋,引起心率降低。右心房损伤使得窦房结细胞受损,诱发心动过缓。Western蛋白质印迹实验结果进一步证实,与对照组相比,右冠状动脉结扎组SD大鼠的右心房组织(包含窦房结)中HCN4和NCX1蛋白表达显著降低而左冠状动脉结扎组SD大鼠上述蛋白表达无明显改变。宋宝莹[14]研究报道,右冠状动脉动脉粥样硬化管腔狭窄可导致HCN4表达降低,左冠状动脉粥样硬化和心肌梗死与HCN4表达无关,与本实验结果一致。HCN4和HCN1是窦房结细胞维持自律性的重要离子通道,其表达减少,阻碍起搏细胞自动除极且延长动作电位周期,诱发心动过缓。
与经典的左冠状动脉结扎术相比,右冠状动脉结扎术对SD大鼠心脏功能影响较小,交感神经反馈性刺激较弱,心率变化平稳,窦房结缺血性病变和纤维化明显,手术操作难度与左冠状动脉结扎类似。为保证结扎部位和程度类似,右冠状动脉结扎操作时要把心脏取出,置于胸腔外,因此实验操作和饲养环境应尽可能洁净,SD大鼠胸部主要消毒和无菌处理,必要时使用抗菌药物,避免SD大鼠伤口感染,操作要尽可能轻柔、迅速,避免损伤血管及其他器官。
与现有的心动过缓模型相比,SD大鼠右冠状动脉结扎建立的心动过缓模型的发病机制和缺血性病窦综合征类似,都是由于冠状动脉阻塞,引起窦房结供血不足,导致窦房结损伤,引发心律失常。同时,成模时间短,约2周。此模型可用于动态研究缺血对窦房结功能的影响和心房纤维化与缺血的关系。对探讨心动过缓发病机制,观察心动过缓治疗药物的疗效,以及寻找心动过缓药物治疗靶点,此模型都有广泛的应用价值。

