丹酚酸C对MPP+损伤的SH-SY5Y细胞氧化应激和凋亡的抑制作用
宋俊科,张 雯,张 雪,杨海光,周启蒙,王金华,杜冠华
(中国医学科学院&北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,药物靶点研究与新药筛选北京市重点实验室,北京 100050)
帕金森病(Parkinson disease,PD)是一种多发于老年人、以黑质多巴胺神经元慢性进行性死亡为主要特征的神经退行性疾病[1-2]。流行病学调查显示,65岁以上人群PD患病率达到2%~3%,并且随着老龄化社会的到来,PD患者的数量将迅速增加[3-5]。目前,对PD发病机制认识不足,尚无有效的治疗手段。越来越多的证据显示,线粒体功能障碍与氧化应激等相互作用,在PD神经元选择性死亡过程中发挥重要作用[6-9]。
据报道,丹酚酸类化合物在抑制氧化应激与细胞凋亡方面有着非常显著的作用。丹酚酸B(salvi⁃anolic acid B,Sal B)能够逆转6-羟基多巴胺和1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridi⁃num ion,MPP+)造成的SH-SY5Y细胞调亡[10-13],Sal A能够抑制H2O2诱导的SH-SY5Y细胞损伤[14]。Sal C与Sal A和Sal B具有较为相似的结构。有研究表明,Sal C对基质金属蛋白酶2和基质金属蛋白酶9的活性均具有明显的抑制作用[15],同时Sal C能够降低单侧输尿管梗阻大鼠肾CCL5和CXCL10炎症因子的分泌[16]。然而到目前为止,尚无关于Sal C神经保护作用方面的报道。考虑到Sal A和Sal B作为Sal C的类似物具有较好的抗MPP+损伤或神经细胞保护作用,本研究选择SH-SY5Y细胞为研究对象,采用MPP+诱导SHSY5Y细胞损伤模型研究Sal C对SH-SY5Y细胞的保护作用。
1 材料与方法
1.1 药物、试剂和主要仪器
Sal C购自中国源叶生物科技有限公司。DMEM/F12培养基、胎牛血清(fetal bovine serum,FBS)、线粒体超氧化物指示剂(mitochondrial super⁃oxide indicator,MitoSOX)和2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodihydrofluorescein diace⁃tate,DCFH-DA)均购自美国Thermo scientific公司;MPP+,Hoechst33258和四甲基偶氮唑盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)均购自美国Sigma公司;Alexa Fluor 488绿色荧光标记二抗、蛋白裂解液、β肌动蛋白、Bax、Bcl-2和活化的胱天蛋白酶3抗体均购自美国Cell Signaling Technology公司;烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(nicotinamide adenine dinucleo⁃tide phosphate oxidase 2,NADPH oxidase 2,NOX2)和细胞色素c抗体购自英国Abcam公司;BCA蛋白定量试剂盒购自中国普利莱公司;吖啶橙(acridine orange,AO)/溴化乙啶(ethidium bromide,EB)双染试剂盒购自中国索莱宝科技有限公司;线粒体膜电位检测试剂盒(JC-1)购自中国碧云天生物技术公司;其他试剂均为市售国产分析纯。蛋白电泳仪、转膜仪及Molecular Imager Chemi Doc XRS+System成像仪购自美国Bio-Rad公司;Spectra Max M5酶标仪购自美国Molecular Devices公司;Thermo Scientific ArrayScan Infinity高内涵分析仪购自美国Thermo Scientific公司。
1.2 细胞培养
人神经母细胞瘤细胞SH-SY5Y购自中国医学科学院基础医学研究所。SH-SY5Y细胞用含10%FBS的DMEM/F12培养液,37°C,5%CO2培养,待细胞处于对数生长期时用于实验。
1.3 细胞损伤模型制备和分组
细胞处于对数生长期时,接种于96孔板。正常对照组始终使用完全培养基在常氧培养箱孵育24 h。加药组给予不同浓度的Sal C(0.1,1.0和5.0 μmol·L-1)及阳性药NAC(5 mmol·L-1),2 h 后加入 MPP+(终浓度为 500 μmol·L-1),继续培养24 h。同时设单加 Sal C 5.0 μmol·L-1组和 MPP+500 μmol·L-1组(模型组)。
1.4 MTT法检测细胞存活率
取1.3分组处理的细胞,吸除原培养液,每孔加入100 μL MTT溶液(0.5 g·L-1),37℃继续培养4 h,之后吸除MTT溶液,每孔加入100 μL DMSO振荡,待结晶完全溶解后在490 nm处测定吸光度(A490nm),计算各组细胞存活率。细胞存活率(%)=(实验组A490nm-空白对照组A490nm)(/正常对照组A490nm-空白对照组A490nm)×100%。
1.5 吖啶橙/溴化乙啶染色检测细胞凋亡
取1.3分组处理的细胞,吸除细胞培养液,每孔加入100 μL PBS洗涤2次,之后加入100 μL AO/EB染色工作液(AO∶EB=1∶1,终浓度为1 g·L-1),室温静置2 min,于Cellomics Arrayscan高内涵细胞分析系统进行检测。活细胞的核染色质着绿色并呈正常结构,而显著凋亡的细胞的核染色质为橘红色并呈固缩状,计数并计算细胞凋亡率。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.6 DCFH-DA和MitoSOX检测SH-SY5Y细胞内活性氧(reactive oxygen species,ROS)及线粒体内超氧化物水平
取1.3分组处理的细胞,吸除细胞培养液,PBS洗涤细胞1次,每孔加入50 μL含有DCFH-DA 10 μmol·L-1或MitoSOX 5 μmol·L-1及 Hoechst33258 10 mg·L-1的DMEM/F12培养基,37℃避光孵育30 min。PBS洗涤3次。应用Cellomics Array⁃scan高内涵细胞分析系统检测,使用ImageJ软件进行荧光处理计算,用荧光强度值表示细胞内ROS及线粒体内超氧化物的水平。
1.7 线粒体膜电位JC-1的测定
取1.3分组处理的细胞,吸除培养液上清,用PBS洗涤1次,每孔加入50 μL含有1×JC-1染色工作液及Hoechst33258 10 mg·L-1的培养基,37℃孵育20 min。JC-1染色缓冲液洗涤2次。加入100 μL培养基,应用Cellomics Arrayscan高内涵细胞分析系统检测,使用ImageJ软件进行荧光处理计算,按照JC-1检测结果的常用表示方法,以红色荧光/绿色荧光的比值反映线粒体膜电位高低。
1.8 Western蛋白质印迹法检测Bax、Bcl-2、活化的胱天蛋白酶3和细胞色素c蛋白表达
取1.3分组处理的细胞,加入蛋白裂解液,冰上裂解30 min后,4℃,12000×g离心10 min,用以提取细胞总蛋白,将上清液转移到1.5 mL的EP管中。依据BCA蛋白浓度测定试剂盒步骤进行蛋白定量。之后加入5×上样缓冲液,煮沸10 min。采用等量上样,进行SDS-PAGE电泳,之后转印至PVDF膜上。将转印后的PVDF膜置于5%BSA封闭2 h,之后用TBST稀释后的Bax(1∶1000)、Bcl-2(1∶1000)、活化的胱天蛋白酶3(1∶1000)、细胞色素c(1∶500)和β肌动蛋白(1∶1000)抗体于4℃孵育过夜。回收抗体后的PVDF膜用TBST洗涤3次,每次10 min;再置于稀释后的对应种属的二抗室温孵育2 h,TBST洗涤3次后显色成像。应用Gel-Pro analyzer 4.0图像分析系统,对所得条带进行分析统计,计算条带吸光度值。目标蛋白与β肌动蛋白吸光度值的比值表示目标蛋白相对表达水平。
1.9 免疫荧光检测NADPH氧化酶2的表达和细胞色素c的释放
取1.3分组处理的细胞,吸除原培养液,用PBS洗1次,每孔加入50 μL 4%多聚甲醛,于37°C孵育15 min。PBS洗1次后,每孔加入50 μL 0.3%Triton X-100,于37°C继续孵育10 min。接着,用PBS洗1次,每孔加入50 μL 5%BSA 37℃封闭1 h。之后,加入稀释后的NOX2(1∶100)和细胞色素c(1∶200)抗体,于4℃孵育过夜。然后,用PBS洗3次,每次10 min,每孔加入50 μL荧光二抗稀释液,于37℃孵育1.5 h。PBS洗3次,每次10 min,最后加入Hoechst33258溶液,37℃孵育 30 min,PBS洗1次,于Cellomics Arrayscan高内涵细胞分析系统检测,使用ImageJ软件进行荧光处理计算,用荧光强度值表示相应蛋白的表达水平。
1.10 统计学分析
实验结果以±s表示,使用Graph Pad Prism version 6.0(GraphPad Software,CA,USA)软件中One-way ANOVA(Tukey′spost hoctest)方法进行统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1 SalC对MPP+损伤的SH-SY5Y细胞存活的影响
如图1所示,与正常对照组相比,Sal C 5.0 mmol·L-1单独作用对SH-SY5Y细胞存活无明显影响。MPP+500 μmol·L-1损伤 24 h 后,SHSY5Y细胞活力显著降低(P<0.01)。Sal C 1.0和5.0 μmol·L-1及阳性药 NAC 5 mmol·L-1能够逆转MPP+对SH-SY5Y细胞造成的损伤,显著提高SHSY5Y细胞存活率(P<0.05,P<0.01,P<0.01)。

Fig.1 Effect of salvianolic acid C(Sal C)on cell viability of SH-SY5Y cells injured by MPP+.SH-SY5Y cells were pre-treated with Sal C(0.1,1.0 and 5.0 μmol·L-1)or N-acetyl-L-cysteine(NAC)5 mmol·L-1for 2 h.Then,the cells were treated with or without MPP+500 μmol·L-1for 24 h.±s,n=4. **P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with MPP+group.
2.2 Sal C对MPP+损伤的SH-SY5Y细胞凋亡的影响
如图2A所示,正常对照组活细胞发出绿色荧光,MPP+损伤模型组细胞处于凋亡状态,呈现橘红色荧光。如图2B所示,与正常对照组相比,模型组细胞凋亡率显著升高(P<0.01);与模型组相比,Sal C(1.0和5.0 μmol·L-1)和 NAC 5 mmol·L-1能够显著降低细胞凋亡率(P<0.01)。
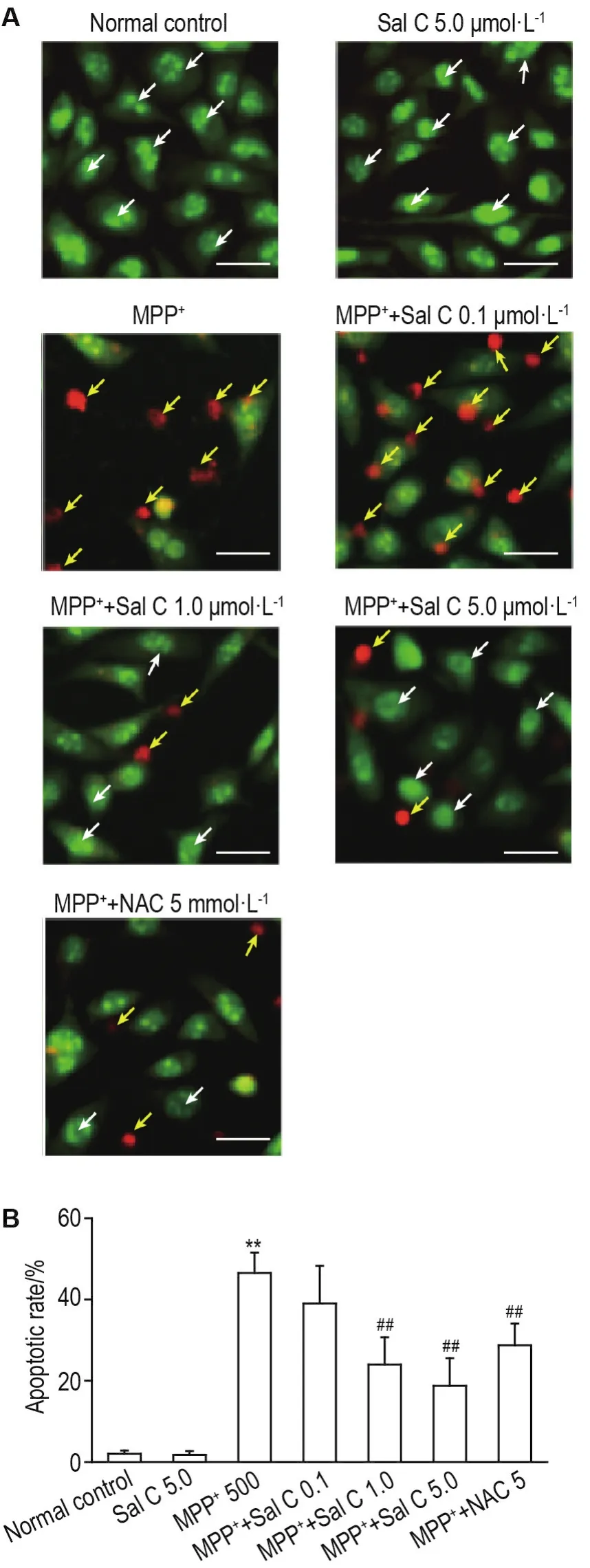
Fig.2 Effect of Sal C on apoptosis of SH-SY5Y injured by MPP+.See Fig.1 for the cell treatment.The apoptosis was monitored using AO/EB staining(A and B).Scale bar=20 μm.White arrows show live cells;Yellow arrows show apoptotic cells.
2.3 Sal C对MPP+损伤的SH-SY5Y细胞中Bax和Bcl-2表达的影响
如图3A所示,与正常对照组比较,MPP+损伤导致SH-SY5Y细胞中抗凋亡蛋白Bcl-2表达降低(P<0.01),促凋亡蛋白Bax表达增加(P<0.01)。Sal C给药组能够降低MPP+诱导的Bax表达升高,但无统计学差异。SalC 1.0和5.0 μmol·L-1可以显著抑制MPP+诱导Bcl-2的降低(均P<0.01)。如图3B所示,MPP+损伤导致SH-SY5Y细胞中Bax/Bcl-2比值显著升高(P<0.01),与模型组相比,Sal C 1.0和5.0 μmol·L-1能够显著降低Bax/Bcl-2比值(P<0.01),维持Bax和Bcl-2表达平衡。
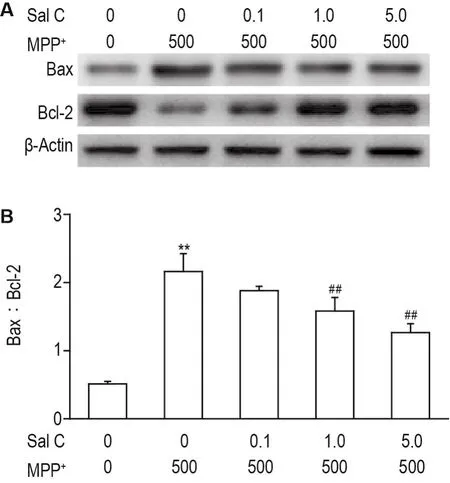
Fig.3 Effect of Sal C on Bax and Bcl-2 levels in SHSY5Y cells injured by MPP+by Western blotting.See Fig.1 for the cell treatment.±s,n=4.**P<0.01,compared with normal control group;##P<0.01,compared with MPP+group.
2.4 Sal C对MPP+损伤的SH-SY5Y细胞ROS和NOX2的影响
如图4A和图4B所示,与正常对照组相比,MPP+组细胞ROS释放显著增加(P<0.01),而Sal C 1.0和5.0 μmol·L-1均能显著降低MPP+损伤导致的ROS释放(P<0.01)。如图4C和图4D所示,模型组细胞内NOX2的表达水平显著增加(P<0.01);与模型组相比,Sal C 0.1,1.0和5.0 μmol·L-1可显著抑制MPP+损伤导致的NOX2表达升高(均P<0.01)。如图4E和图4F所示,模型组MitoSOX荧光强度显著高于正常对照组(P<0.01),Sal C 0.1,1.0和5.0 μmol·L-1可以显著抑制线粒体中超氧化物的释放(P<0.01)。
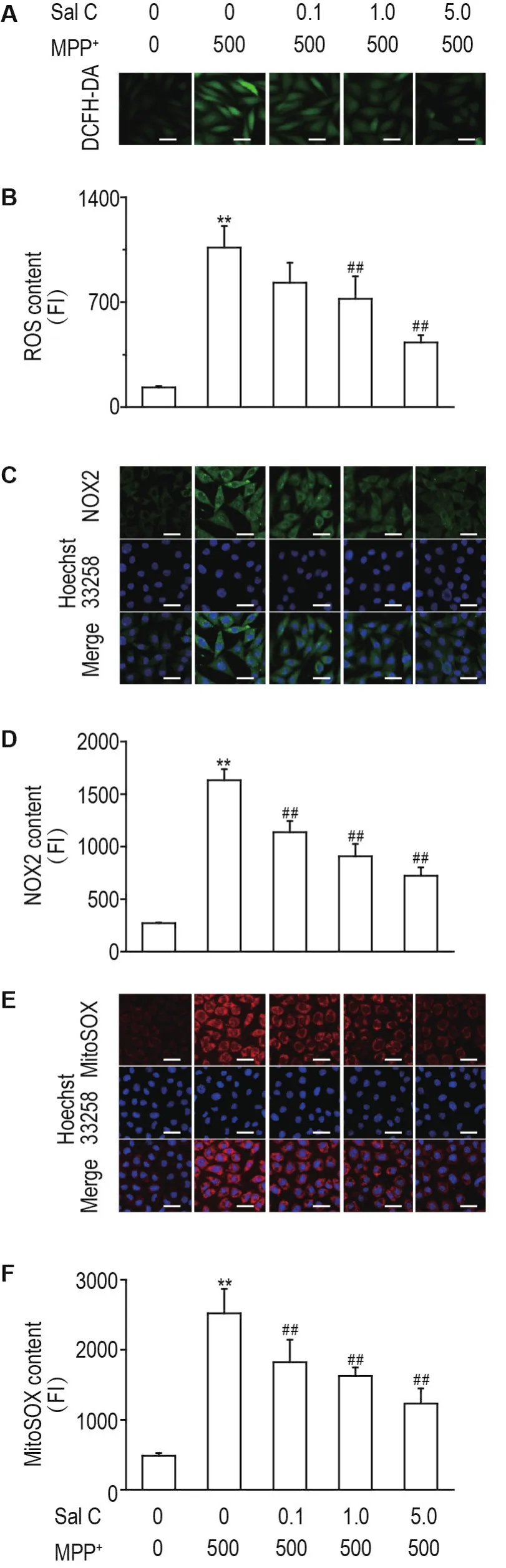
Fig.4 Effect of Sal C on reactive oxygen species(ROS)content and nicotinamide adenine dinucleo⁃tide phosphate oxidase 2(NOX2)production of SH-SY5Y cells injured by MPP+.See Fig.1 for the cell treatment.B,D and F was the semi-quantitative result of A,C and E,respec⁃tively. ± s,n=4. **P<0.01,compared with normal control group;##P<0.01,compared with MPP+group.Scale bar=20 μm.
2.5 Sal C对MPP+损伤的SH-SY5Y细胞线粒体膜电位的影响
如图5所示,正常对照组SH-SY5Y细胞线粒体膜电位较高,JC-1以聚合物形式聚集在线粒体基质中,产生红色荧光。与正常对照组相比,MPP+损伤SH-SY5Y细胞线粒体膜电位降低,JC-1以单体形式存在,荧光由红色转变为绿色,线粒体膜电位显著下降(P<0.01)。Sal C 1.0和5.0 μmol·L-1可以显著抑制MPP+损伤造成SH-SY5Y细胞线粒体膜电位下降(P<0.05,P<0.01)。
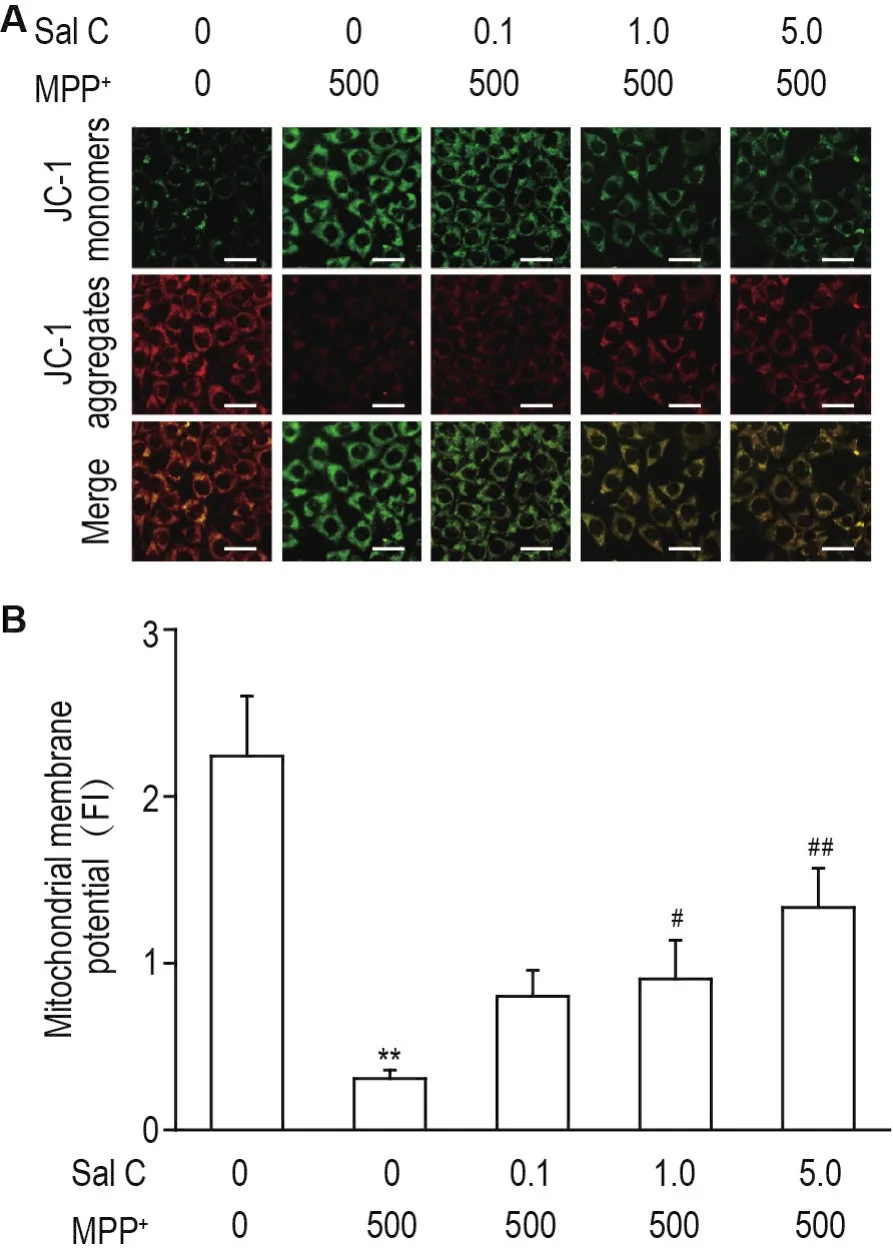
Fig.5 Effect of Sal C on mitochondrial membrane poten⁃tial of SH-SY5Y cells injured by MPP+by JC-1 fluores⁃cence method.See Fig.1 for the cell treatment.±s,n=4.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with MPP+group.Scale bar=20 μm.
2.6 Sal C对MPP+损伤的SH-SY5Y细胞中细胞色素c释放和胱天蛋白酶3活化的影响
Western蛋白质印迹结果显示,与正常对照组相比,MPP+损伤会使细胞色素c释放量显著上升(P<0.01),而Sal C 1.0和5.0 μmol·L-1能显著降低MPP+引起的SH-SY5H细胞内细胞色素c的释放(P<0.01)(图6A和B)。进一步采用免疫荧光法检测SH-SY5Y细胞中细胞色素c的释放,如图6C和D所示,MPP+可以诱导线粒体细胞色素c释放,而Sal C能够抑制MPP+诱导的线粒体细胞色素c释放(P<0.01)。如图6E和F所示,而Sal C 1.0和5.0 μmol·L-1能够显著降低 MPP+损伤引起的胱天蛋白酶3的活化(P<0.05,P<0.01)。
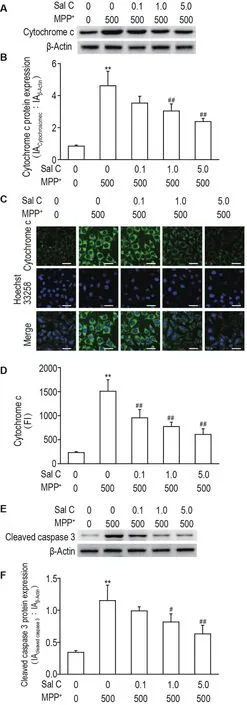
Fig.6 Effect of Sal C on release of cytochrome c(A-D)and expression of cleaved caspase 3(E,F)of SH-SY5Y cells injured by MPP+by immunofluorescence method or by Western blotting.See Fig.1 for the treatment.±s,n=4.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with MPP+group.Scale bar=20 μm.
3 讨论
本研究结果表明,MPP+损伤导致SH-SY5Y细胞存活率显著降低,NOX2蛋白表达显著增加,并且线粒体内超氧化物水平显著提高,进而导致细胞内ROS过量生成,线粒体膜电位下降,最终诱发线粒体途径的细胞凋亡。Sal C在0.1~5 μmol·L-1浓度范围内,可以提高MPP+损伤后细胞存活率,抑制MPP+损伤SH-SY5Y细胞NOX2的表达,降低线粒体超氧化物水平,减少MPP+诱导的细胞ROS生成,改善MPP+引起的SH-SY5Y细胞氧化应激状态,减缓线粒体膜电位去极化,抑制细胞凋亡。
引发PD的因素包括遗传、老化、环境、氧化应激、线粒体障碍、神经炎症、铁代谢异常、α-突触核蛋白异常聚集和表达等[17-19]。研究表明,PD患者脑内存在明显的线粒体能量代谢异常,介导线粒体功能障碍而产生氧化应激[20]。MPTP作为一种神经毒素,其主要毒性表现为影响细胞内能量消耗及自由基产生。MPP+是MPTP的代谢产物,通过高亲和力的多巴胺转运体被选择性转运到细胞内被线粒体吸收,破坏细胞内氧化磷酸化过程,导致ATP产生降低,自由基生成增多[21-23]。
细胞内ROS的稳态对维持细胞正常功能至关重要,过量的ROS是神经退行性疾病的重要特征,参与神经元凋亡[23]。NADPH氧化酶是细胞内ROS的重要来源,NOX2是NADPH氧化酶的亚基,其通过质膜传输电子以产生ROS[24]。线粒体是细胞凋亡的控制中心,也是细胞内ROS的主要来源[20]。本研究发现,MPP+引起SH-SY5Y细胞中NOX2蛋白表达显著增加,线粒体超氧化物水平升高,导致细胞产生过量ROS。Sal C能显著抑制MPP+诱导的SHSY5Y细胞内NOX2蛋白表达及线粒体超氧化物水平的增加,从而降低细胞中ROS的产生。
Bcl-2蛋白家族的促凋亡蛋白和抑凋亡蛋白共同调节细胞凋亡。Bax可形成同源二聚体,促进细胞凋亡;也可以与Bcl-2形成异源二聚体,抑制细胞凋亡,且异源二聚体的稳定性大于同源二聚体[25]。MPP+损伤引起线粒体中超氧化物及细胞内ROS的增加,激活Bcl-2蛋白家族。降低抑凋亡蛋白Bcl-2的表达,提高胞质中促凋亡蛋白Bax的表达水平,显著提高Bax与Bcl-2的比值,促进细胞凋亡。Sal C能够维持Bax/Bcl-2比值的平衡,抑制凋亡发生。
当促凋亡蛋白Bax活性高于抑凋亡蛋白Bcl-2时,Bax构象发生改变,并易位于线粒体膜,导致线粒体膜转换孔开放,线粒体膜通透性改变,膜电位降低[26]。上述过程进而引起线粒体相关凋亡因子细胞色素c释放到细胞质中,释放到细胞质中的细胞色素c与凋亡蛋白酶激活因子结合,形成凋亡体,促进胱天蛋白酶3的活化,引发线粒体途径的细胞凋亡。本研究结果表明,Sal C能够减缓线粒体膜电位去极化,抑制MPP+诱导的细胞氧化应激状态,抑制MPP+诱导的线粒体细胞色素c释放与胱天蛋白酶3的活化程度。
综上所述,Sal C通过抑制NOX2的表达,减少线粒体超氧化物的生成,降低MPP+诱导的细胞总ROS的增加,改善SH-SY5Y细胞的氧化应激状态。且Sal C能够维持Bax/Bcl-2比值的平衡,减缓线粒体膜电位去极化,抑制MPP+诱导的细胞氧化应激状态,抑制MPP+诱导的线粒体细胞色素c释放与胱天蛋白酶3的活化,最终抑制细胞凋亡。

