蛇菰多糖对实验性糖尿病大鼠过氧化物酶体增殖物激活受体γ、鸢尾素和糖脂代谢的影响
陈显兵,杨清煜,覃晓莉,赵方毓,唐鲜娥,王子礼,陈宗海,向家鹏
(1.生物资源保护与利用湖北省重点实验室,湖北恩施 445000;湖北民族学院,2.医学院,3.附属民大医院,湖北恩施 445000)
胰岛素抵抗(insulin resistance,IR)是2型糖尿病(type 2 diabetes mellitus,T2DM)的危险因素,是多种代谢性疾病的前期表现和主要组成部分[1-2]。高脂饮食是导致IR和T2DM发病的重要因素。研究发现,高脂饮食诱导的IR模型与人肥胖时的IR状态及糖耐量受损相似,高脂饮食可影响胰岛素分泌[3-4]。肝是利用葡萄糖、产生葡萄糖的重要器官,肝功能紊乱对IR的发生具有重要意义。过多的脂肪沉积在肝中会改变肝功能,出现甘油三酯(triglycerides,TG)升高,高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)降低,高胰岛素血症和低脂联素血症[5]。
过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPAR)在脂代谢过程中发挥关键作用,调控脂肪储存和释放,在维持机体能量平衡和改善IR等方面均有正向调节作用。鸢尾素(irisin)是一种肌肉因子,通过增加体内能量消耗来改善糖、脂肪及氨基酸代谢,逆转肝脂肪变性,提高胰岛素敏感性的作用被认为可能是肥胖、糖尿病等疾病治疗的突破点[6-8]。研究发现,糖尿病的发生与氧化应激调控密切相关,活性氧(reactive oxygen species,ROS)增多可以促进糖尿病的发生[9],大量摄取高脂饮食能显著增加体内氧化应激的水平[10],同时氧化应激对胰岛素信号通路有抑制作用[11]。提示氧化应激可能对这类疾病的发生及发展有着重要的影响[12]。
筒鞘蛇菰(Balanophora involucrateHook.f.)又名文王一枝笔、借母怀胎或鸡心七。民间医生用其治疗肝炎、消化道出血和醉酒等病症。研究表明,蛇菰含有多糖和黄酮类等成分,具有提高人体免疫功能、清除自由基、抗肿瘤、降血压和降血脂药理活性[13-15]。但蛇菰多糖(Balanophorapolysac⁃charide,BPS)对T2DM的疗效观察及机制研究尚未见报道。本研究拟制备高脂饮食和STZ诱导的IR大鼠模型,探讨BPS对其血糖、血脂和肝组织中自由基的影响,并检测血清鸢尾素和肝组织中PPARγ的变化,探讨BPS抗IR的可能机制,为糖脂代谢性疾病的治疗提供新的思路。
1 材料与方法
1.1 试剂和主要仪器
大鼠鸢尾素ELISA试剂盒(杭州联科Cat.CKE93640R);PPARγ抗体、β肌动蛋白抗体(一抗)和辣根过氧化物酶标记的羊抗兔IgG抗体(二抗)(美国Santa Cruz公司);链脲佐菌素(streptozocin,STZ)(美国 Sigma 公司);总胆固醇(total choles⁃terol,TC)、TG、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和 HDL-C试剂盒(北京索莱宝科技有限公司);超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondi⁃aldehyde,MDA)试剂盒(南京建成生物工程有限公司);胆固醇(湖北中料化工有限公司)。Leica 1850冰冻切片机,Nikon80i正置显微镜(日本),LAS4000mini成像仪,日立7600全自动生化分析仪(日本)。
1.2 蛇菰多糖的提取
筒鞘蛇菰全株于2015年夏季采自湖北省恩施市望城坡,经湖北民族大学药用植物分类与鉴定实验室李厚聪博士鉴定为蛇菰科(Balanophoraceae)蛇菰属(Balanophora)植物,主要分布于湖北、云南和四川等地。洗净后50℃烘干,捣碎成粗粉后称取500 g,加入5 L去离子水,浸泡4 h,加热煮沸提取60 min,过滤,滤渣再分别加去离子水5 L和4 L,同法加热煮沸提取2次,过滤,合并滤液,并于40℃减压浓缩至1 L。浓缩液加入无水乙醇,使乙醇的体积分数达90%,4℃静置过夜。离心分离沉淀,沉淀部分加水0.5 L搅拌,离心,沉淀部分再同法操作2次。合并上清液,将3次沉淀合并加水溶解后,离心除去不溶物,滤液减压浓缩,搅拌后离心收集沉淀,无水乙醇洗涤3次,50℃烘干,得蛇菰粗多糖。Sevage法脱蛋白[16],将所得蛇菰粗多糖配成5%水溶液,加入1/4体积的氯仿-正丁醇混合溶液(氯仿∶正丁醇=4∶1),振摇30 min,离心15 min(5000×g),弃下层沉淀,收集上清,反复3次。混合上清液装入即用型透析袋(相对分子质量:1000;级别:RC膜 S/P 6),蒸馏水透析48 h,冻干,得BPS。苯酚-硫酸法[17]测定其中多糖含量为61.3%。
1.3 糖尿病大鼠模型制备及分组
成年健康雄性SD大鼠30只,体质量200~220 g,湖北省实验动物中心购买(许可证号SCXK(鄂)2015-0018),本实验通过湖北民族学院伦理委员会伦理审查。适应性喂养1周,随机分为正常对照组(n=10),普通饲料喂养;模型组(n=20)高脂饲料喂养(在普通饲料中添加猪油10%、鸡蛋5%和胆固醇2.5%)4周后,一次性ip给予STZ 40 mg·kg-1,1周后测定空腹血糖(fasting blood-glucose,FBG),FBG≥7.8 mmol·L-1作为模型成功标准[18]。将模型大鼠分成2组,分别为模型组和模型+BPSG组,每组10只。模型组ig给予等体积生理盐水;模型+BPS组ig给予BPS 200 mg·kg-1,共4周。所有大鼠最后1次给药后禁食12 h,称取空腹体质量,麻醉后取心脏血,制备血清;然后将肝组织完整取出,预冷生理盐水冲洗干净,滤纸吸干肝表面水分,称肝湿重,然后在相同部位取材固定,新鲜肝组织-80℃冻存。肝指数=肝湿重(g)/体质量(g)×100。
1.4 苏丹Ⅲ染色观察肝形态变化
观察各组大鼠肝大体颜色、形态及质地的变化。在同一部位取材冰冻切片,切片厚5 μm,自然干燥5 min,70%乙醇稍洗,苏丹Ⅲ染色5 min;70%乙醇洗去多余染液,苏木素常规染核,甘油封片后显微镜下观察。
1.5 血糖和血脂检测
将采集的心脏血在室湿下静置60 min后,离心,分离血清,分装。各组大鼠FBG,TC,TG,LDL-C和HDL-C指标检测严格按试剂盒实验流程进行。
1.6 肝组织中SOD活性和MDA含量的检测
取肝组织约1 g,在冰浴中匀浆,离心,取上清。肝组织上清MDA含量和SOD活性的测定方法分别采用硫代巴比妥酸法(TBA法)和亚硝酸盐法。检测严格按试剂盒实验流程进行。
1.7 ELISA法检测血清鸢尾素水平
按该试剂盒的要求取样和保存待测样品,遵照试剂盒说明书进行检测。设置空白孔、标准品孔和待测样品孔,首先在板孔中加入工作液,再分别加入标准品和待测样品,摇匀,用膜覆盖酶标板,37°C孵育1 h,洗涤5次,加入底物,37°C孵育30 min,洗涤5次,TMB显色30 min,加终止液终止反应。酶标仪测定各孔的吸光度值,绘制标准曲线,按公式计算样品浓度。
1.8 Western蛋白印迹法检测PPAR γ蛋白表达
取大鼠肝组织,PBS清洗2次,弃PBS,加入1 mL RIPA裂解液,冰浴匀浆;4℃ 10000×g,离心10 min,去沉淀,留取上清。BCA法测定蛋白浓度,取10 μg蛋白加入上样缓冲液,煮沸5 min后进行SDS-PAGE电泳并电转移至PVDF膜,5%脱脂奶粉室温振荡封闭2 h,TBST洗膜3次,每次5 min,加1∶500稀释的PPARγ一抗4℃孵育过夜,PBS洗膜3次,每次15 min,再加入二抗(HRP标记的IgG,1∶7500)37℃孵育 60 min,PBS 洗膜 3次,每次5 min,用化学发光法检测蛋白表达,以β肌动蛋白为内参照,LAS4000 mini凝胶成像系统显影并分析。以目标蛋白与内标蛋白积分吸光度值比值表示蛋白相对表达量。
1.9 统计学分析
实验结果数据以±s表示,采用SPSS20.0进行统计学分析,用单因素方差分析和t检验进行分析处理,P<0.05为差异有统计学意义。
2 结果
2.1 蛇菰多糖对实验性糖尿病大鼠体质量和肝指数的影响
图1结果显示,与正常对照组比较,模型照组和模型+BPS组体质量增加幅度明显降低(P<0.01);模型+BPS组体质量增加幅度比模型组较高(P<0.05)。正常对照组肝指数为3.21±0.21,模型组肝指数4.43±0.33,显著升高(P<0.01);模型+BPS组肝指数为3.83±0.28,相比模型组显著降低(P<0.01),但仍高于正常对照组(P<0.05)。
2.2 蛇菰多糖对实验性糖尿病大鼠肝组织形态的影响
正常组肝颜色暗红,不油腻。模型组肝较正常组大,颜色棕黄,质软,油腻感强。模型+BPS组肝较模型组有较大改善(图2A)。
正常组肝组织结构完整,肝细胞排列整齐,肝小叶规则,呈放射状分布,肝细胞质中无或仅少数细胞出现脂肪变性;模型组肝小叶结构紊乱,肝细胞体积大,胞浆内可见大小不等的脂滴,且呈弥漫性分布,肝小叶内及汇管区有炎症细胞浸润。BPS组肝细胞脂肪变性比模型组明显好转(图2B)
2.3 蛇菰多糖对实验性糖尿病大鼠FBG和血脂的影响

Fig.1Effect of Balanophora polysaccharide(BPS)on body mass of experimental diabetic rats.Male SD rats were fed with high fat feed(add 10%lard,5%eggs and 2.5%cholesterol to normal feed)for 4 weeks,injected into the abdominal cavity using streptozocin(STZ)40 mg·kg-1one time and fasting blood glucose(FBG)was measured one week later.The model group was identified when the level of FBG ≥7.8 mmol·L-1.Then the experimental group was intragastrically administered BPS 200 mg·kg-1for 4 weeks.±s,n=10.**P<0.01,compared with normal control group;#P<0.05,compared with model group.

Fig.2 Effect of BPS on liver histopathological changes of experimental diabetic rats.See Fig.1 for the treatment.A:the change in liver by the naked eyes;B:the microscopic structure change in the liver.Sections were stained with SudanⅢ.Arrows show lipid droplets.
与正常对照组相比,模型组大鼠FBG水平显著升高(P<0.01);模型+BPS组FBG明显低于模型组(P<0.05),但仍高于正常值,属于糖尿病状态。模型组TC,TG和LDL-C水平比正常对照组升高(P<0.01),HDL-C 水平降低(P<0.01);与模型组相比,模型+BPS组TG和LDL-C水平显著降低(P<0.05),而 HDL-C 水平则升高(P<0.05)(表1)。

Tab.1 Effect of BPS on fasting blood glucose(FBG)and lipid level of experimental diabetic rats
2.4 蛇菰多糖对实验性糖尿病大鼠肝组织中SOD活性和MDA含量的影响
与正常对照组相比,模型组大鼠肝中SOD活性显著降低(P<0.01);与模型组相比,模型+BPS组SOD活性升高(P<0.05)。与正常对照组相比,模型组MDA含量显著升高(P<0.01);与模型组相比,模型+BPS组MDA含量显著下降(P<0.05),但仍显著高于正常对照组(P<0.01)(表2)。
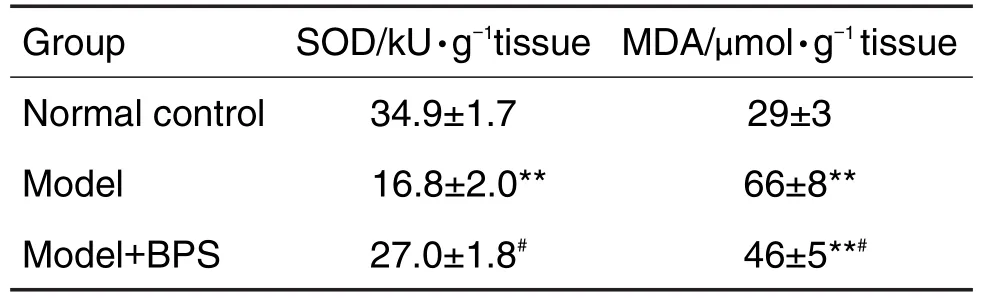
Tab.2 Effect of BPS on SOD and MDA of experimental diabetic rats
2.5 蛇菰多糖对实验性糖尿病大鼠血清鸢尾素水平的影响
实验结果显示,模型组大鼠血清鸢尾素水平显著地低于正常对照组(P<0.01);模型+BPS组大鼠血清鸢尾素水平明显高于模型组(P<0.05)(表3)。

Tab.3 Effect of BPS on serum irisin level of experi⁃mental diabetic rats
2.6 蛇菰多糖对实验性糖尿病大鼠肝组织PPAR γ蛋白的影响
Western蛋白印迹结果显示(图3),模型组PPARγ表达低于正常对照组(P<0.01);模型+BPS组大鼠肝组织PPARγ表达高于模型组(P<0.05)。
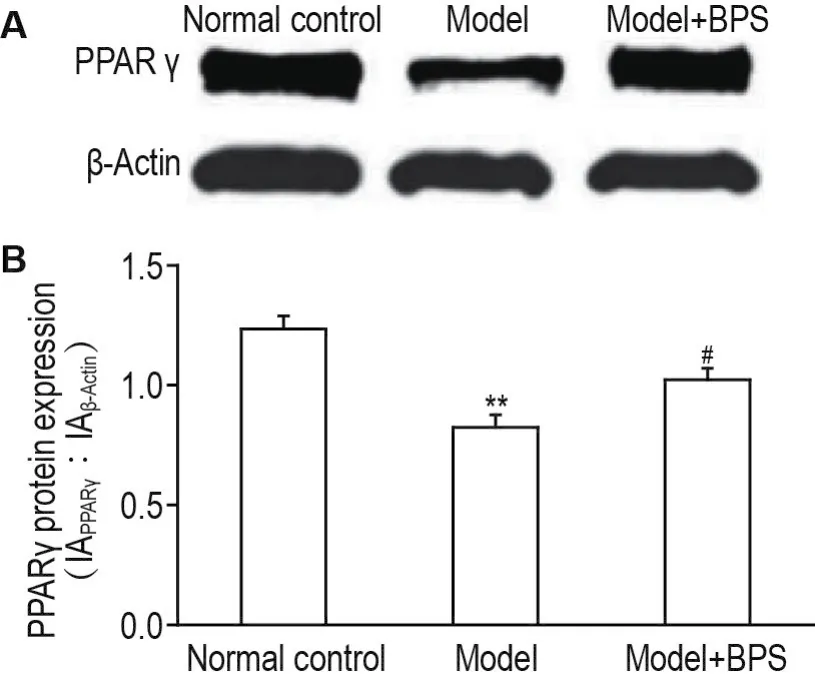
Fig.3 Effect of BPS on expression of peroxisome prolif⁃erators-activated receptor γ(PPAR γ)protein in liver of experimental diabetic rats by Western blotting.See Fig.1 for the treatment.±s,n=10.**P<0.01,compared with normal control group;#P<0.05,compared with model group.
3 讨论
本研究采用高脂饮食方法诱导IR T2DM大鼠模型。模型组大鼠体质量减轻,肝指数升高;苏丹Ⅲ染色光镜观察显示肝小叶结构紊乱,肝细胞体积大,胞浆内可见大小不等的脂滴,肝小叶内及汇管区有不同程度炎症细胞浸润;血清FBG,TG,TC和LDL-C水平明显升高,HDL-C降低;肝组织SOD活性降低,MDA含量升高;血清鸢尾素的水平降低,肝组织中PPARγ蛋白表达降低。表明高脂饮食和STZ方法成功诱导IR T2DM大鼠模型。
本研究结果显示,BPS处理可降低模型大鼠升高的FBG,TG和LDL-C水平,升高HDL-C,提高SOD活性,降低MDA含量,提高血清鸢尾素的水平,上调肝组织中PPARγ蛋白表达,表明BPS对高脂饮食诱导的糖尿病大鼠具有一定的治疗效果。在前期实验中采用BPS 100,200和400 mg·kg-1对模型大鼠进行干预,发现BPS 100 mg·kg-1组FBG呈下降趋势,但与模型组比较无统计学差异;400 mg·kg-1与200 mg·kg-1作用相当,无统计学差异。在本研究中只采用了BPS 200 mg·kg-1对模型组进行干预,未对正常对照组进行单独干预及与阳性药品进行对比。同时发现,BPS 200 mg·kg-1治疗4周,FBG仍高于糖尿病阀值,可能与治疗时间有关。因此,对BPS的毒性及有效剂量有待进一步研究。
本研究发现,IR模型大鼠血清鸢尾素水平明显低于正常对照组,经BPS干预后鸢尾素水平明显上升,与FBG及血脂的变化相一致。但是血清鸢尾素水平与糖尿病相关性的研究还存在争议,可能是由研究的性别和种族差异引起的[19]。但多数研究结果显示,T2DM患者血清鸢尾素水平低于正常人群[20-21]。同时研究发现,肝中存在鸢尾素的免疫反应,提示肝可能是鸢尾素受体活跃的器官[22]。T2DM和肥胖患者胰岛素对肝糖原分解和糖异生的抑制效应明显减弱,血清鸢尾素水平与肝TG呈负相关[23-24]。以上结果表明,鸢尾素参与了IR T2DM的发病。
本研究结果显示,模型组PPARγ的表达显著降低,血清鸢尾素水平减少。PPARγ在脂代谢过程中起关键作用,调控脂肪储存和释放,在维持机体能量平衡等方面均有正向调节作用[25-27]。PPARγ被配体激活后[28-29],改善IR的可能机制包括增强胰岛素信号转导[30]、调节胰岛细胞[31]、参与糖代谢过程中某些关键酶的表达及抑制丙酮酸脱氢酶激酶表达[32]。
综上所述,BPS具有明显的降血糖作用,并且能降低MDA的含量,提高SOD活性,改善脂代谢异常。但BPS的降糖作用是与其提升鸢尾素水平和增强肝内PPARγ的表达有关,还是与提高机体的抗氧化能力有关目前无法确定,其具体的机制有待进一步研究。

