后循环介入术后合并基底动脉尖综合征
杨净松,赵 卫,潘文秋,胡继红
(昆明医科大学第一附属医院影像科,云南 昆明 650032)
后循环血管解剖位置特殊,对于后循环动脉瘤、动静脉畸形(arteriovenous malformations, AVM)等疾病,外科手术难度大,且风险高,目前多选择介入治疗[1-2],而其相关并发症越来越受到重视。基底动脉尖综合征(top of the basilar syndrome, TOBS)是基底动脉尖区(top of the basilar artery, TBA)基底动脉主干和/或分支血管栓塞引起的术后并发症[3]。本文分析接受后循环介入治疗患者术后TOBS发病率、临床表现及其影像学特点。
1 资料与方法
1.1 一般资料 收集2010年1月—2017年7月于我科接受介入治疗的43例颅内后循环动脉瘤、AVM患者的临床及影像学资料,男19例,女24例,年龄24~71岁,平均(52.4±11.2)岁。43例中,19例因TBA动脉瘤而接受栓塞,动脉瘤位于TBA分叉处4例、大脑后动脉(posterior cerebral artery, PCA)12例、小脑上动脉(superior cerebellar artery, SCA)3例;20例TBA及基底动脉分支AVM,其中1例TBA穿支直接供血,15例PCA供血,4例SCA供血,1例由PCA穿支动脉供血;4例接受TBA狭窄成型术。纳入标准:①发生于后循环基底动脉-TBA分支(PCA、SCA)的血管病变(动脉瘤、AVM、动脉狭窄);②单纯接受血管腔内介入治疗,未联合应用外科夹闭或切除手术;③具有完整的术前、术中、术后临床资料与影像学相关资料,影像学与临床表现均提示存在病变。排除标准:①术前由于出血等原因患者处于昏迷状态,无法明确术后症状(如昏迷)是否因介入手术操作引起;②术前影像学检查提示严重脑缺血;③有明确介入手术禁忌证。
1.2 方法 采用支架辅助弹簧圈释放技术栓塞宽颈动脉瘤,其中2例使用Y型支架进行辅助栓塞;以双导管超选择栓塞、单纯弹簧圈栓塞、支架辅助弹簧圈栓塞技术单独或联合对不规则动脉瘤瘤体进行栓塞。对动脉瘤破裂且须行支架辅助栓塞者,手术当日通过胃管等辅助方法给予阿司匹林300 mg,氯吡格雷225 mg,并于术中及术后3天规律使用肝素重叠;术后口服阿司匹林100 mg、氯吡格雷75 mg至少3个月,每日一次,术后3~12个月根据复查DSA结果选择减量或停用抗血小板凝集药物。
对TBA区域及基底动脉分支AVM均以Onxy18液态栓塞系统栓塞畸形血管团;术后控制性低血压2~3天,以预防灌注突破。对于较大畸形采用分次栓塞法,每次栓塞体积约占畸形血管团的30%~40%。
对TBA狭窄成型术患者,术前7天给予口服抗阿司匹林300 mg、氯吡格雷75 mg,每日一次,术中肝素化,采用单纯支架植入狭窄段或球囊辅助支架成型术,植入支架前、后均行血管造影,明确基底动脉血流改善情况。
1.3 TOBS诊断标准 根据患者临床症状及随访观察对TOBS进行分级:严重TOBS,患者出现严重残疾、植物状态甚至死亡;轻度TOBS,术后出现意识障碍、动眼神经麻痹、共济失调等症状,但无影响日常生活的严重残疾,且在随访过程中症状缓解甚至痊愈。
1.4 术后随访 对TBA动脉瘤患者术后随访3个月~2年;TBA区域及基底动脉分支AVM引起TBA狭窄而接受腔内血管成型术患者术后随访6个月~3年,包括术后1个月、3个月、6个月、1年有无临床症状改善或加重。影像学随访包括术后3个月、6个月、1年造影观察动脉瘤、AVM等有无复发,支架有无再狭窄;对临床症状无明显改善者复查CT或MR,观察有无颅脑组织缺血梗死。
2 结果
43例中,6例(6/43,13.95%)术后并发TOBS(表1),其中男、女各3例,动脉瘤、AVM各 3例,分别占全部动脉瘤患者的15.79%(3/19)、全部AVM患者的15.00%(3/20)。严重TOBS 2例,1例对基底动脉分叉处动脉瘤行Y型支架辅助弹簧圈栓塞,术中弹簧圈移位(图1A),支架塌陷,左侧PCA闭塞而致患者死亡;1例对PCA供血AVM行Onxy胶栓塞畸形血管团,之后发现Onxy胶进入脑室内,导致梗阻性脑积水而引起迟发性血管闭塞,丘脑缺血梗死,呈植物状态生存。轻度TOBS 4例,1例出院后3个月仍存在共济失调,随访至1年时共济失调症状消失,随访2年无特殊不适;1例出院时仍存在意识障碍、嗜睡,出院后嘱家属多与之互动,营养神经,加强神经功能刺激,6个月后好转,1年、2年后随访,患者意识清楚;1例出院时存在动眼神经麻痹及意识障碍(嗜睡),出院后3个月意识逐渐好转,随访6个月时意识清楚,瞳孔对光反射迟钝,2年后随访恢复正常;1例术后出现患侧上睑下垂,随访至术后3年,症状较前稍缓解,但仍存在睁眼困难。
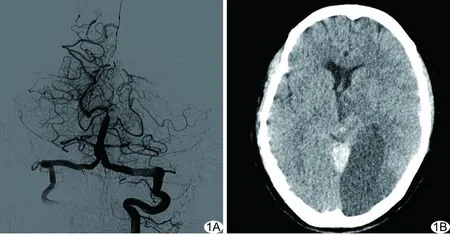
图1 病例1,患者女,47岁 A.弹簧圈移位造成左侧大脑后动脉闭塞; B.术后CT示颞叶、枕叶低密度影
TOBS患者术后1~7天出现颞叶、枕叶、顶叶、丘脑等急性梗死,CT平扫可见片状低密度影(图1B),MRI呈稍长T1稍长T2信号、DWI高信号,栓塞畸形血管团责任血管后出现部分供血区域内血流灌注降低等,见表1。
3 讨论
3.1 TOBS发病率 TOBS多见于心室壁血栓脱落导致后循环血栓栓塞以及动脉粥样硬化引起脑血管狭窄、血栓形成患者[4],与发病相关的危险因素包括高血压、糖尿病、心脏病以及高脂血症等[5]。本组介入治疗后循环TBA病变后TOBS发病率为13.95%,严重TOBS占同期发生TOBS患者的33.33%(2/6),病死率16.67%(1/6),重度致残率16.67%(1/6),可能与栓塞动脉瘤、AVM畸形血管团等时直接进行血管内栓塞操作有关。
3.2 TOBS临床表现及影像学特点
3.2.1 临床表现与原因分析 意识障碍,如嗜睡、昏迷:①术中操作导管导丝、弹簧圈栓塞等引起TBA穿支动脉、尤其是P1段以内的粗大穿支动脉损伤、闭塞,导致丘脑上行性网状激活系统和丘脑边缘系统等缺血梗死;②蛛网膜下腔出血患者,TBA穿支血管痉挛导致丘脑缺血;③导管、导丝在血管内长时间留置[6],且TBA动脉瘤患者多为蛛网膜下腔出血后急诊患者,一般术前抗凝多为大剂量阿司匹林+氯吡格雷,术中以低分子肝素抗凝,但因术中多次操作导管、导丝等刺激血管,弹簧圈栓塞时引起瘤腔内血栓形成,在操作弹簧圈如调整成篮时可能引起动脉瘤内的血栓游离而出现穿支血管闭塞;④术后迟发血栓栓塞引起小的穿支血管闭塞。
动眼神经麻痹:①蛛网膜下腔出血后引起脑室内动眼神经炎性反应;②动脉瘤或其搏动以及后循环TBA畸形血管团形成均可压迫周围颅神经(如动眼神经)而导致出现相应症状[7],TBA发生动脉瘤、尤其是处于搏动状态的动脉瘤时,常伴较严重的动眼神经麻痹症状,但栓塞动脉瘤后搏动效应消失,动眼神经麻痹症状多于半年到3年缓解甚至消失。
共济失调:主要由于栓塞SCA引起部分小脑缺血而导致相应症状,SCA有丰富的侧支循环,一般认为非邻近起始部SCA的介入手术是安全的,但SCA起始部邻近基底动脉干发生动脉瘤等血管疾病时,应注意保留SCA主干,避免严重脑干症状[8]。
3.2.2 影像学表现 DSA可见动脉瘤、AVM责任/非责任血管血液流速减慢、血流量降低甚至血管闭塞而不显影;CT表现为额叶、顶叶、枕叶、丘脑、中脑点片状低密度影,但弹簧圈、Onxy胶等高密度材料周围病变可能与伪影难以鉴别;MRI表现主要为颞叶、顶叶、枕叶、丘脑多发长T1长T2信号、DWI高信号,对诊断TOBS有较高敏感度[4],但对于术后深昏迷、全身麻醉下防止灌注突破的AVM患者等不能进行MR扫描。

表1 TOBS患者的临床资料
3.3 可能引起TOBS的术中操作及患者预后或转归 Y型支架辅助弹簧圈栓塞技术并发症发生率低,临床效果良好,可用于对分叉部动脉瘤的介入治疗[9],但如放置第2枚支架时穿网眼困难,可能导致手术失败;在双支架放置完成后,如动脉瘤复发,难以再次将弹簧圈输送系统穿过支架[10]。本组1例严重TOBS死亡患者(图1A),由于动脉瘤顶端有一小动脉瘤,栓塞后复查造影仍有对比剂进入,且考虑为该小动脉瘤破裂出血,故选择继续以弹簧圈进行填塞,期间弹簧圈进入支架,导致患者一侧PCA闭塞;此外,本例左侧选用Enterprise闭环支架,经回顾观察此例患者基底动脉分叉处成角>180°,而P1-P1段成角越大,发生动脉瘤破裂的可能性越高[11],因此临床发现动脉瘤填塞不完全时,建议于支架内再放支架,或利用LVIS支架,采用“灯笼技术”的特点,使近瘤口处的支架网格金属覆盖率更高[8,12],以达到对弹簧圈的支撑与动脉瘤口处血流的重塑作用;但重叠放置支架是否增加术后支架内血栓形成概率,或造成TBA穿支动脉闭塞而引起TOBS,仍需进一步观察。
本组4例轻度TOBS患者的临床症状均在术后随访过程中缓解,对其日常工作生活无明显影响,可能与后循环丰富的代偿血流相关[13]。
总之,本组严重TOBS发生率4.65%(2/43),主要原因包括过度栓塞导致弹簧圈移位致血管闭塞、术后脑水肿导致血管痉挛闭塞引发脑梗死、栓塞穿支血管等;患者临床表现主要有昏迷、意识障碍、嗜睡、动眼神经麻痹、共济失调等;影像学主要为颞顶枕区、小脑、丘脑等急性缺血梗死表现。发生TOBS后,通过对症处理如营养神经、神经功能刺激等,多数患者的症状可以得到缓解,但严重TOBS可导致植物状态甚至死亡。

