超声引导下经皮激光消融治疗甲状腺乳头状癌术后复发转移淋巴结
张 璐,詹维伟,周 伟,彭 艳,徐上妍
(上海交通大学医学院附属瑞金医院超声医学科,上海 200025)
甲状腺乳头状癌(papillary thyroid carcinoma, PTC)是临床上分化型甲状腺癌的最常见类型,对其术后颈部复发转移淋巴结常需进行手术清扫;但术后由于局部解剖结构改变、组织粘连等原因,致使淋巴结清扫难度增加,且并发症发生率升高[1]。相比于手术治疗,经皮激光消融(percutaneous laser ablation, PLA)消融颈部转移淋巴结精准性高,不失为一种安全、有效的非手术微创治疗技术[2-5]。PLA治疗过程中需同时借助超声进行实时监测,以确保消融的准确性和安全性。本研究主要探讨超声引导下PLA治疗PTC患者术后颈部复发转移淋巴结的安全性及有效性。
1 资料与方法
1.1 一般资料 收集2014年1月—2015年10月我院收治的23例PTC术后复发颈部淋巴转移患者(共30枚转移淋巴结),男5例,女18例,年龄23~75岁,平均(45.8±12.1)岁,均接受超声引导下PLA治疗。纳入标准:①经超声引导下经皮细针穿刺细胞学检查证实为转移淋巴结;②无远处转移;③颈部单区域≤3枚转移淋巴结;④单枚淋巴结直径<2 cm;⑤淋巴结内无直径>2 mm的钙化;⑥患者强烈要求PLA治疗;⑦甲状腺癌切除术后曾接受131I治疗,131I全身显像提示转移灶不摄取放射性碘。
1.2 仪器与方法
1.2.1 术前检查 治疗前完善血清甲状腺球蛋白抗体(anti-thyroglobulin antibodies, TGAb)、甲状腺球蛋白(thyroglobulin, Tg)、凝血功能、心电图等常规检查;采用Mylab 90多普勒超声诊断仪,线阵探头LA523(频率4~13 MHz)及LA522探头(频率3~9 MHz),行甲状腺常规超声扫查及CEUS检查,测量并计算淋巴结体积;淋巴结体积=0.523×前后径×上下径×左右径。
1.2.2 超声引导下PLA治疗 采用EchoLaser X4型激光消融仪行PLA治疗,发射钕钇激光(Nd: YAG laser),波长1064 nm,光纤直径300 μm;并采用Mylab 90多普勒超声诊断仪进行引导。嘱患者仰卧,充分暴露颈部,常规消毒、铺巾。以2%利多卡因局部麻醉后,将生理盐水隔离液注射至组织间隙以隔离血管、神经等重要组织器官(图1A)。超声引导下将21G引导针穿刺至目标淋巴结内(图1B),拔出针芯后插入光纤(图1C)。设定单次输出能量上限为1 000~1 500 J,每次光纤输出功率为3 W或4 W,开始PLA治疗。通过超声实时监测整个治疗过程,随着激光能量的释放,光纤尖端周围逐渐产生强回声气化区,待其范围不断扩大、完全覆盖并超过淋巴结边界(图1D)后追加20~50 J能量,停止消融。如消融后即刻超声复查显示原淋巴结区域为灌注缺损区,认为消融完全;如局部仍可见造影剂进入,则怀疑消融不完全,予以补充消融。
1.2.3 术后随访 分别于消融后1周、1个月时复查常规超声及CEUS,3个月、6个月及之后每隔6个月复查甲状腺常规超声,测量消融区最大径并计算消融区体积,消融区体积=0.523×前后径×上下径×左右径。消融后1周复查CEUS显示消融区域无灌注认为消融完全,如消融区内仍有明显造影剂灌注,提示消融不彻底,需要再次进行消融。消融后每隔3个月复查血清Tg。随访截止至2017年10月。
1.4 统计学分析 采用SPSS 19.0统计分析软件,超声引导下PLA治疗前淋巴结最大径与治疗后消融区最大径符合正太分布,以±s表示,采用配对样本t检验进行比较;超声引导下PLA治疗前淋巴结体积与治疗后消融区体积、治疗前后患者血清Tg呈非正太分布,以中位数(上下四分位数)表示,采用非参数检验(Kolmogorov-SmirnovZ检验)进行比较。以P<0.05为差异有统计学意义。
2 结果
23例颈部复发淋巴转移患者中,18例为单发,5例为多发(3例为2枚转移淋巴结,2例为3枚转移淋巴结);30枚转移淋巴结中,9枚淋巴结位于中央区,21枚位于颈侧区,均经1次治疗完全消融。
6例(6/23,26.09%)患者消融过程中出现轻度烧灼感及颈部疼痛症状,均于术后2周内自行消退。1例(1/23,4.35%)患者在超声引导下PLA治疗后即刻主诉声音嘶哑,随后出现饮水呛咳症状,考虑为喉返神经损伤,术后3个月内自行恢复。无颈部血肿、局部感染或气管及食管损伤等严重并发症。
术后随访24~42个月,平均(32.22±6.26)个月。随访期内末次超声复查完全无法探测的淋巴结占83.33%(25/30),16.67%(5/30)仅可探及条索样低回声。超声引导下PLA治疗后消融区最大径及体积均明显小于治疗前转移淋巴结最大径及体积(P均<0.05,表1)。末次随访复查患者血清Tg水平与治疗前差异无统计学意义(P=0.087,表1)。
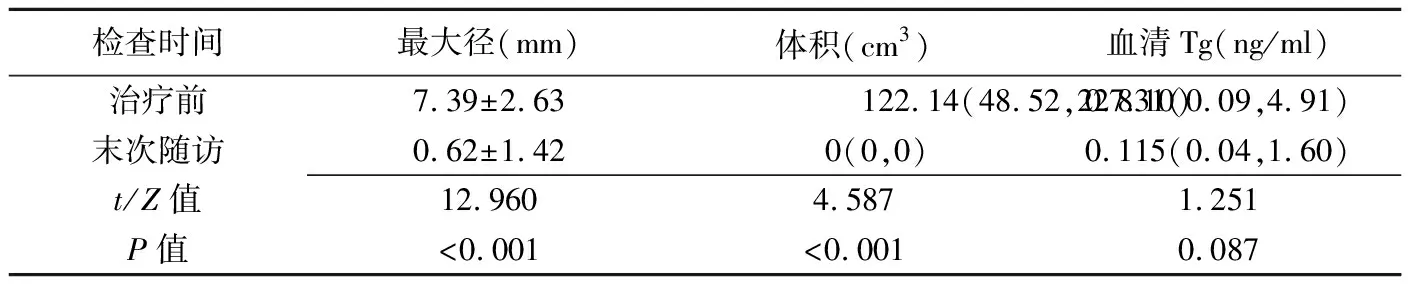
表1 随访末消融灶最大径、体积及血清Tg变化

图1 超声引导下激光消融颈部转移淋巴结 A.建造隔离带(箭); B.引导针(箭)穿刺至淋巴结内; C.插入激光光纤(箭); D.消融范围完全覆盖并超过淋巴结边界(箭)
3 讨论
根据原发性PTC单/多灶、大小、局部或远处转移等情况,甲状腺癌切除术后复发时,患者需要接受再次手术或一次至多次131I治疗。但一方面,并非所有术后复发淋巴结均能通过131I治疗清除,一些失分化PTC细胞(通常由于多次131I治疗导致)失去摄取碘的能力而导致放射性碘治疗无效[6],且131I对体积较大的转移淋巴结治疗效果不明显;另一方面,再次手术可能增加术后并发症风险,如甲状旁腺功能减退、喉返神经损伤、瘢痕形成等。由于甲状腺癌细胞的生物学行为相对惰性,手术对这类复发性PTC可能存在过度治疗的隐患。近年来,随着超声技术的发展,临床越来越多转移性小淋巴结被检出,直径2~3 mm的转移性淋巴结亦可经超声引导下经皮细针穿刺细胞学检查证实[7]。由于术后严重的纤维化和解剖结构变化,体积较小的转移性淋巴结在无超声引导的情况下可能很难被手术清除,多数选择继续随访。
与传统手术相比,经皮消融类微创治疗具有创伤小、安全性高的优势,适用于特殊人群及一般情况较差的患者,且可重复治疗。与其他热消融技术相比,PLA治疗颈部病变有一定优势:①术中可应用21G穿刺针,较射频消融治疗的17G穿刺针和微波消融治疗的16G穿刺针更细[8],在解剖结构比较复杂的颈部,使用细针更有利于穿刺至靶目标,并尽量减少疼痛及出血等;②消融范围小,能量聚集,消融更精确,适用于消融体积较小的病灶[9],有助于减少术中对颈部重要血管神经的损伤。
喉返神经损伤是PLA术后并发症之一,其对患者预后可能造成较为严重的不良影响,因此需谨慎对Ⅵ区淋巴结进行消融。制造隔离带是有效避免热能损伤神经的方法之一。然而,甲状腺术后颈部解剖结构紊乱,以及喉返神经走行存在变异,使得通过超声有时难以准确判断喉返神经的位置,因此即使注射隔离液也不能完全保证不损伤喉返神经[9],必须同时依靠操作者的经验。较小的淋巴结在注射隔离带后活动度增大,穿刺时穿刺针易滑脱且难以固定,操作难度大,需根据淋巴结及周围具体情况决定是否注射隔离液及注射量。本组1例患者术后发生喉返神经损伤,表现为声音嘶哑、饮水呛咳,主要原因在于转移灶位于颈部Ⅵ区,消融该处淋巴结时由于水肿压迫或热能损伤导致喉返神经损伤。消融过程中应不时嘱患者发声来判断其是否发生喉返神经损伤,保护喉返神经为消融治疗中的要点。
至随访末时,本研究中83.33%(25/30)淋巴结经激光消融后消失,仅16.67%(5/30)消融后有组织残留,考虑为局部消融区瘢痕组织形成。本研究对所有患者均随访24个月以上,均未发现原位复发,表明PLA治疗PTC颈部复发转移淋巴结的效果长期稳定。
目前评估肿瘤消融效果的最佳方法仍存在争论。有学者[10-11]认为PTC患者治疗后检测不到刺激后Tg、超声检查阴性为治愈。本研究结果显示,超声引导下PLA治疗前后Tg差异无统计学意义,分析原因:①本组病例中17.39%(4/23)患者可能因术前存在高TgAb(>100 ng/ml)影响后续Tg检测结果的准确性;②所有病例均无肺、骨等远处转移,颈部转移淋巴结≤3枚,转移灶对患者血清Tg影响较小。
本研究的局限性:①为观察激光消融后的长期效果,随访时间较长,但纳入的样本量有限;②淋巴结及消融区体积计算方法是按照椭球体体积计算公式,而消融区随着时间延长逐渐缩小,形状多数欠规则,计算结果可能不够精确。
总之,超声引导下PLA是PTC术后颈部复发淋巴结的一种有效的微创治疗方式。

