硫化氢(H2S)熏蒸对葡萄损伤接种黑曲霉的抑制及其采后品质的影响
张磊,魏佳,张政,吴斌
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐 830091)
无核白葡萄(Vitis viniferaL. cvThompson Seedless)又名“无籽露”,皮薄肉脆,汁多味甜,品质优良[1]。但无核白葡萄不耐贮藏,易受病原菌侵染而腐烂变质。黑曲霉引起的真菌病害是葡萄常见的采后病害,黑曲霉为常温优势菌,葡萄果穗部位的伤口处易被感染,使健康葡萄组织褐色软腐,感染部位先长出白色菌丝后变成黑色的成熟分生孢子[2]。同时葡萄贮藏期间也易发生果实软化、果梗褐变、果粒脱落腐烂等现象,导致葡萄品质的下降,造成巨大经济损失[3]。
硫化氢(Hydrogen sulfide,H2S)是继一氧化氮(NO)和一氧化碳(CO)被发现之后的又一种新型气体信号分子[4]。近年来,越来越多的研究显示,H2S作为信号分子参与了植物体中的多种生理作用,如调节气孔运动、增强植物耐热性、延缓植物衰老、增强植物抗菌性等方面[5~7]。但 H2S是否在果蔬的贮藏保鲜和病害预防中发挥着重要作用至今还不清楚。已有研究表明,采用H2S供体NaHS处理甘薯能够抑制黑腐病和软腐病,并有效缓解了甘薯的衰老和腐烂[8]。H2S还能够有效抑制梨黑曲霉和青霉的生长,且延长了梨的保质期,有效保持了果实的贮藏品质[9]。Hu等人[10]证明H2S延缓草莓衰老所需浓度是很低的,表明低浓度H2S熏蒸水果是食用安全可行的。目前,H2S在果蔬贮藏保鲜中的研究主要以NaHS水溶液处理方式为主,这种一段式释放方式不易控制气体浓度和应用,如何精准控制H2S熏蒸方式是果蔬保鲜方面应用研究的难点。
熏蒸技术是利用熏蒸剂杀死果皮表面病菌,从而降低果实发病率、延长贮藏期。H2S间歇熏蒸采用短时多次的熏蒸方式,可以降低高浓度气体对果实造成的伤害,也有利于气体浓度的精准调控。目前在果蔬保鲜贮藏方面已有相关应用。前期课题组发现NO间歇熏蒸处理木纳格葡萄,可延缓果实的衰老,维持贮藏品质[11]。SO2间歇熏蒸处理红地球葡萄,避免了高浓度SO2气体长时间处理对果实的伤害[12]。因此,间歇熏蒸这种新型处理方式体现了它的优势性。
外源H2S气体诱导处理对葡萄果实品质和贮藏特性影响的研究目前尚未见报道。为此,本文以新疆无核白葡萄果实为试材,研究了H2S处理对其采后黑曲霉病害的控制及果实贮藏品质的影响。为H2S处理在葡萄果实采后保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料与菌种
黑曲霉(Aspergillus niger)新疆农业科学院农产品贮藏加工研究所;无核白葡萄(Vitis vinifera L. var Thompson Seedless),于2017年7月采自吐鲁番,挑选大小均一、无机械损伤、无病虫害的葡萄果实,采后当日置于(0±1)℃实验室冷库中进行预冷处理,预冷时间24 h后待用。
1.2 试剂与仪器
硫化氢(H2S)气体(气体纯度为99.99%),广州世源气体有限公司;L-苯丙氨酸,广州市江顺化工科技有限公司;愈创木酚、Triton X-100,天津市光复精细化工研究所;三氯乙酸、聚乙烯吡咯烷酮、聚乙二醇6000、邻苯二酚,天津市致远化学试剂有限公司;30%过氧化氢、抗坏血酸、酚酞,天津市北联精细化学品开发有限公司;乙二胺四乙酸、β-巯基乙醇、丙酮、氢氧化钠,天津市福晨化学试剂厂;以上试剂均为国产分析纯。
DELTA320分析天平,梅特勒-托利多仪器(上海)有限公司;SIM-F140ADL制冰机,日本松下电器;UV-2600型分光光度计,日本岛津;DW-86L626 80 ℃超低温冰箱,青岛海尔特种电器有限公司;IKA⑧A11基本型研磨机,广州仪科实验室技术有限公司;GY-4硬度计,北京市兴光测色仪器公司;PAL-1数显折射仪,日本Atago公司;Centrifge 5810 R型高速冷冻离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1 H2S熏蒸处理
预实验采用不同H2S浓度(50,250,500,750,1000 µL/L)间歇熏蒸处理葡萄,然后损伤接种黑曲霉,发现500 µL/L的H2S处理对黑曲霉病斑直径和果实病情指数的抑制效果最好,筛选出H2S对葡萄果实病害控制的适宜浓度为500 µL/L。故此后续试验都采用该浓度,将18 kg葡萄随机分成6份,每份约重0.5 kg,置于30 L的熏蒸装置中,密闭后将H2S气体注入熏蒸装置中使其浓度为500 µL/L,同时将装置内的小风扇打开,然后立即关闭进气孔密闭3 h后取出。从第0 d开始熏蒸,每隔24 h在常温下熏蒸一次,共熏蒸5次。每次熏蒸结束后立即取样,共6次。另有18 kg葡萄未经处理为对照组,将处理后的葡萄果实置于常温贮藏。
1.3.2 黑曲霉孢子悬浮液的配制
参考 Bi等人[13]方法进行修改,将纯化好的黑曲霉接种到PDA培养基中,于25 ℃培养7 d后,用无菌水将孢子洗下,再用灭菌的双层纱布过滤,最后用血球计数板在显微镜下计数,并且调节浓度将菌悬液稀释至1×106个/mL,4 ℃下保存备用。
1.3.3 果实损伤接种
熏蒸后的葡萄放置24 h后,每盒选取15颗葡萄对其进行黑曲霉损伤接种,先用75%的酒精溶液擦拭果实表面需要接种的位置,然后在果实赤道部位用灭菌针刺尺寸深2 mm、直径2 mm的孔,用微量移液枪向孔中注入15 μL预先配制好的孢子悬浮液。接种结束后将葡萄果粒分装到塑料盒(175×135×76 mm)中,每个盒子有6个直径1 cm的孔。盒内放置保鲜纸,密闭后套上保鲜袋置于25 ℃条件下贮藏6 d(果实在第6 d腐烂严重,故取样至第5 d),每24 h观察果粒的病情指数和病斑直径。同时避开果实病斑,取健康果肉样品,切碎混匀后用液氮速冻并置于-80℃保存待测。
1.3.4 果实病情指数和病斑直径测定
病情指数(disease index,DI)参照吴斌等[14]的方法;病斑直径利用游标卡尺进行十字交叉法测定,每个病斑测量3次,计算平均值作为其测量值。

1.3.5 果实失重率、落粒率、腐烂率测定
采用称重法测定葡萄的质量失重率、落粒率、腐烂率,重复测定3次。计算公式如下:

1.3.6 果实硬度、可溶性固形物、可滴定酸、抗坏血酸含量的测定
葡萄果实的硬度测定采用GY-4型硬度计;可溶性固形物(TSS)含量测定采用PAL-1型数显折射仪测定;可滴定酸(TA)采用酸碱中和滴定法[15];抗坏血酸含量测定参照钼蓝比色法测定[15]。各处理平行重复测定3次。
1.3.7 果实叶绿素含量的测定
采用丙酮提取法[16]进行测定。
1.3.8 果实防御相关酶活性的测定
过氧化物酶(POD)和多酚氧化酶(PPO)活性的测定参考曹建康等[15]的方法,苯丙氨酸解氨酶(PAL)活性参照Mei[17]等的方法,略有改动。
1.4 数据处理与分析
使用Sigma Plot 12.0软件作图,SPSS 19.5进行数据方差分析并利用 Duncan法进行均值比较。p<0.05表示差异显著,p<0.01表示差异极显著。
2 结果与分析
2.1 H2S处理对葡萄果实病情指数与病斑直径的影响
病情指数和病斑直径是影响葡萄果实贮藏期长短的主要因素,是判断果蔬保鲜效果的重要依据之一[18]。如图1所示,葡萄果实在接种黑曲霉后2 d才开始发病,随着时间的延长,葡萄果实的病情指数呈不断上升趋势,H2S处理能够延缓接种葡萄果实病斑面积的扩大,在25 ℃条件下贮藏6 d后,H2S处理组果实病情指数为0.88(图1a),显著低于对照组的0.92(p<0.05)。葡萄果实接种黑曲霉后,病斑直径随贮藏时间的推移逐渐增大。在整个贮藏期间,H2S处理组果实的病斑直径始终低于对照果实。H2S处理可显著抑制果实病斑的扩展,在25 ℃条件下贮藏至第3 d,H2S处理组和对照组葡萄果实的病斑直径分别为10.8 mm和14.3 mm(图1b),H2S处理组果实的病斑直径比对照果实低了24.5%(p<0.01)。
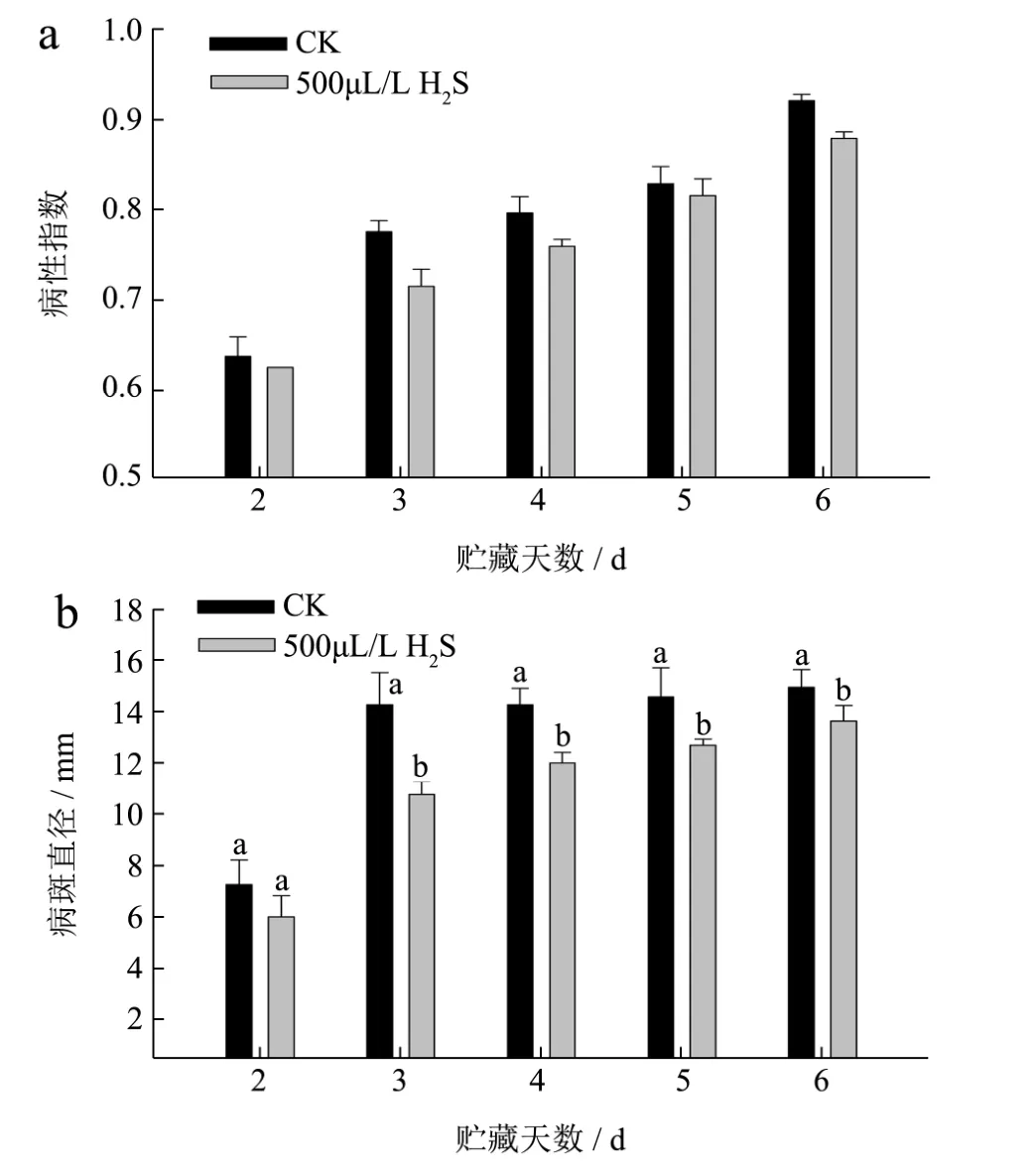
图1 H2S处理对葡萄果实病情指数(a)和病斑直径(b)的影响Fig.1 Effects of H2S treatment on disease index (A) and lesion diameter (B) of grapes during storage
2.2 H2S处理对葡萄果实失重率、落粒率、腐烂率的影响
蒸腾失水是导致果蔬贮藏期间失重的主要原因之一[19]。葡萄贮藏过程中,随着时间的延长,果实营养物质损失和受霉菌侵染,造成葡萄果粒脱落和果实腐烂变质[20]。
由表1可以看出,在整个贮藏期间,葡萄的失重率呈上升趋势,且H2S处理组失重率始终低于对照组,贮藏至第5 d,对照组失重率为H2S处理组的1.39倍(p<0.01);葡萄的落粒率在整个贮藏期间呈上升趋势,且H2S处理组落粒率显著低于对照组(p<0.01);在葡萄整个贮藏期间,其腐烂率总体来说呈现上升趋势,贮藏至第2 d,葡萄果实才开始腐烂,但对照组腐烂率显著高于H2S处理组(p<0.01),但在贮藏至3~5 d,对照组和 H2S处理组的腐烂率差异不是很大(p>0.05)。这表明H2S可以抑制葡萄质量损失率的上升,缓解葡萄果实的落粒,降低腐烂率。
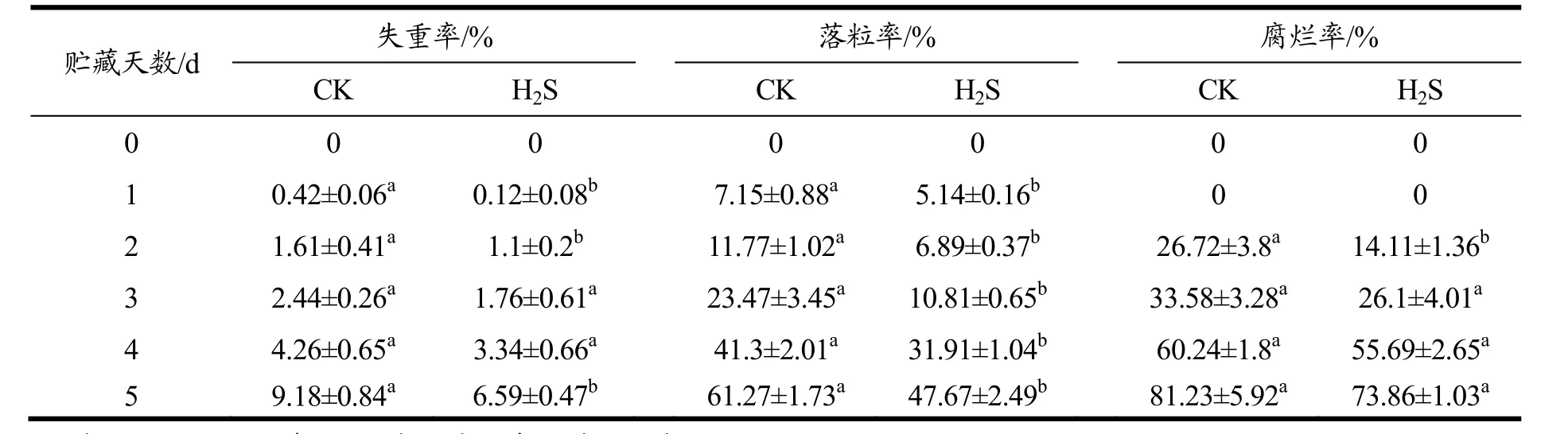
表1 H2S处理对葡萄果实失重率、落粒率和腐烂率的影响Table 1 Effects of H2S treatment on weight loss rate, drop rate and decay rate of grapes during storage
2.3 H2S处理对葡萄果实硬度、TSS、TA、抗坏血酸含量的影响


图2 H2S处理对葡萄果实硬度(a)、可溶性固形物(b)、可滴定酸(c)和抗坏血酸(d)的影响Fig.2 Effects of H2S treatment on hardness (a), soluble solids (b),titratable acid (c) and ascorbic acid (d)of grapes during storage
果实硬度是葡萄采后耐贮性的重要品质之一,而软化的果实容易受机械损伤和病菌感染[21]。由图 2a可知,葡萄采后随着贮藏时间的延长逐渐软化,硬度迅速下降,H2S处理组跟对照组葡萄的硬度在采后前2 d变化不大,从第3 d开始,对照组的葡萄的硬度显著低于H2S处理组(p<0.01)。说明H2S处理能够延缓葡萄果实的成熟软化。
果蔬样品中的可溶性固形物(TSS)主要是可溶性糖,其含量与果蔬的呼吸强度和品质状况相关[22]。由图2b可知,葡萄果实中TSS含量随着贮藏时间的延长而逐渐降低,第1 d和第2 d,对照与H2S处理组无显著差异(p>0.05),从第3 d开始,对照组TSS含量的下降速度明显高于H2S处理组(p<0.05),说明H2S能够较好的抑制TSS含量的下降。
可滴定酸(TA)作为果蔬呼吸底物会随着贮藏时间的延长被消耗,同时也是重要的呈味物质[22]。如图2c所示,葡萄果实中的TA含量在贮藏期间整体呈先上升后下降的趋势。由于葡萄果实中的有机物被消耗分解,使其TA含量短时间内增加,H2S处理组在第2 d达最大值。而处理组TA含量高峰推迟了1 d,但其含量依然低于H2S处理组,随贮藏时间的延长,果实呼吸作用持续进行,有机酸含量逐渐降低。在整个贮藏期间,除了第3 d外,H2S处理组TA含量均显著高于对照组(p<0.05)。结果表明,H2S能够较好的维持TA含量。
抗坏血酸含量与水果的品种、成熟度、耐贮性和贮藏条件有关,是水果营养价值的重要组成部分[23]。从图2d可以看出,贮藏期间,葡萄果实中的抗坏血酸含量呈下降趋势,且H2S处理组抗坏血酸含量始终高于对照组,贮藏至第1 d和第4 d,H2S处理组抗坏血酸含量分别是对照组的1.19和1.21倍(p<0.01)。结果表明,H2S对葡萄抗坏血酸的损失起到较好的保护作用。
2.4 H2S处理对葡萄果实叶绿素含量的影响

图3 H2S处理对葡萄果实叶绿素的影响Fig.3 Effects of H2S treatment on chlorophyllof grapes during storage
叶绿素是与果蔬采后商品性状密切相关的重要色素之一[24]。H2S处理对葡萄果实叶绿素含量的影响如图3所示,贮藏期间,葡萄果实中的叶绿素含量呈下降趋势,且H2S处理组叶绿素含量始终高于对照组,在贮藏第2 d和第4 d,H2S处理组叶绿素含量分别高于对照组28.16%和35.4%(p<0.01)。说明H2S能有效维持果实叶绿素含量。
2.5 H2S处理对葡萄果实防御相关酶活性的影响
过氧化物酶(POD)是植物体内重要的抗病防御相关酶,在病害防御方面发挥着重要作用[25]。图 4a表明,经接种黑曲霉后,POD活性在整个病害观察期均呈先逐渐升高后下降的趋势,接种后第2 d,H2S处理组POD活性出现高峰后缓慢下降,而对照组POD活性在第3 d出现高峰后快速下降,尤其接种第4 d后,H2S处理组POD活性下降速率显著大于对照组(p<0.01)。表明H2S能够较好的抑制POD活性的下降。
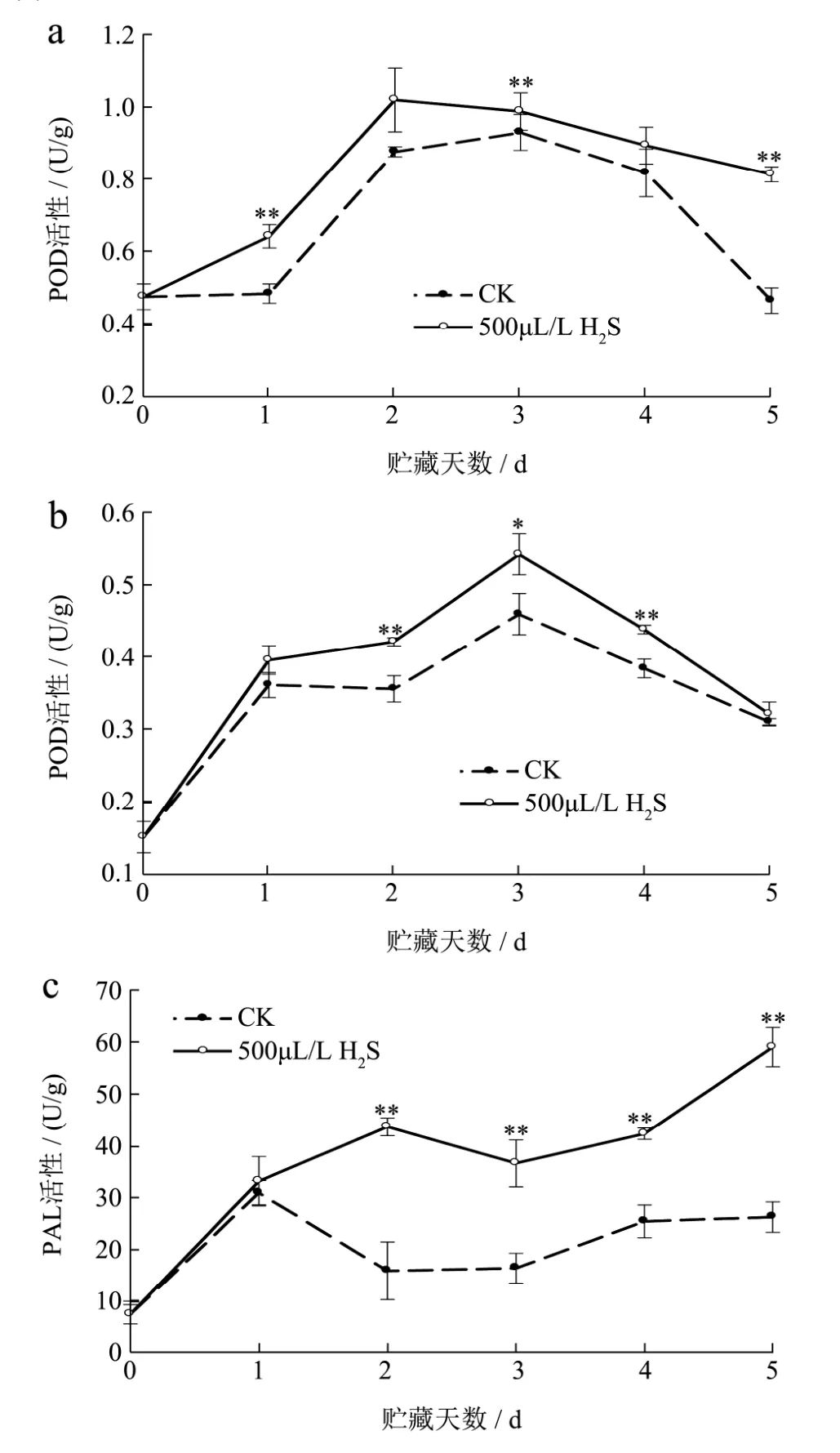
图4 H2S处理对葡萄果实在贮藏期间POD(a)、PPO(b)和PAL(c)活性的影响Fig.4 Effects of H2S treatment on of POD (a), PPO (b) and PAL(c) activities of grapes during storage
多酚氧化酶(PPO)是一种能够催化酚类生成醌类的氧化酶,当果蔬组织受到逆境胁迫或病原菌侵染时,PPO会快速上升来保护果蔬组织[26]。如图4b所示,接菌后葡萄的PPO活性总体上呈先升高后降低的变化趋势。在第3 d,两者同时达到最大值,此时H2S处理组的PPO活性高出对照组15.24%(p<0.05),随后处理组与对照组的PPO活性均开始下降,但处理组的PPO活性始终高于对照。说明H2S处理可提高葡萄果实PPO的活性。
苯丙氨酸解氨酶(PAL)是苯丙烷途径中的关键酶和限制酶,其活性的高低直接与寄主的抗性强弱有密切的关联[27]。由图4c可知,H2S处理组和对照组的PAL活性整体上均呈先上升后降低再上升的变化趋势。接种后第1 d,对照组便出现小峰,而处理组PAL活性不断升高,于第2 d出现峰值,此时为对照PAL活性的 2.75倍,且差异性显著(p<0.01)。之后对照组PAL活性缓慢上升,而对照组PAL活性先下降后快速上升。贮藏期间处理组PAL活性始终高于对照。H2S处理不仅增强了果实PAL活性,并使其维持相对较高水平。
3 讨论
近年来,研究发现H2S作为一种新型气体信号分子,可诱导采后果蔬产生抗病性。如H2S对草莓灰霉病的主要致病菌包括酿酒酵母、黄绿青霉和梨形毛酶均有较强的抑制作用[28]。H2S抑制了采后桃果实褐腐菌菌斑直径和果实病斑直径的扩展[29]。本文中,H2S熏蒸能够有效控制常温条件下葡萄采后黑曲霉的生长,显著降低了果实的病情指数,抑制了病斑直径的扩展。这可能是由于H2S直接诱导黑曲霉ROS产生以及过量的 ROS导致氧化损伤对菌丝生长和孢子萌发起到关键作用[30]。
H2S处理的葡萄果实失重率、落粒率、腐烂率与对照组相比显著下降,明显降低果实硬度、TSS、TA和抗坏血酸含量下降的速度,保持了果实叶绿素含量。从而延缓葡萄果实采后衰老速度,延长其贮藏时间。H2S可作为果蔬保鲜剂,明显延缓西兰花、莴笋、苹果、番茄、哈密瓜等鲜切果蔬的萎蔫失水、成熟、衰老和霉变,维持采后果蔬的品质特性,延长其贮藏期[31]。采后H2S处理可以抑制猕猴桃失重率、硬度、TSS、TA、抗坏血酸和叶绿素含量的下降,延缓了猕猴桃成熟和衰老进程[32]。H2S处理还能显著降低贮藏过程中桃果实腐烂率和失重率,延缓TSS的升高和硬度的下降,从而延缓果实的软化进程,显著延长采后桃果实的货架期和贮藏期[33]。这与本实验的研究结果相一致。
POD、PPO活性的增强对于采后果实抗病性的增强具有重要作用。1-MCP诱导红富士苹果抗病过程中,POD、PPO活性显著升高[25]。Tang等[8]研究发现H2S处理甘薯显著提高 POD的活性,从而增强了甘薯的抗病性,有效缓解了甘薯的衰老和腐烂。H2S处理还能增强采后鲜切梨 POD活性,阻止了黑曲霉和青霉病原菌的进一步生长[35]。这与本试验结果一致,在本研究中,采后H2S处理明显增强了葡萄果实POD、PPO防御酶的活性,这可能是因为H2S诱导了木质素、植保素等抗性物质的形成,增强酚类物质氧化能力,生成对病原微生物有毒性作用的醌类物质[34]。PAL是苯丙烷代谢途径的关键酶和限速酶。马铃薯[36]和甜瓜[37]抗病性的增强都伴随着 PAL活性的上升。本研究表明H2S处理诱导了葡萄果实PAL活性的上升,可能是H2S可以诱导苯丙烷代谢系统,激活抗病代谢产物的生成,如酚类、类黄酮类、木质素和植保素等,从而提高果实的抗病性[34]。这与张畅[29]在桃果实上的研究结果一致。但H2S对病害控制的分子机理尚不清楚,有待后续实验进一步研究。
4 结论
综上所述,H2S气体熏蒸处理显著降低了损伤接种黑曲霉无核白葡萄果实的病斑直径和病情指数,明显诱导了果实体内POD、PPO、PAL等防御酶活性的增强。有效抑制了失重率、落粒率、腐烂率的上升,显著降低了果实硬度、TSS、TA和抗坏血酸含量下降的速度,保持了果实叶绿素的含量。从而延缓葡萄果实采后衰老进程,提高果实的采后抗病性和贮藏品质。由此表明,500 µL/L H2S处理在一定程度上能够增强葡萄果实的抗病性,还能提高葡萄果实的贮藏品质。
——硫酰氟熏蒸应用技术

