FAS2基因过表达对酿酒酵母风味酯生成能力的影响
杜永静,陈叶福,李洁,何亚辉,龚瑞,郭学武,肖冬光
(天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
白酒是我国特有的蒸馏酒,在人们的日常生活中占有重要地位,酯类作为白酒中含量最多的香味成分之一,种类较多,是白酒香气的物质基础,对白酒的风味和香型起着关键性作用。适量的酯可使酒体丰满,香味协调,给饮酒者带来喜悦感。白酒中酯类主要分为两大类,乙酸酯类和脂肪酸乙基酯类。乙酸酯类主要包括:乙酸乙酯、乙酸异戊酯和乙酸异丁酯等,在各种香型白酒中含量均较高,对白酒风味贡献比较大,其中乙酸乙酯是清香型、芝麻香型等多种香型白酒的主体香;乙基酯主要有丁酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯等[1]。我国名优白酒中以含乙酸乙酯、丁酸乙酯、己酸乙酯和乳酸乙酯四大酯为主,其和占总酯含量的80%以上,含量多少与白酒香型相关[2]。
以己酸乙酯为主体香成分的浓香型白酒,是我国产量和消费量最大的白酒。己酸乙酯是浓香型白酒的主体香,然而酿酒酵母自身虽然具有极强的酒精发酵效率,但其产酯能力极低。在酵母发酵过程中,代谢产物己酸乙酯含量很少,一般在0.5 μg/mL左右。能否让酿酒酵母大量合成和分泌己酸乙酯,是一个长期困扰我国白酒界的问题[3]。
影响白酒酿造最终产己酸乙酯的因素很多,如酵母菌种,原料、糖化剂及发酵工艺等[4,5]。白酒中己酸乙酯等中链脂肪酸乙基酯主要是在酒精发酵后期,由大曲和窖泥中酯化能力极强的霉菌(根霉、毛霉和曲霉)在酯化酶的作用下酯化己酸和酵母产生的乙醇合成,但其发酵周期长,粮耗大[6]。工业上为了提高白酒的酯含量,通常采用的方法有:添加生香酵母、延长发酵期和窖藏时间[7]。然而这些方法在提高酯产量的同时,增加了人力和物力的消耗,延长发酵期还带来了糠嗅味、涩味、酸味等异味,会降低白酒品质[8]。为提高酿酒酵母产己酸乙酯的能力,使得酿酒酵母在主发酵期,保持其高产乙醇特性的同时高产己酸乙酯,以达到缩短白酒发酵周期、减少粮耗的目的,故有必要构建高产己酸乙酯的酿酒酵母菌株。因此,研究和构建高产己酸乙酯酿酒酵母用于白酒生产,对于改善白酒风味和品质具有重要意义[9,10]。本研究以实验室前期构建的α5F-FAS1及α5O-FAS1作为出发菌株[11],过表达FAS2基因,从而获得FAS1,FAS2共同过表达的菌株α5F-FAS1,2和α5O-FAS1,2,研究共表达FAS基因对中链脂肪酸乙酯产量的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli)DH5α、酿酒酵母(Saccharomyces cerevisiae)AY15的单倍体α5均为天津科技大学天津市工业微生物重点实验室保藏。其中质粒Yep352-P为本实验室保存,质粒pUC6由德国Hegemann教授惠赠。
1.1.2 培养基及培养条件
YEPD培养基(m/V):葡萄糖2%,酵母粉1%,蛋白胨2%。
LB培养基(m/V):葡萄糖1%,酵母粉0.5%,蛋白胨1%。
以上两种培养基,自然pH值,固体培养基加2%琼脂,121 ℃灭菌15 min。
发酵培养基:玉米糖化醪。
1.1.3 试剂和酶
限制性内切酶、DNA连接酶、rTaq聚合酶、RNA提取试剂盒、质粒小提试剂盒、PCR纯化试剂盒及荧光定量PCR试剂盒均购自宝生物工程(大连)有限公司;卡纳霉素(KanMX)购自Merck公司;酵母基因组DNA提取试剂盒购自北京索莱宝科技有限公司;引物由金唯智生物科技有限公司合成。
1.1.4 仪器
PCT-200型PCR基因扩增仪,台式高速离心机,电热恒温水浴锅电子天平,DYY-4c型电泳仪,Reference-2型移液枪,DL102x型电热鼓风干燥箱,AgilentGC 7890,StepOnePlus™实时荧光定量PCR仪。
1.2 实验方法
本实验采用同源重组基因改造的方法,同时结合质粒构建技术将相应基因连接到载体Yep352-P上,然后以酿酒酵母(Saccharomyces cerevisiae)己糖转运蛋白Hxt16基因为整合位点,过表达脂肪酸合成酶亚基FAS2基因,并筛选得到重组菌株。
1.2.1 引物
本实验所用到的PCR反应引物见表1,引物设计均采用Primer 5.0软件设计。具体引物说明如下:根据NCBI公布的酿酒酵母Saccharomyces cerevisiae的FAS2基因,设计用于扩增 FAS2基因的引物对FAS2-U/FAS2-D。根据pUC6质粒序列设计用于扩增KanMX抗性基因序列的引物KAN-U和KAN-D。根据NCBI公布S. cerevisiaeS288c的Hxt16基因序列,设计用于扩增 HXT16上游同源臂序列FA的引物对FA-U(Hxt16)/FA-D(Hxt16),及 HXT16下游同源臂序列 FB的引物对 FB-U(Hxt16)/FB-D(Hxt16)。根据Yep352-P质粒序列设计用于扩增过表达片段的引物对PGK1P-U/PGK1T-D。
1.2.2 重组质粒Yep-PF2质粒构建
将纯化过的 FAS2片段用 Xho1酶切连入Yep352-P,构建表达质粒Yep-PF2。构建过程详见图1。
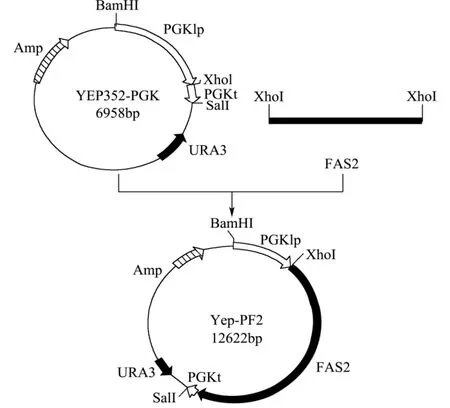
图1 质粒Yep-PF2的构建Fig.1 Flow chart of recombinant plasmid Yep-PF2 construction
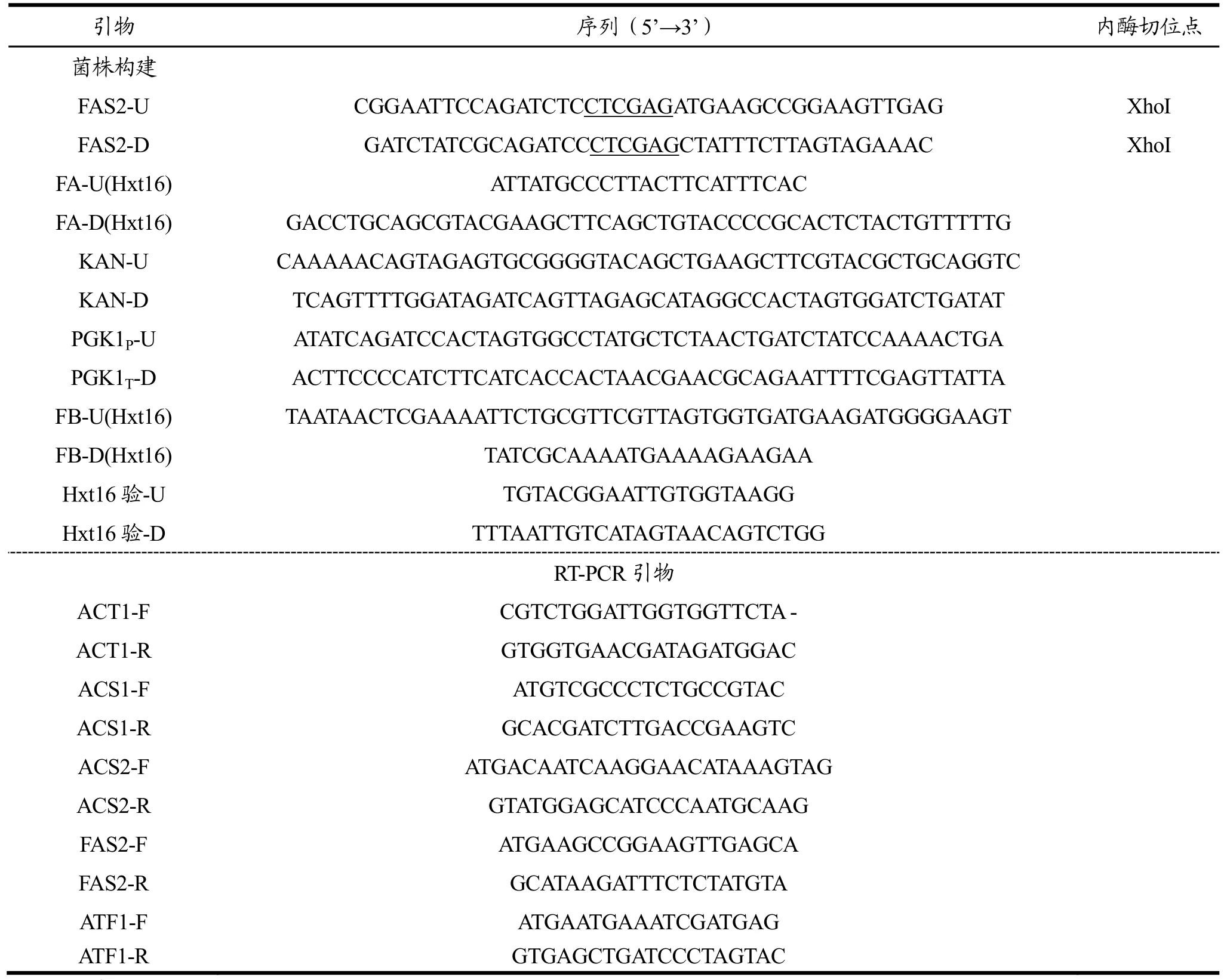
表1 PCR引物Table 1 PCR primers used in this study
1.2.3 酵母转化
从酿酒酵母(Saccharomyces cerevisiae)α5的基因组上扩增得到上下同源臂FA和FB,从质粒Yep-PF2上扩增得PGK1p-FAS2-PGK1T片段,从质粒pug6上扩增得loxp-KANMX-loxp片段,使用醋酸锂转化法[12]转化到酿酒酵母α5中,涂布含 1000 μg/mL G418 YEPD平板,30 ℃,静置培养48 h,对YEPD平板上生长的单菌落进行筛选验证。
1.2.4 发酵验证
从YEPD斜面上挑取1环菌种接入含5 mL一级种子培养基的试管中,30 ℃静置培养24 h,进入稳定期后,按照10%的接种量将其接种到含45 mL二级种子培养基的三角瓶中。
30 ℃静置培养16~17 h至对数期的后期,然后按照10%接种量接种到发酵培养基。30 ℃静置发酵,每隔12 h称重1次,发酵结束后测定CO2累计失重、发酵时间、酒精度、发酵液残余还原糖及酯的含量,每个样品做3个平行,取平均值。
1.3 分析方法
1.3.1 CO2失重的测定
在发酵过程中,按照文献[13]描述的方法每隔12 h称重1次。
1.3.2 还原糖的测定?
斐林试剂法[13]。
1.3.3 酒精度的测定
酒精计比重法[13]。
1.3.4 酯测定方法
1.3.4.1 乙酸乙酯测定方法[14]
发酵结束后将发酵液进行蒸馏,得到含乙酸乙酯的样品进行气相色谱分析。根据Agilent GC7890气相色谱说明书及有关白酒样品检测资料设定检测高级醇的最佳条件为:色谱柱:105 m×0.530 mm毛细管柱;柱温50 ℃保持8 min,然后以5 ℃/min的速度升温至150 ℃,再保持15 min;进样口温度200 ℃;检测器温度 200 ℃;载气流速 20 mL/min;氢气流速 30 mL/min;空气流速400 mL/min;尾吹速度25 mL/min;分流比 10∶1;进样量 1 μL。
1.3.4.2 中链脂肪酸乙酯测定方法[11,15]
发酵结束后将发酵液进行蒸馏,得到含中链脂肪酸乙酯的样品进行气相色谱和气质色谱(GC-MS)分析。将酒样稀释至12%(V/V),取8 mL置于20 mL螺口顶空样品瓶,加3 g氯化钠,放入磁性转子,用聚四氟乙烯将瓶口紧密封好。样品在恒温磁力搅拌器中60 ℃平衡 10 min,将萃取头插入瓶内顶空吸附 40 min。萃取后将萃取头插入GC-MS系统进样口,250 ℃解吸附5 min。
1.3.4.3 气相色谱条件
色谱柱为 Agilent CP-Wax(60 m×0.25 mm×0.5 μm);进样口温度为250 ℃,不分流;载气氦气流速为0.8 mL/min;升温程序为起始40 ℃维持2 min,按照2 ℃/min的速度升到100 ℃,再按照4 ℃/min的速度升到230 ℃,维持3 min。质谱条件:EI;70 eV;扫描范围30~500 u;离子源温度230 ℃。
1.3.5 数据分析
每组实验做三个平行,并使用 SPSS 11.0和EXCEL 2013软件对实验数据进行差异显著性检验分析(ANOVA)。
2 结果与讨论
2.1 突变株的构建与验证
2.1.1 重组质粒Yep-PF2构建与验证
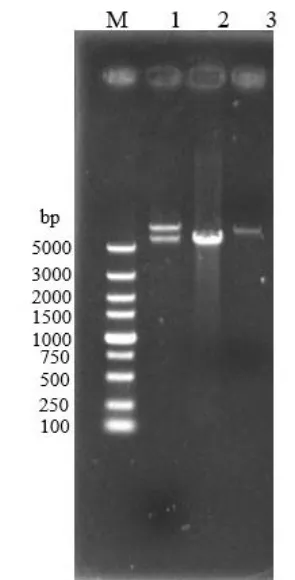
图2 重组质粒Yep-PF2的验证Fig.2 The verification of recombinant plasmid of Yep-PF2
使用1.2的方法,构建表达质粒Yep-PF2。对重组质粒进行酶切验证,结果如图 2所示。其中 1道为Yep-PF2用XhoI酶切后的线性化片段,分别存在大小为6958 bp和5664 bp的条带;2道为以a5基因组为模板扩增得到的FAS2基因片段,大小为5664 bp;3道为Yep-P用XhoI酶切后的线性化质粒,大小为6958 bp。酶切结果与理论预期相符,说明FAS2基因片段成功插入到Yep-P上的PGK1启动子和终止子中间的多克隆位点处,Yep-PF2质粒构建成功。
2.1.2 过表达FAS2基因突变株的构建与验证

图3 重组片段的同源重组示意图Fig.3 The process of homologous recombination
用醋酸锂转化法将四个片段:上同源臂FA、下同源臂 FB、PGK1p+FAS2+PGK1T片段、loxP-KanMX-loxP基因片段导入酿酒酵母α5F-FAS1及α5O-FAS1。通过FA和FB片段与酵母基因组上HXT16基因两侧的同源序列发生同源重组,从而实现了FAS2基因的过表达盒整合到酿酒酵母染色体上。同源重组过程如图3。将导入片段的菌液涂布在含有1000 mg/L G418抗性的YEPD平板上,30 ℃条件下培养2 d,挑取转化子进行验证。分别以长势较好的转化子基因组为模板,以出发菌株α5F-FAS1及α5O-FAS1的基因组为阴性对照,分别用三对引物进行验证,验证过程如图4。

图4 突变株的验证过程Fig.4 The verification of transformants
引物对Ⅰ:Hxt16验-U/KAN-D进行上游定点PCR验证,PCR产物经0.8%的琼脂糖凝胶电泳,可看到一条大小约2655 bp左右的特异性条带,其大小与预期相当,而出发菌株无法扩增出条带。
引物对Ⅱ:KAN-U/PGK1P-D进行中游定点PCR验证,PCR产物经0.8%的琼脂糖凝胶电泳,可看到一条大小约3092 bp左右的特异性条带,其大小与预期相当,而出发菌株无法扩增出条带。
引物对Ⅲ:PGK1T-U/Hxt16验-D进行下游定点PCR验证,PCR产物经0.8%的琼脂糖凝胶电泳,可看到一条大小约3553 bp左右的特异性条带,其大小与预期相当,而出发菌株无法扩增出条带。说明片段已经成功连接并整合到酿酒酵母单倍体基因组中的HXT16位点,得到FF1F2和OF1F2突变株。结果如图5所示。

图5 突变株α5F-FAS1,2的验证Fig.5 The verification of transformants α5F-FAS1,2
2.2 出发菌株与突变菌株的发酵性能比较
按照方法 1.2.5以出发菌株α5为对照菌株与α5F-FAS1、FF1F2、α5O-FAS1、OF1F2同时进行玉米原料发酵,发酵结束后测定各菌株的基本发酵性能。
由表2可知,与出发菌株α5相比,敲除FAA1同时过表达FAS1基因后突变菌和敲除OPI1同时过表达FAS1基因后突变菌的主要发酵性能总CO2失重、酒精度和残糖没有明显的影响。在过表达FAS1基因的基础上过表达FAS2的主要发酵性能也未受明显影响。
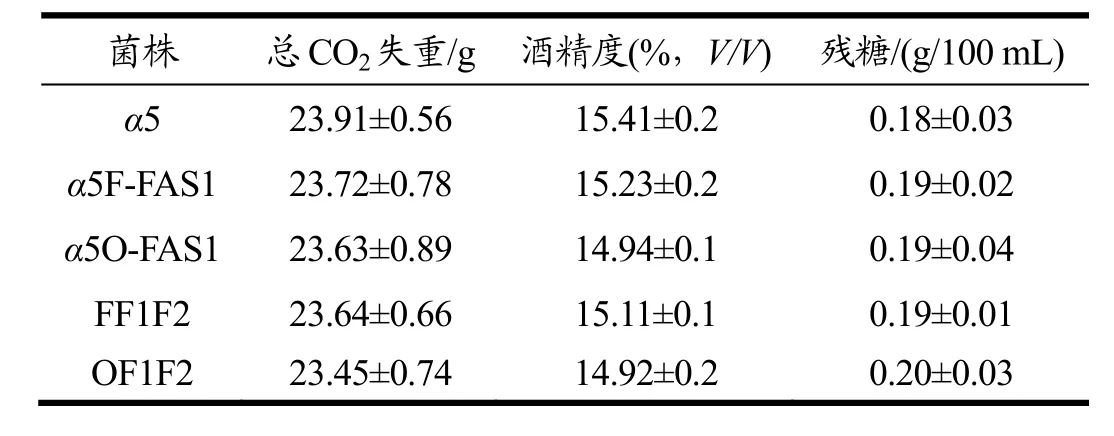
表2 突变株的发酵性能比较Table 2 The comparison of the fermentation performance of mutants
2.3 共表达FAS1,FAS2基因对中链脂肪酸乙酯生成量的影响
发酵结束后,对发酵醪进行蒸馏,获得的酒样经过顶空萃取和吸附后,用GC-MS检测分析酒样中己酸乙酯等脂肪酸乙酯生成量。
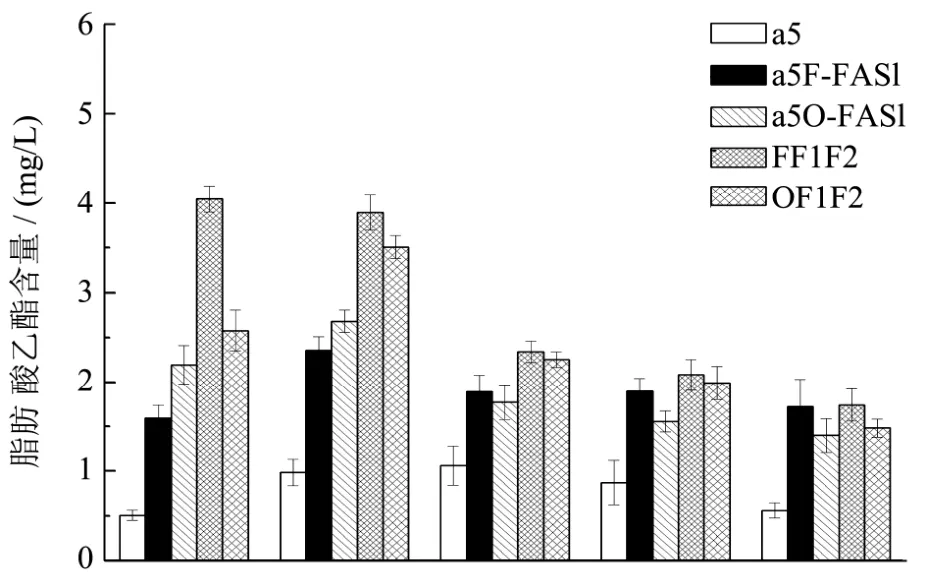
图6 出发菌株和突变菌株中链脂肪酸乙酯的生成量比较Fig.6 The comparison of medium chain fatty acid ethyl esters production between original strain and recombinant strains
如图6所示,相比较于α5F-FAS1菌株,在此基础上共表达FAS2的菌株的FF1F2的己酸乙酯、辛酸乙酯、癸酸乙酯分别提升了 154.31%,65.22%和23.53%,但十二酸乙酯、十四酸乙酯基本不变。与此结果类似:相比较于α5O-FAS1菌株,在此基础上共表达FAS2的菌株的OF1F2的己酸乙酯、辛酸乙酯、癸酸乙酯、十二酸乙酯分别提升了17.34%,30.71%,27.12%和28.13%,但十四酸乙酯基本不变。结果显示共表达FAS1和FAS2基因可以更进一步的提升中链脂肪酸乙酯的产量,特别是己酸乙酯、辛酸乙酯、癸酸乙酯的产量,最终的最高产量分别达到4.049 mg/L,3.89 mg/L,2.34 mg/L。
实验结果与 Furukawa等在清酒酵母中过表达FAS1可以提高己酸乙酯,并且共表达FAS1和FAS2可以使己酸乙酯的产量达到最大的结论一致[16]。由于脂肪酸合成酶是由两个亚基组成,它们对于脂肪酸合成酶的酶活力都有贡献,并且编码β亚基的基因FAS1其主要作用,其可以在RNA水平上调节编码α亚基的基因FAS2的表达,从而提高脂肪酸合成酶的酶活力。并且同时共表达FAS1和FAS2使得α亚基和β亚基以等摩尔的形式存在[17],从而使脂肪酸合成酶达到最大的酶活力,进一步提升了中链脂肪酸乙酯的含量。
2.4 共表达FAS1,FAS2基因对乙酸乙酯生成量的影响
本研究还发现,过表达FAS1可以提高乙酸乙酯的生成量。突变株的乙酸乙酯及乙酸的生成量结果如表3。
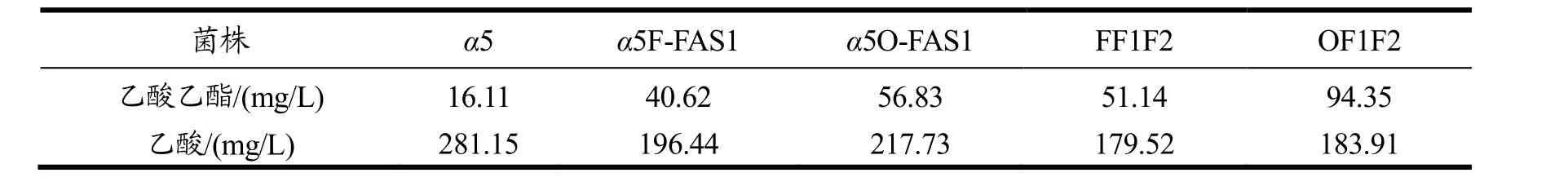
表3 过表达FAS1和共表达FAS1,2的乙酸乙酯和乙酸产量Table 3 The production of Acetate and Ethyl ester between Co-overexpression of FAS1 and FAS2 strains and overexpression of FAS1 strains
从表3可以看出,过表达FAS1可以提高乙酸乙酯的含量同时降低乙酸的含量。而共表达 FAS1,2会进一步提高乙酸乙酯并降低乙酸的含量。并且敲除Opi1过表达FAS1的菌株α5O-FAS1比敲除FAA1过表达FAS1的菌株α5F-FAS1产生的乙酸乙酯更高,同样共表达FAS1,2的菌株OF1F2比FF1F2产生的乙酸乙酯更高。说明不同整合位点对乙酸乙酯的生成量也有影响。

图7 酿酒酵母细胞质acetyl-CoA的代谢途径Fig.7 The metabolic pathway of acetyl-CoA in cytoplasm in S.cerevisiae
图7是酿酒酵母细胞质中乙酰CoA的代谢途径,由于在细胞质中乙酰 CoA一部分在醇乙酰基转移酶Atf1p和Atf2p催化下形成乙酸乙酯,另一部分通过脂肪酸合成途径形成脂肪酸乙酯,因此实际上脂肪酸合成途径和乙酸乙酯合成途径存在相互竞争底物乙酰CoA的情况,当过表达FAS基因后,理论上乙酸乙酯的生成量应该降低。因此表3的结果似乎与理论不符。
由于过表达FAS1导致了乙酸的降低,癌症细胞的背景与此现象类似。相比较于正常细胞,癌细胞的脂肪酸合成能力变强,同时大部分癌细胞存在于低氧低营养的恶劣环境中,许多研究学者都发现癌细胞通过ACSS基因的上调,从而利用乙酸维持癌细胞的存活[18,19]。猜测乙酸乙酯升高的第一种原因可能是过表达脂肪酸合成酶基因使乙酰 CoA的上游途径基因ACS1或ACS2基因上调。另一方面由于乙酸乙酯主要是由醇乙酰基转移酶Atf1p催化,并且ATF1基因会受到氧气,氮信号,不饱和脂肪酸等的调控[20,21]。因此猜测乙酸乙酯升高的第二种原因是过表达脂肪酸合成酶基因可能使乙酸乙酯的调控基因ATF1上调。
为了探究本现象,以出发菌株α5和突变株α5O-FAS1进行玉米原料发酵,发酵培养48 h取菌体提RNA进行RT-PCR。
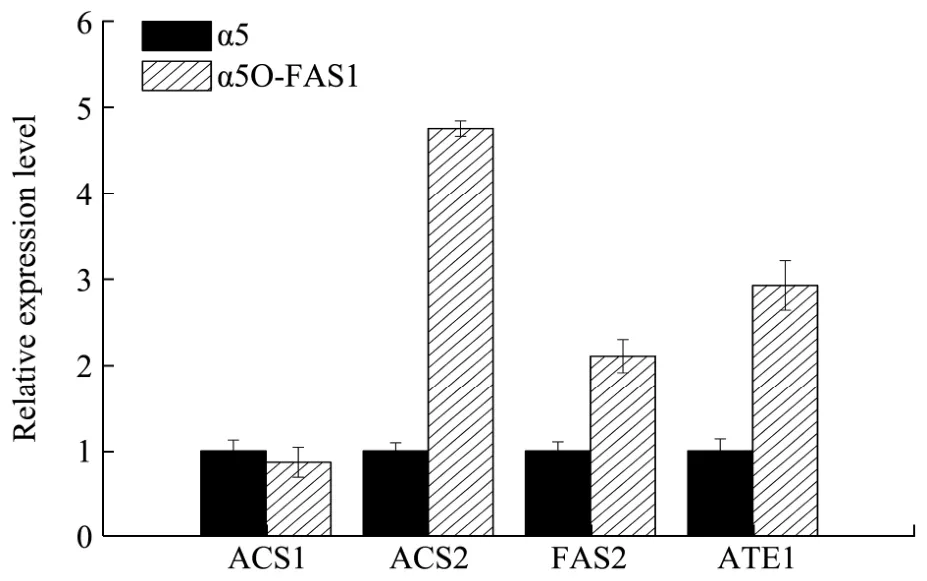
图8 α5和α5O-FAS1中ACS1,ACS2,FAS2,ATF1的基因表达量Fig.8 Determination of ACS1, ACS2, FAS2, ATF1 gene expression levels in α5 and α5O-FAS1
如图8,FAS1基因过表达并未影响ACS1基因的表达量,但会提高ACS2的和ATF1基因的表达量,分别提高了4.75倍和2.93倍,同时也使FAS2基因表达量提高了2.11倍。因此过表达FAS1导致乙酸乙酯的升高一方面可能是由于ACS2基因的表达量上调导致的,另一方面也可能是由于ATF1基因的表达量上调导致的。
一方面为了进一步确定乙酸乙酯的上升是由于哪一种原因造成的,另一方面为了探索不同整合位点导致乙酸乙酯提升程度不同的原因,本研究以α5,α5F-FAS1,α5O-FAS1为出发菌株,同时过表达ATF1基因,得到α5-ATF1,FF1-ATF1,OF1-ATF1三株突变株,进行玉米白酒液态发酵。气相测定乙酸乙酯及乙酸产量如表4。同时测定了α5,α5F-FAS1,α5O-FAS1菌株的FAS1和FAS2基因的表达量。

表4 过表达ATF1和共表达FAS1,ATF1的乙酸乙酯和异戊醇产量Table 4 The production of higher alcohols and estersbetween Co-overexpressionof FAS1 and ATF1 strains and overexpressionof ATF1 strains
表 4结果显示与α5-ATF1相比,FF1-ATF1和OF1-ATF1的乙酸乙酯产量分别为277.1 mg/L和73.7 mg/L,出现逐渐递减的现象。假如脂肪酸合成途径的强化导致乙酸乙酯的升高是ACS2基因的表达量上调导致的,那么过表达 ATF1基因后,菌株 FF1-ATF1和OF1-ATF1生成的乙酸乙酯量应该比α5-ATF1菌株的高。此结果可以说明脂肪酸合成途径的强化导致乙酸乙酯的升高并不是ACS2基因的表达量导致的,而是由于ATF1基因的表达量上调造成的。

图9 α5,α5F-FAS1和α5O-FAS1中FAS1,FAS2的基因表达量Fig.9 Determination of FAS1 and FAS2 gene expression levels in α5, α5F-FAS1 and α5O-FAS1
图9显示整合Opi1过表达FAS1的菌株α5O-FAS1比整合FAA1过表达FAS1的菌株α5F-FAS1的FAS2的基因表达量更高。该结论与表3-2所出现的共表达FAS1和FAS2的菌株比单独过表达FAS1产生更多的乙酸乙酯相符合。结果说明菌株α5O-FAS1比菌株α5F-FAS1产生的乙酸乙酯更高,是由于Opi1基因是脂肪酸合成途径的负调控基因[22],其敲除强化了脂肪酸合成途径导致的。
3 结论
3.1 本研究以酿酒酵母AY15的单倍体α5基因组为模板,PCR扩增得到编码α亚基的FAS2基因,经醋酸锂转化和G418抗性筛选鉴定获得共表达FAS1和FAS2基因的突变株α5F-FAS1,2和α5O-FAS1,2。经玉米原料发酵后,实验结果显示突变株的生长速度、发酵速度、酒精度等基本发酵性能都没有明显变化。相比较于单独过表达FAS1基因,共表达FAS1和FAS2基因可以更进一步的提升中链脂肪酸乙酯的生成量,最终α5F-FAS1,2的己酸乙酯、辛酸乙酯、癸酸乙酯分别提升了 154.31%,65.22%和 23.53%,同时α5F-FAS1,2的己酸乙酯、辛酸乙酯、癸酸乙酯、十二酸乙酯分别提升了 17.34%,30.71%,27.12%和28.13%。
3.2 本研究发现过表达脂肪酸合成酶的编码基因可以提高乙酸乙酯的生成量。通过RT-PCR测定发现脂肪酸合成酶编码基因的过表达可以使ACS2和ATF1基因上调,不影响ACS1基因的表达。而与单独过表达ATF1基因的菌株相比,共表达FAS1和ATF1的菌株的乙酸乙酯逐渐降低。因此过表达FAS1导致的乙酸乙酯生成量上升的现象主要是由于过表达脂肪酸合成酶编码基因使得醇酰基转移酶的编码基因ATF1的表达量上升造成的。但ATF1的表达量上调的原因是否是通过某些中间调节因子造成尚不清楚,需要在后续在调控机理上进行更深入的研究。
3.3 本研究初步探讨了脂肪酸合成酶复合体对酿酒酵母中链脂肪酸乙酯生成的影响,为后续研究中链脂肪酸乙酯合成的调控机制奠定了一定的理论基础。

