猪源金黄色葡萄球菌lsa(E)基因的流行性研究
谷立慧,周文渊,王丽,闫鹤
(1.华南农业大学食品学院,广东广州 510642)(2.华南理工大学食品科学与工程学院,广东广州 510640)
金黄色葡萄球菌(Staphylococcus aureus,SA)广泛分布于自然界,也存在于人和动物的体表、鼻腔和消化道等部位,是一类共生的人畜共患条件致病菌,能够引起人和动物局部化脓性感染、肺炎、心包炎和脓包败血症等,是全球公认的医院感染病原菌的代表菌株[1,2]。在我国,20~25%的细菌性食物中毒事件是由金黄色葡萄球菌引起的,是仅次于沙门氏菌和副溶血弧菌的第三大致病菌[3,4]。在兽医临床上可广泛引起疾病,降低动物生产力,危害家畜健康。由于畜牧业发展的集约化和规模化,抗生素在我国养殖业中被大量使用,以促进生长、预防及治疗疾病[5]。金葡菌的适应性极强,能够对新投入使用的抗生素迅速产生耐药性[6],严重的耐药问题为其防控与治疗带来了极大挑战。自2005年首例猪源耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)感染人的病例在荷兰报道后[7],动物源金葡菌开始备受关注,它不仅影响畜禽动物的安全防治,甚至可能通过环境-人、食物链-人以及人-人等多种方式进行传播,威胁人类健康。
lsa(E)基因,属于ABC转运基因,编码ABC转运蛋白,能同时介导三类不同化学结构的抗菌药物产生耐药(林克胺类、截短侧耳素类和链阳菌素A类)[8],这三类抗菌药物均为人医和兽医临床上非常重要的抗感染药物。2013年,多重耐药基因lsa(E)首次在欧洲人源MRSA和MSSA中被检出[8],同年,Li等人在猪源MRSA中检测到lsa(E)基因,并通过序列分析证实该基因位于多重耐药基因簇中[9]。随后,该基因在多种细菌中被发现,包括:粪肠球菌[10]、屎肠球菌[10]、表皮葡萄球菌[11]、无乳链球菌[12]、猪丹毒杆菌[13]等。动物源 lsa(E)基因及其多重耐药基因簇在不同菌株间进行的水平传播,甚至在动物、食品和人之间的交互传播扩散,对兽医临床和人医临床造成严重威胁。
目前,国内对于 lsa(E)基因及其耐药基因簇在动物源金黄色葡萄球菌中的流行特点及传播方式研究少有报道。因此,本研究以厦门三大生猪养殖场中分离的金黄色葡萄球菌为研究对象,检测 lsa(E)基因及其耐药基因簇的流行分布情况,分析 lsa(E)基因簇在猪源金葡菌中的传播方式,调查 lsa(E)基因阳性金葡菌对临床抗菌药物的耐药性,从而为我国开展动物源金葡菌的风险评估以及降低多重耐药菌随食品链的传播提供科学依据。
1 材料与方法
1.1 菌株来源
2014年从中国厦门三个大型生猪养殖场共采集样本168份,其中环境样本71份,猪鼻拭子97份,样品于4 ℃保存,并参照国标GB 4789.10-2016的方法进行金黄色葡萄球菌的分离鉴定。其中22株金葡菌分离自猪鼻拭子,另外7株菌分离自环境样本。
1.2 主要仪器与设备
GeneAmp PCR system 2700,美国 Applied Biosystems公司;Gel Doc EQ凝胶成像系统、核酸电泳仪,美国BIO-RAD公司;恒温培养箱,德国Binder公司。超净工作台,美国Baker公司;超纯水系统,美国Millipore公司;高压灭菌锅、-80 ℃冰箱,日本三洋公司;电子天平,上海梅特勒托利多仪器有限公司。
1.3 培养基和主要试剂
脑心浸出液肉汤,购自广州环凯微生物科技有限公司;细菌基因组DNA快速提取试剂盒,购自北京博迈德生物技术有限公司;rTaq酶(5 U/μL)、dNTP Mixture、10×PCR Buffer,购自日本 TaKaRa公司;5×Loading Buffer、DL2000 DNA marker、琼脂糖,购自艾迪生物科技有限公司;引物,由英潍捷基(上海)贸易有限公司合成;药敏纸片,购自杭州微生物试剂有限公司。
1.4 基因检测
根据细菌基因组DNA快速提取试剂盒说明书进行DNA的提取。将提取的细菌总DNA作为模板,采用PCR方法检测lsa(E)基因,以NCBI数据库中公布的猪源MRSA PV7037(JX560992)的lsa(E)基因环境序列为参考(图1)。
设计引物,对 lsa(E)基因阳性菌株,进行overlapping PCR,基因引物及退火温度见下表1。据此检测多重耐药基因簇的流行情况。PCR总反应体系为 25 μL,扩增条件:94 ℃,5 min;94 ℃,1 min、退火温度(表 1),1 min、72 ℃,2 min,30 个循环;72 ℃,7 min。扩增产物经1%琼脂糖凝胶电泳后用凝胶成像系统观察拍照并分析,将阳性产物送往上海美吉生物医药科技有限公司进行测序,对测序结果进行 NCBI序列比对分析。
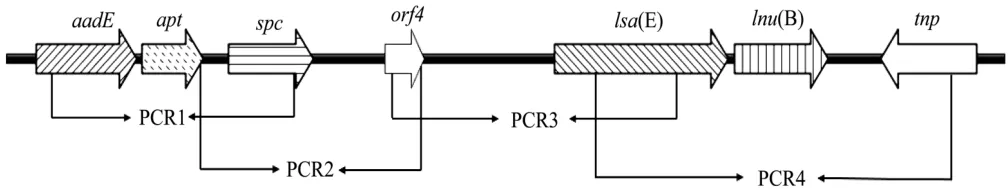
图1 lsa(E)的基因环境Fig.1 Genetic environment of the lsa(E) gene
1.5 抗菌药物敏感试验
采用CLSI推荐的纸片扩散法(Kirby-Bauer,K-B)进行抗生素药物敏感性试验,结果按照CLSI(2012)标准进行结果判断。测试的抗生素有:青霉素、苯唑西林、头孢西丁、头孢噻吩、四环素、环丙沙星、左氧氟沙星、莫西沙星、加替沙星、喹奴普汀/达福普汀、利奈唑胺、复方新诺明、克拉霉素、克林霉素、庆大霉素。质控菌株为金黄色葡萄球菌ATCC29213,由本实验室保存。

表1 lsa(E)基因和overlapping PCR引物Table 1 The Primers for lsa(E) gene and overlapping PCR
2 结果与讨论
2.1 lsa(E)基因检测
2013年,Sarah等[8]人首次在人源MRSA和MSSA中发现并定义lsa(E)基因,同年,Li等人在江苏及浙江猪场中分离得到的猪源 MRSA中检测到 lsa(E)基因,检出率为22.9%(16/70)[9]。2014年Yan等[14]对中国哈尔滨两个屠宰场的猪源金葡菌进行 lsa(E)基因筛查,检测率为22.0%(44/200)。
在本研究中,对于厦门猪场分离得到的金葡菌中lsa(E)基因的检出率为 100.0%(29/29),表明近两年lsa(E)基因在我国猪源金葡中广泛传播,该结果与李君[15]对上海、宁夏、河南及山东的猪源MRSA的lsa(E)基因的检出率相同。lsa(E)基因在越来越多细菌中的发现及检出率的显著提高表明可能存在可移动原件促使该基因广泛传播,从而给临床抗感染治疗带来更大困难,应该引起高度重视。
2.2 lsa(E)多重耐药基因簇
深入研究发现,lsa(E)基因主要存在于多重耐药基因簇中:aadE-spc-lsa(E)-lnu(B)-tnp,该基因簇通常含有多个耐药基因,分别为介导氨基糖苷类抗生素耐药的基因aadE和spc,林可酰胺-截短侧耳素-链阳菌素A类的耐药基因 lsa(E),介导林可酰胺类耐药的基因lnu(B)以及转座酶tnp[10,11,15]。运用overlapping PCR的方法对 lsa(E)阳性菌株进行基因簇筛查,结果显示,96.6% (28/29)的菌株均含有多重耐药基因簇中的aadE-spc-lsa(E)-lnu(B)-tnp区域,仅有一株菌含有lsa(E)基因,但不含该基因簇,4个overlapping PCR反应均为阴性,该菌株分离自养殖场的地面环境中,耐药谱为PEN-TET-SXT-CLI-CIP-LEV-MXF,且对庆大霉素和左氧氟沙星中介耐药,而对苯唑西林、头孢噻吩、头孢西丁、克拉霉素、喹奴普汀-达福普汀和利奈唑胺敏感。
aadE-spc-lsa(E)-lnu(B)-tnp基因簇较为保守,在目前已经报道的研究中,除猪丹毒杆菌外,该基因簇在其他多种病原菌中稳定存在[10~12,15],可能是由于该序列中不含插入序列,因此不易发生结构变化,同时该基因簇可能通过质粒实现种内及种间交换,从而加剧不同种属间耐药基因的相互传播。而使用该基因簇介导的氨基糖苷类、林可酰胺、截短侧耳素、链阳菌素A类抗生素中的任意一种均可对该基因簇产生选择性压力,促进其传播扩散,因此,需加强对含有多重耐药基因簇菌株的监控。
2.3 lsa(E)基因阳性菌株对抗生素的耐药情况
对分离出的29株lsa(E)基因阳性的金葡菌进行药敏实验,耐药情况见表 2。大环内酯类、林可胺类和磺胺类抗生素是养殖场常用抗生素,也是临床常用的抗葡萄球菌感染药物,本研究中,29株lsa(E)基因阳性金葡菌对克拉霉素、克林霉素和复方新诺明的耐药率分别为93.1%、100.0%和100.0%。其次,对庆大霉素、四环素、环丙沙星及莫西沙星的耐药率均大于70%,没有发现有对苯唑西林、喹奴普汀/达福普汀和利奈唑胺耐药的金葡菌。
Cui等[16]人对陕西、河北、四川、湖北地区分离的猪源MRSA进行了抗生素敏感性检测,结果显示,分离获得的菌株对环丙沙星、克林霉素、头孢西丁、庆大霉素及四环素普遍耐药,未发现有对利奈唑胺耐药的菌株。
李君等[15]人研究表明上海、宁夏、河南及山东的猪源lsa(E)基因阳性MRSA主要对四环素(99.6%)、红霉素(97.0%)、喹奴普汀/达福普汀(97.0%)以及庆大霉素(80.4%)呈现出较高耐药,普遍的高耐药应引起我们不断重视。而且,越来越多的研究表明,猪和猪肉可以作为细菌转移的重要载体,通过食物链将养殖场的细菌以及其携带的耐药性向下游的屠宰场、市场传播[17,18],进而对食品安全和人类健康带来了一定严重的威胁。

表2 金黄色葡萄球菌对抗生素的药敏结果Table 2 Drug susceptibility testing of S. aureus isolates
2.4 lsa(E)基因阳性菌株的多重耐药分析
金葡菌对九大类抗生素的多重耐药情况见表 3。定义菌株对三大类及以上抗生素耐药的菌为多重的耐药菌。

表3 金黄色葡萄球菌多重耐药分析Table 3 Multidrug drug resistance analysis for S. aureus isolates
结果表明,养殖场中29株菌均为多重的耐药菌,而且耐七大类抗生素的菌株有22株,占比75.9%,耐药谱主要为PEN-GEN-TET-CLA-SXT-CLI-CIP-MXF。
多重耐药率达到100.0%,与樊润等[19]人对河南省猪源MRSA分离株的多重耐药率相同。另一项研究[20]表明我国河北、陕西、湖北和四川的生猪养殖场或屠宰场金葡菌的主要耐药表型为 CIP-CLI-ERY-FOXGEN-TET-CHL和 CIP-CLI-ERY-FOX-GEN-TET。金葡菌的流行扩散对食品安全和人们健康有着不可估量的潜在威胁,而多重耐药是一个长期存在的问题,药物压力造成细菌的选择性耐药,因此,应不断加大对动物源食品耐药菌的监控,尤其是加强对多重耐药基因和基因簇的监控,降低食物链转移多重耐药基因的风险。
3 结论
3.1 本研究分离的猪源金葡菌中,均含有能介导细菌对林可胺类、截短侧耳素及链阳菌素A类耐药的lsa(E)基因,运用overlapping PCR扩增其多重耐药基因簇:aadE-spc-lsa(E)-lnu(B)-tnp,阳性率为96.6%,仅有一株菌含有 lsa(E)基因,但不含该基因簇。该多重耐药基因簇较为保守,不易发生结构的变化,这是加剧不同种属间耐药基因相互传播的重要原因。
3.2 29株lsa(E)基因阳性的金葡菌对15种药物表现出不同的耐药性。对常用抗生素克拉霉素、克林霉素、复方新诺明、庆大霉素、四环素、环丙沙星及莫西沙星的耐药率均大于70%,耐药情况严峻,没有对苯唑西林、喹奴普汀/达福普汀和利奈唑胺耐药的金葡菌,说明药物压力造成了细菌的选择性耐药。
3.3 29株菌均为多重耐药菌,多重耐药率达到100.0%,耐七大类抗生素的菌株占比75.9%,耐药谱主要为PEN-GEN-TET-CLA-SXT-CLI-CIP-MXF,这对动物和人类临床治疗在抗生素的选择上有一定的指导作用。

