全外显子测序技术在脑胶质瘤精准诊疗中的作用及进展:3例报道
丁骁杰 陈 弟 唐 超,2 姚 瑜,2
(1复旦大学附属华山医院神经外科 上海 200040; 2复旦大学附属华山医院神经外科免疫实验室 上海 201206)
胶质母细胞瘤(glioblastoma,GBM)是成人最常见的原发性恶性脑肿瘤,中位生存期只有15个月左右[1]。目前的标准治疗方法是最大程度手术切除,术后替莫唑胺(temozolomide,TMZ)同步放化疗以及TMZ辅助化疗。组织病理学诊断的GBM可进一步根据基因、分子特征等分组,不同分组的GBM患者预后迥异,可能对治疗的敏感性不同。例如,IDH1/2突变的胶质瘤患者生存期明显优于野生型患者[2];MGMT启动子甲基化患者经过TMZ治疗后获益更大[3]。尽管已有分子标志物被纳入常规GBM的诊疗流程中,但是这些分子检测仅仅针对常见基因(如IDH1/2、MGMT、TERT、1p/19q等),形成的分子亚组过于局限,不能完全符合个体化精准医学的标准,同时可能忽视肿瘤基因异质性[4]。
下一代测序技术(next generation sequencing,NGS)是目前常用的高通量测序方式,根据测序深度的不同,可分为全基因组测序(whole gene sequencing,WGS)、全外显子测序(whole exon sequencing,WES)、目标区域捕获测序等,可以为临床提供客观而又全面的基因信息(包括突变、缺失、拷贝数改变等),从而帮助医师快速地找到潜在的基因靶点并进行靶向治疗。美国TCGA通过多种NGS的测序手段先后发现了ERBB2、NF1、TP53等基因在GBM中的作用,揭示了PI3激酶调节性亚单位基因PIK3R1,并结合临床资料发现了MGMT启动子甲基化与超突变表型之间的关系。通过GBM患者的基因组检测已对GBM的分子病理学及治疗策略有了一定的认识[5-7]。对于初发GBM患者,已报道前神经元型患者对贝伐单抗展现出了一定的生存益处[8]。然而,针对GBM的WES研究在国内外尚处于起步阶段。
本研究对3例GBM患者的肿瘤组织及配对的血液样本进行了WES分析,旨在通过高通量的检测手段对GBM患者进行基因层面的分析,寻找与脑胶质瘤分子生物学特性有关的基因突变。
标本来源选择复旦大学附属华山医院神经外科实施手术治疗且术后病理证实、诊断明确的GBM患者。标本获取通过医院伦理委员会审查(伦理号:2016-400)。进行WES前通过HE染色确认肿瘤含量,并用DNA抽提试剂盒(北京华夏远洋科技有限公司,QIAGEN 69504)进行DNA提取及质检。
WES对3例复发GBM患者的冰冻肿瘤组织、血液配对标本进行WES(北京泛生子生物科技有限公司),测序平台Illumina HiseqX,测序策略PE150,κ试剂盒建库,安捷伦探针捕获。测序深度为N-100X,T-200X。详细流程如下。
数据质控 高通量测序得到的原始图像数据经碱基识别(base calling)转化为原始测序序列(sequenced reads),结果以 FASTQ文件格式存储,其中包含测序序列(reads)的序列信息及其对应的测序质量信息。测序得到的原始数据中会有少量序列包含接头信息、低质量碱基或未检出的碱基,对后续信息分析造成一定干扰。为了保证信息分析质量,通过Trimmomatic-0.33软件对原始数据进行质量控制,将原始序列过滤为高质量测序数据(clean reads)。数据过滤主要包括以下4个方面:(1)截掉序列中含有的接头(adapter)碱基序列;(2)截掉序列开头和尾端中的低质量(质量值低于3)碱基序列;(3)截掉序列开头和尾端中含N(N表示不确定的碱基信息)碱基序列;(4)截取后序列长度小于36 bp则去除整对序列。
数据比对 过滤后的高质量测序数据通过 BWA比对到参考基因组(hg19)得到BAM 格式的最初的比对结果。BAM文件再用 GATK与 Picard进行局部重比对(local realignment)、去重复(duplicate removal)以及碱基质量值重校正(base quality recalibration)等处理,从而得到 BAM 格式的最终比对结果。根据比对结果对参考基因组上的数据进行统计计算,得到比对率、重复率、捕获效率、覆盖度、覆盖深度等统计指标,对数据的有效性进行评估,最终得到的BAM数据文件将被用于进行变异检测。对配对血液标本分别进行种系单个核苷酸变异(single nucleotide variation,SNV)、插入缺失改变(InDel)、拷贝数变异(copy number variation,CNV)的检测(GATK),并以其为对照,对肿瘤组织进行相应的体细胞 SNV的检测、体细胞InDel的检测、体细胞CNV的检测。
变异注释 利用 ANNOVAR、Oncotator (http://www.broadinstitute.org/oncotator)对高质量变异进行结构、功能、多种数据库的注释。具体注释中使用的数据库/方法包括:Gene and protein structure(Refseq 2013-05-09,UCSC)、dbSNP(dbSNP138 UCSC)、1000 Genomes Project(2014年4月发布)、COSMIC(Cosmic Complete Export_v65)。
Sanger测序 通过Sanger测序检测肿瘤组织IDH和TERT启动子的突变情况[9]。其中IDH检测的突变热点为IDH1的132位点和IDH2的172位点[10],TERT启动子则检测C228T(chr5,1,295,228)和C250T(chr5,1,295,250)[11]。
测序结果 由于IDH1在原发GBM中突变率极少,故本试验选取了3例IDH野生型GBM患者进行WES,以确保肿瘤发生早期基因突变事件的相对一致性。3例患者均为复发GBM,原发肿瘤均接受了手术切除联合后续同步放化疗,且在接受复发肿瘤切除术后均接受了传统化疗药物的治疗。2例患者出现肿瘤进展,1例未进展(表1)。
配对的患者血样标本同时进行测序以去除种系多样性。测序数据经过质控、比对等筛选后共有245处突变,包括237处SNV和9处InDel。其中,SNV包括214处非同义SNV(90.3%)、14处stopgain(5.9%)、6处可变剪切(2.5%)、3处未知SNV(1.3%);InDel包括3处非移码缺失(33.3%)、1处移码插入(11.1%)、5处移码缺失(55.6%)。与在其他肿瘤中发现的结果类似[12],共有172处G:C突变为A:T;65处A:T突变为G:C。3例患者标本测序结果显示,仅MUC16基因突变同时发生于不同肿瘤标本中,而以下基因突变在同一例标本中存在重叠现象:FBN3、ZCCHC2、TPX2、NOTCH1(图1)。为了明确此3例标本的IDH/TERTp分子分型[9,13],我们对其进行了Sanger测序,结果显示3例患者肿瘤标本测序结果均为IDHwt/TERTpmut。
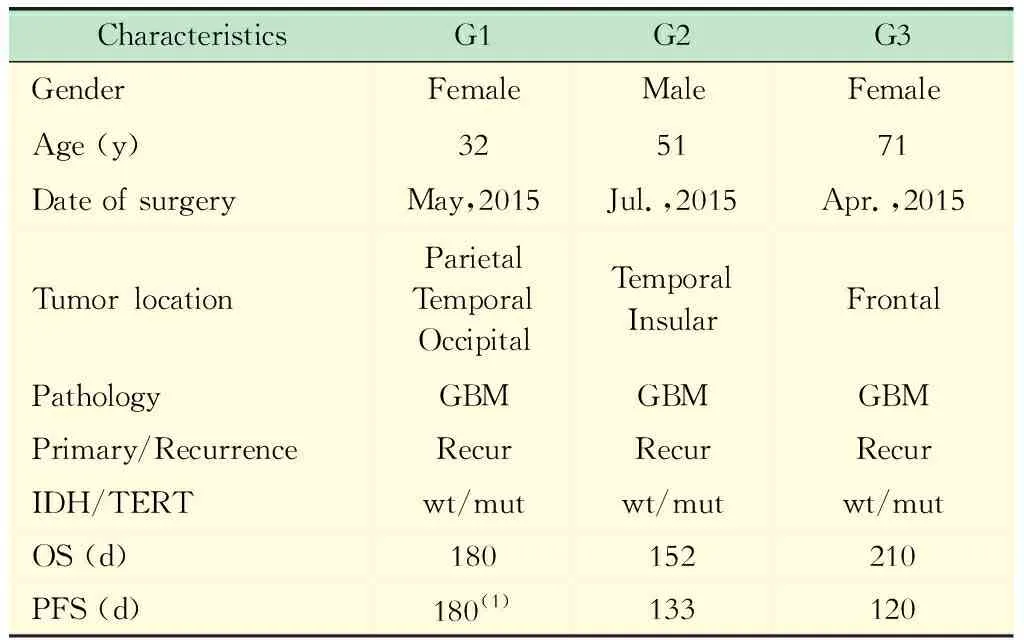
表1 3例GBM患者信息Tab 1 Characteristics of 3 cases with GBM
(1)Patient G1 was not disease progression yet.OS:Overall survival time;PFS:Progression-free survival time.
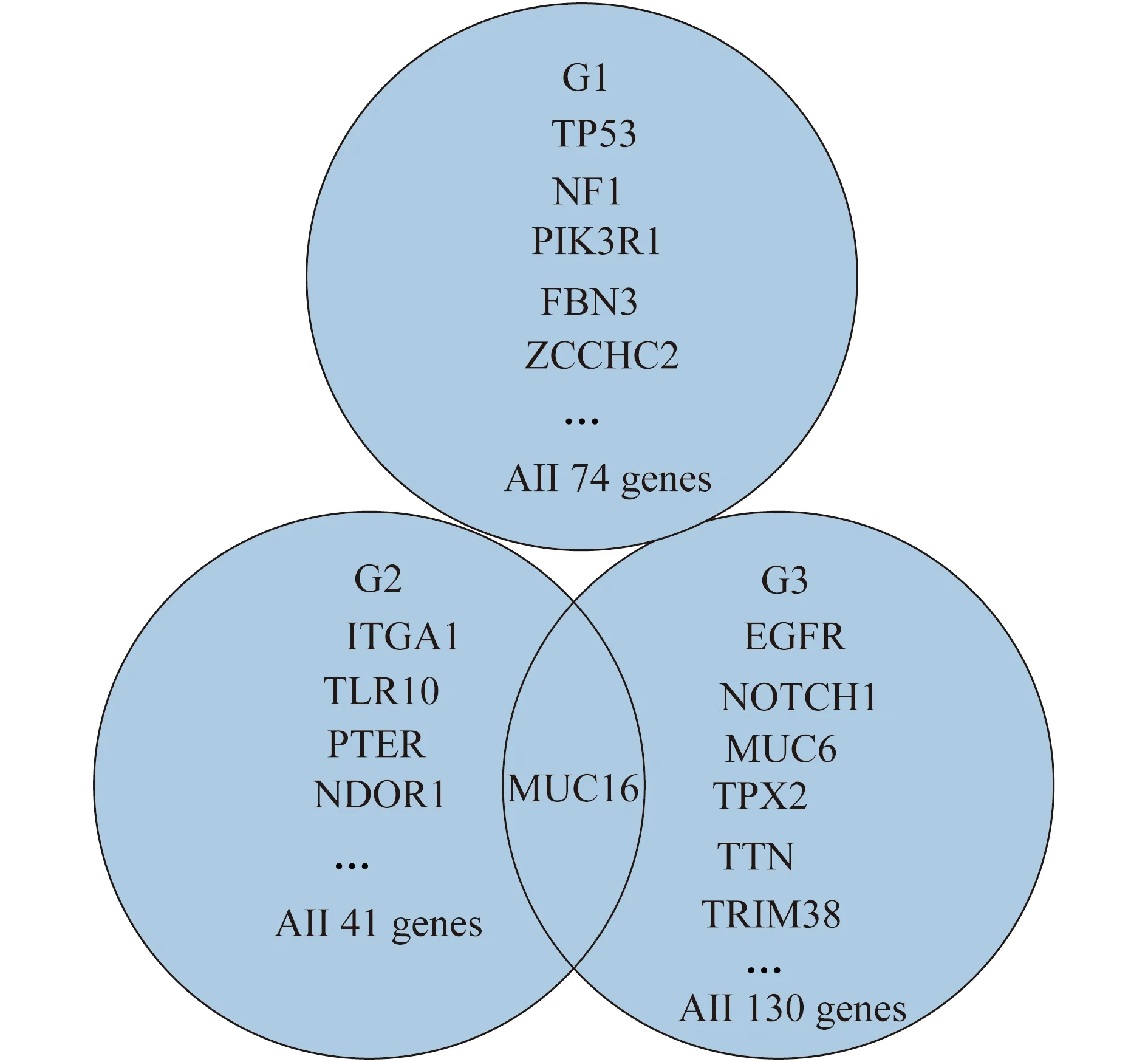
图1 3例GBM患者肿瘤组织WES测序结果示意图Fig 1 The schema of WES results from the tumor tissue of 3 cases with GBM
生物信息学分析:突变功能预测通过美国医学遗传学会(ACMG)推荐的生物信息学预测软件(SIFT、MutationTaster、PolyPhen-2、PROVEAN),对候选突变基因的致病性以及突变后蛋白功能进行分析。对前期分析所得的共有突变基因MUC16进行突变蛋白功能生物学软件分析。因两者基因突变类型不一致(G2:非同义SNV;G3:InDel),我们利用SIFT、MutationTaster、PolyPhen-2和PROVEAN 4个软件对G2的MUC16突变后蛋白质进行分析,结果均为良性(分别为“Tolerant”、“Polymorphism”,“BENIGN”,“Neutral”)。而G3的MUC16突变生物信息预测(MutationTaster)提示有较强的致病性(结果为“disease causing”)。
讨论Killela等[14]的研究表明,IDH/TERT分子分型可将高级别胶质瘤分为预后迥异的4个亚型;而我们团队的回顾性分析亦显示,IDH/TERT分子分型同样适用于较低级别胶质瘤[9],且不同IDH/TERT分子亚型对于传统放化疗的敏感性不同[13]。尽管如此,IDH/TERT分子亚型仍不能达到针对每个患者个体的精准诊疗目的,对GBM的基因组分析仍亟待研究。
通过高通量测序(如WGS、WES等)的方法可以找到更多关键的突变和拷贝数的改变,从而对既有分子病理诊断进行确认并增加分子诊断的特异性,一些经常同时存在的突变可以更有力地证实分子病理的诊断(如CIC突变和1p/19q共缺失;TP53突变和IDH突变、1p/19q完整;TERT启动子、IDH突变和1p/19q共缺失),且EORTC 26951研究显示[15],NGS对基因突变检测的准确性高于传统的FISH检测。该研究还提示,尽管绝大部分1p/19q共缺失的肿瘤同时存在IDH和TERTp突变,但确实存在少数1p/19q共缺失的肿瘤没有IDH或TERTp突变。此外,大部分IDH突变及1p/19q完整的肿瘤具有TP53突变也在该研究中通过NGS得到证实。
分子病理的研究不仅具有预后判断作用,检测肿瘤相关突变可能对患者后续的个体化治疗具有指导作用,但目前这方面的研究尚处起步阶段。RTOG 9402临床试验中,74%的患者具有IDH突变,且IDH突变提示对PCV方案的疗效益处[16];而EORTC 26951则显示,通过Illumina H450芯片检测到的MGMT启动子甲基化能够显著延长接受PCV方案治疗的患者的生存期,而IDH突变不能起到预测PCV方案疗效的作用[17]。在胶质瘤的生物学特点方面,近年来有一些研究应用NGS找到了一些与胶质瘤发生、发展等有关的基因突变。因此,在外显子测序技术问世并广泛应用于癌症相关研究后,越来越多的基因改变被发现,如何对测序结果进行充分分析,寻找到与肿瘤的诊治密切相关的基因改变则尤为重要。
我们的研究团队先前已对IDH/TERT分子分型较低级别胶质瘤的预后预测作用以及不同IDH/TERT分子分型GBM患者对传统放化疗效果进行了一定研究[9,13]。本研究旨在通过高通量的方式对GBM的基因变异情况有所了解。初步结果显示,患者复发后的组织学病理均为GBM,且分子病理结果均为IDHwt/TERTpmut,其他基因的突变情况存在很大差异。而MUC16作为仅有的一处共有突变,可能是与GBM复发或进展有关的癌基因。
MUC16基因编码的MUC16蛋白是一种高分子质量糖蛋白,表达于人体多处表皮细胞表面,以保护外界对细胞的损伤。MUC16的细胞外部分可用于多种肿瘤的诊断和监测(即CA125),如卵巢癌[18]。MUC16在肿瘤发生中的作用机制尚未被阐明。MUC16在多种疾病中存在表达异常,如溃疡性结肠炎[19]、肺结核[20]、干燥综合征[21]及癌症(卵巢癌、乳腺癌、胰腺癌)[22-24]。约90%的卵巢癌患者MUC16表达明显升高,CA125升高还提示卵巢癌患者的复发可能[25]。目前尚无报道MUC16在脑胶质瘤中存在突变或异常表达情况。本研究发现有2例患者均有MUC16突变,通过ESP及dbSNP等数据库对已知变异比对查询,表明MUC16的两种突变类型在这之前均未被发现。虽然2例患者MUC16基因突变的生物信息预测结果存在不同,但这2例患者均已出现肿瘤复发,PFS相对较短,故后期需测定其mRNA转录水平和蛋白质表达水平,以进一步探讨MUC16基因突变的临床意义。此外,本研究还在测序中发现了一些存在重叠区域的基因突变,包括FBN3、ZCCHC2、TPX2、NOTCH1。其中,NOTCH1和ZCCHC2基因已在TCGA针对较低级别胶质瘤和GBM的WGS中得到证实,而FBN3、ZCCHC2、TPX2则尚未证实其和胶质瘤的关系。
综上所述,MUC16突变存在于复发GBMA患者中,可能与肿瘤的发生发展或复发有关,有待于样本量的扩大及进一步的数据分析和验证,从而帮助我们深入了解GBM的生物学特性。

