EGCG对血小板源性生长因子-BB诱导的大鼠血管平滑肌细胞增殖和迁移的影响
邓 颖 史伟浩 童进东 王铁平 乔正东 余 波
(1复旦大学附属浦东医院血管外科,3科创中心 上海 201399; 2复旦大学附属华山医院普外科 上海 200040)
血管内膜增生是血管重建术(如球囊扩张血管成形术、支架植入术、血管移植等)后常见且严重的并发症之一,常导致手术失败。探索有效抑制血管内膜增生的方法是解决问题的关键。表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是一种绿茶提取物,近年来国内外学者对EGCG的作用机制进行了大量的研究,结果显示EGCG具有抗炎症反应、抗血管动脉粥样硬化以及有效抑制肿瘤细胞侵袭和增殖等作用[1]。Lee等[2]研究发现EGCG能强有效地抑制血小板源性生长因子-BB (platelet-derived growth factor BB,PDGF-BB)刺激诱导的血管平滑肌细胞(vascular smooth muscle cell,VSMC)的有丝分裂。Orozco-Sevilla等[3]研究发现EGCG可以有效地阻止大鼠颈动脉损伤后的内膜增生。然而,对于EGCG抑制VSMC增殖和迁移的具体机制目前尚不明确。本研究拟观察EGCG对PDGF-BB诱导的VSMC增殖和迁移的影响,并探索其可能的机制。
材 料 和 方 法
试剂与仪器DAPI(上海碧云天公司),多聚甲醛(国药集团),胰蛋白酶、FBS、3%戊巴比妥钠、DMEM(美国Gibco公司),青霉素-链霉素溶液(美国Sigma公司),α-球蛋白单克隆抗体(美国Dako Cytomation公司),山羊抗鼠IgG (美国Protein Tech Group公司),光学显微镜(德国Leica公司),SD大鼠(上海斯莱克动物公司),RTCAxCELLigence细胞功能分析仪DP系统,增殖实验板E-Plate16,迁移实验板CIM,CIM板夹具,37 ℃、5%CO2培养箱(德国Eppendorf公司),PDGF-BB(以色列ProSpec-Tany TechnoGene公司),EGCG(美国ApexBio公司),α-氰基-(3,4-羟基)N-苄苯乙烯胺(AG490,美国Med Chem Express公司),Western blot及IP细胞裂解液(上海威奥生物科技有限公司)。抗体Jak2,Stat3,P- Stat3,Cyclin D1及二抗,HRP抗体(美国CST公司),ECL显影液(美国Advansta公司),Omega Lum G凝胶成像系统(Omega Lum G,美国Aplegen公司)。
大鼠胸主动脉原代VSMC的提取与鉴定选取80~100 g雄性SD大鼠(清洁级),贴块法分离培养胸主动脉中膜VSMC于10%FBS的DMEM培养基中。待细胞生长后,用0.25%胰蛋白酶消化传代,传至3代进行细胞免疫荧光染色鉴定。
检测EGCG对PDGF-BB诱导VSMC增殖的影响于实验前1天饥饿细胞12 h,设置对照组和实验组:对照组,PDGF-BB 10ng/mL,PDGF-BB 10 ng/mL+EGCG 10 μmol/L,PDGF-BB 10ng/mL+EGCG 50 μmol/L,PDGF-BB 10 ng/mL+EGCG 100 μmol/L,PDGF-BB 10 ng/mL+AG490 50 μmol/L。向E-Plate16的孔中加入50 μL各组溶液,将增殖板E-Plate16放置于细胞功能分析仪(RTCA)自动扫描,检测接触是否良好;开始检测基线,确定所选择的孔接触正常,所有孔的Cell Index低于0.063为正常。取出E-Plate16,每孔中加入100 μL混合均匀的VSMC悬液,使每孔中细胞数目每100 μL含5 000个细胞。将E-Plate16置于超净台中室温放置30 min,放入培养箱中。在系统自动扫描后,开始检测各实验组VSMC增殖曲线。
检测EGCG对PDGF-BB诱导VSMC迁移的影响实验前1天饥饿细胞12 h,对照组和实验组设置同前。CIM板下室的孔中加入165 μL各组PDGF-BB液体后,装配CIM板上室,在上室的孔中加入30 μL无血清培养基。将装配好的CIM板置于37 ℃、5%CO2培养箱中平衡1 h。检测接触是否良好,开始进行基线检测,所有孔的Cell Index低于0.063为正常。在上室的孔中加入100 μL混合均匀的VSMC悬液,使每孔中细胞数目为100 μL含5 000个细胞;置于超净台室温放置30 min,上机检测。
细胞总蛋白提取和Westernblot检测根据增殖及迁移实验结果,设置实验组为:对照组(-),PDGF-BB 10 ng/mL,PDGF-BB 10 ng/mL +EGCG 50 μmol/L,PDGF-BB 10 ng/mL +AG490 50 μmol/L。其中对照组(-)和PDGF-BB 10 ng/mL+AG490 50 μmol/L实验组干预时间为12 h,其他两个实验组干预时间为12 h和24 h。Western blot及IP细胞裂解液冰上裂解细胞,并加入PMSF,使其最终浓度为1 μmol/L。4 ℃条件下,转速13×g,离心10 min后,取上清液。BCA法检测蛋白浓度。取15 μL蛋白质样品上样,进行SDS-PAGE分离,转印至PVDF膜,5%脱脂奶粉封闭2 h,加入对应一抗4 ℃孵育过夜,TBST清洗3次,1次10 min,加入二抗于室温下孵育2 h,TBST清洗3次,ECL显影液在凝胶成像系统显影。
统计学分析采用SPSS 13.0统计软件对结果进行分析,每项实验均重复3次以上,各组间结果采用One-way ANOVA进行比较,以α=0.05 为检验水准。
结 果
大鼠胸主动脉原代VSMC鉴定细胞免疫化学染色后,显微镜下可见细胞胞质内大量与细胞长轴平行的纤维细丝,颜色为棕黄色,即为平滑肌 α肌动蛋白丝,且核形态卵圆形位置居中(图1)。96%的VSMC肌动蛋白质表达阳性。免疫组化结果证实培养的细胞为VSMC且纯度高,符合本次实验所需细胞条件。

图1 大鼠胸主动脉原代VSMC中α肌动蛋白的免疫化学染色(×200)Fig 1 Immunohistochemistry staining of α-SMA expression in primary VSMCs of thoracic aorta in rats (×200)
EGCG对PDGF-BB诱导VSMC增殖的影响xCELLigence RTCA细胞功能分析仪DP系统检测结果显示(图2):实验中各浓度EGCG持续干预12 h及24 h均能抑制PDGF-BB诱导的VSMC增殖(P<0.001);且50 μmol/L EGCG的抑制能力强于其他两个浓度组(P<0.001);Jak2特异性抑制剂AG490明显抑制PDGF-BB诱导的VSMC增殖(P<0.001);50 μmol/L EGCG的抑制能力强于AG490 (P<0.001)。
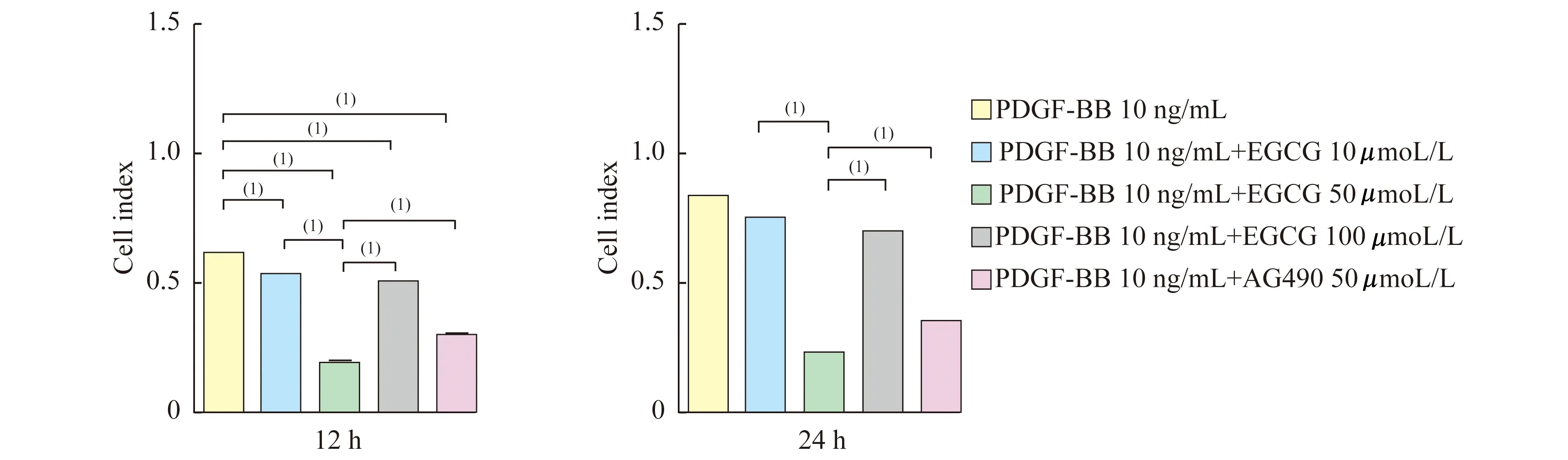
The cell index of EGCG and AG490 on the proliferation activity of VSMCs induced by PDGF-BB.The Cell Index was assessed with RCTA assay at 12 and 24 h after using EGCG and AG490.(1)P<0.001.
图2EGCG和AG490干预后PDGF-BB诱导的VSMC增殖能力下降
Fig2TheabilityofVSMCsproliferationinducedbyPDGF-BBwasdescendedafterthetreatmentofEGCGandAG490
EGCG对PDGF-BB诱导VSMC迁移的影响xCELLigence RTCA细胞功能分析仪DP系统检测结果显示(图3):实验中各浓度EGCG持续干预12 h及16 h均能抑制PDGF-BB诱导的VSMC迁移(P<0.001);且50 μmol/L EGCG的抑制能力强于其他两个浓度组(P<0.001);Jak2特异性抑制剂AG490明显抑制PDGF-BB诱导的VSMC迁移(P<0.001);50 μmol/L EGCG的抑制能力强于AG490 (P<0.001)。

The cell index of EGCG and AG490 on the migration activity of VSMCs induced by PDGF-BB.The cell index was assessed with RCTA assay at 12 and 16 h after using EGCG and AG490.(1)P<0.001.
图3EGCG和AG490干预后PDGF-BB诱导的VSMC迁移能力下降
Fig3TheabilityofVSMCsmigrationinducedbyPDGF-BBwasdescendedafterthetreatmentofEGCGandAG490
EGCG及AG490干预后细胞蛋白质水平Western blot检测结果显示:50 μmol/L EGCG的干预12 h及24 h后均能明显下调PDGF-BB诱导后VSMC的Jak2蛋白质水平(图4B,P<0.001);且EGCG干预12 h较干预24 h的作用更为明显(图4B,P<0.01);AG490能明显下调VSMC的Jak2蛋白质水平(图4B,P<0.001)。EGCG干预12 h能明显下调PDGF-BB诱导后VSMC的Stat3蛋白质水平(P<0.001),且AG490能明显下调VSMC的Stat3蛋白质水平(图4C,P<0.001)。EGCG干预12 h及24 h后均能抑制VSMC的Stat3磷酸化水平,AG490能抑制VSMC的Stat3磷酸化水平(图4D,P<0.001)。EGCG干预12 h及24 h后均能明显下调PDGF-BB诱导后VSMC的Cyclin D1蛋白质水平(P<0.001),而AG490也能下调VSMC的Cyclin D1蛋白质水平,且EGCG下调VSMC的Cyclin D1蛋白质水平较AG490更为明显(图4E,P<0.001)。
讨 论
动脉粥样硬化性疾病已成为目前主要的死亡原因和致残原因,也是心脑血管医学面临的长期而严峻的挑战。目前,对于动脉粥样硬化性疾病治疗措施有开放手术治疗(如颈动脉内膜剥脱术、冠状动脉搭桥术、下肢血管自体及人工血管旁路移植术等)和微创治疗,即血管腔内介入治疗(如颈动脉支架植入术、冠脉球囊扩张血管成形术、冠脉支架植入术、下肢动脉球囊扩张血管成形术及下肢血管支架植入术等),而术后血管内膜增生所致的血管再狭窄是影响手术远期通畅率的主要原因。有文献报道在旁路移植术后1年内再狭窄或闭塞的发生率达30%~40%[4-5],而球囊扩张术后1年内再狭窄的发生率高达55.8%[6-7]。目前研究认为正常血管内膜损伤后VSMC增殖及迁移所致的内膜增生是血管再狭窄的主要原因,新生内膜的过程涉及一系列复杂的信号通路和生物效应,如炎症、血栓形成、VSMC增殖迁移和细胞外基质沉积等[8-11]。
EGCG是一种绿茶提取物,近年来国内外研究者对EGCG的作用机制进行了大量的研究,结果显示EGCG具有抗炎症反应、抗血管动脉粥样硬化以及强有效的抑制肿瘤细胞侵袭和增殖等作用,而这些作用可能涉及多种信号转导通路,包括Jak/Stat、Mapk、PI3K/AKT等信号转导通路[1,12]。而在血管内膜增生的过程中,Jak/Stat信号通路有重要的作用,有研究表明Jak2/Sak3参与调控大鼠颈动脉球囊损伤后的VSMC增殖过程,而Jak2特异性抑制剂AG490能有效地抑制Stat3的磷酸化水平,从而抑制VSMC的增殖以及内膜增生[13]。本研究中以PDGF-BB作为诱导剂刺激VSMC后,明显上调了Jak2、Stat3蛋白质水平以及Stat3磷酸化水平,而Jak2/Stat3信号通路下游的Cyclin D1蛋白质水平也明显上调,而加入AG490后上述蛋白质水平明显被抑制,当利用EGCG干预后上述蛋白质水平也明显下调,且EGCG对于Jak2、Stat3蛋白质水平以及Stat3磷酸化的下调与Jak2特异性抑制剂AG490相比较无明显差异。EGCG对于Cyclin D1蛋白质水平的下调作用要强于AG490,其主要原因可能为EGCG同时抑制了其他信号转导通路,具体机制需进一步深入研究。Orozco-Sevilla等[3]研究发现EGCG能抑制大鼠颈动脉球囊损伤后的内膜增生,本次研究结果与其一致,并提示机制可能是通过抑制Jak2/Stat3信号通路从而抑制VSMC增殖和迁移。
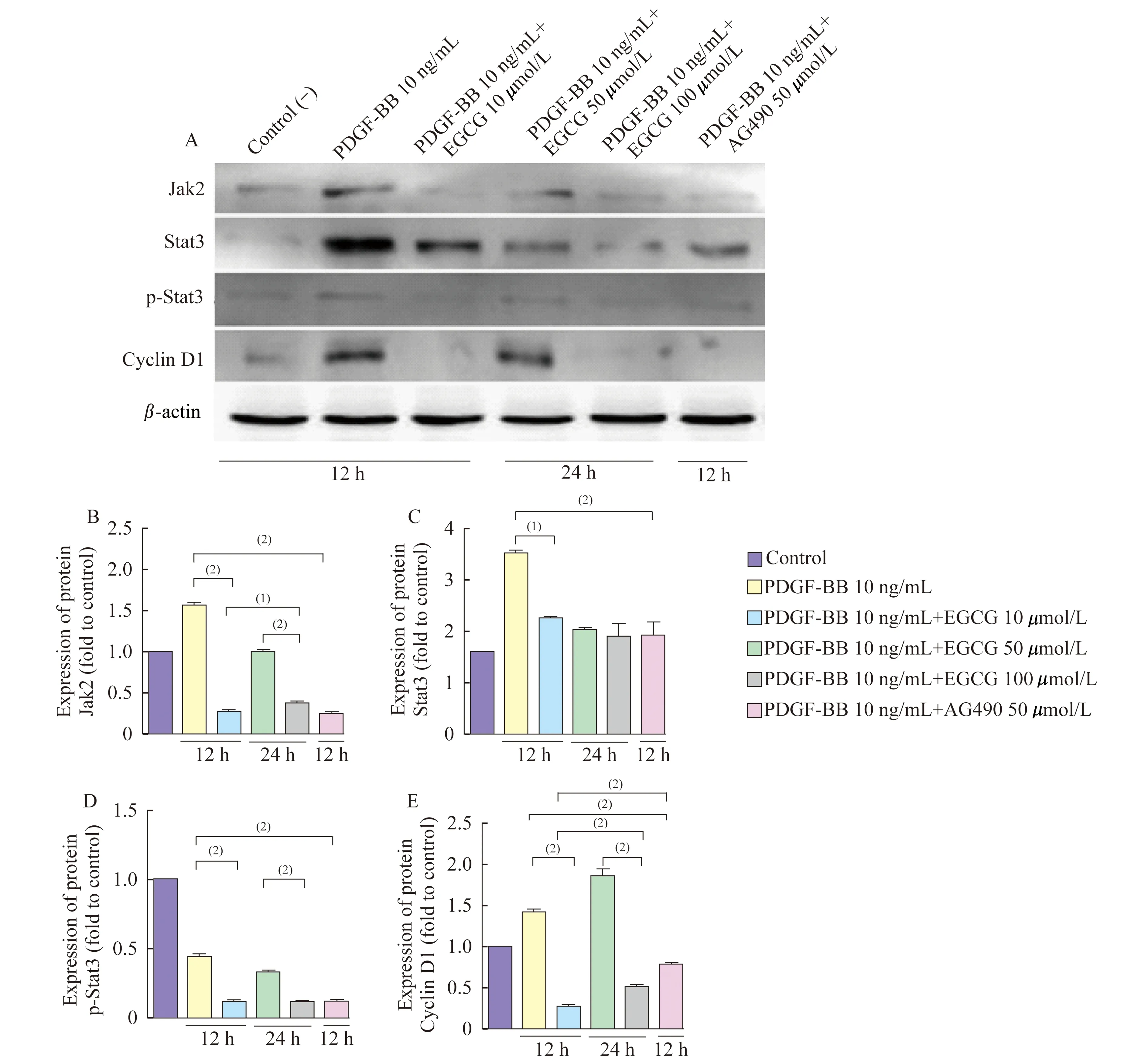
A:Western blot assay was performed to detect the protein expression of Jak2,Stat3,p-Stat3 and Cyclin D1 in VSMCs after the treatment of EGCG and AG490 and β-actin was used as an internal reference.B-E:Expression of protein Jak2,Stat3,p-Stat3 and Cyclin D1 (fold to control).(1)P<0.01.(2)P<0.001.
图4EGCG和AG490干预后VSMC的Jak2,Stat3,Cyclin蛋白质表达以及Stat3蛋白质的磷酸化水平
Fig4TheproteinexpressionsofJak2,Stat3,CyclinD1andp-Stat3,proteinsinVSMCaftertreatmentwithEGCGandAG490
目前,针对抑制血管内膜增生进行了大量的研究,如药物涂层支架的应用在一定程度上抑制了血管内膜增生,但是同时也延缓了血管内皮的修复,增加了迟发性血栓形成的可能性[14-15]。而EGCG作为一种植物提取物,安全性高,de la Torre等[16]利用EGCG加上认知训练治疗青少年唐氏综合征,证明其安全有效。因此,深入研究EGCG抑制血管内膜增生的相关机制,将有助于为治疗血管重建术后再狭窄提供新的方向。
综上所述,本研究结果初步证明EGCG可能通过抑制Jak2/Stat3信号通路从而抑制VSMC细胞增殖和迁移。关于EGCG抑制血管内膜增生的研究大多数还处于细胞水平和动物水平,因此需要对其机制进行深入研究,以期为将来的临床应用打下坚实的理论基础。

