2-甲氧雌二醇对低氧条件下皮肤成纤维细胞自噬水平及纤维化的影响
周 行 刘超凡 鲁静浩 朱鹭冰 李 明
(复旦大学附属中山医院皮肤科 上海 200032)
纤维化是皮肤愈合的重要过程之一,与手术切口愈合、烧伤后修复等密切相关。但过度纤维化不仅影响美观,也降低皮肤保护、分泌和调温等功能[1]。成纤维细胞是纤维化过程的主要效应细胞,不仅自身合成以Ⅰ型胶原(collagen type Ⅰ)为主的细胞外基质,还持续释放结缔组织生长因子(connective tissue growth factor,CTGF)等促纤维化细胞因子,进一步促进胶原合成[2]。纤维化组织内的缺氧环境可能通过促使成纤维细胞分裂增殖、诱发成纤维细胞自噬和启动血管生成等途径导致过度纤维化和疤痕增生[3]。因此,调控低氧条件下成纤维细胞的功能将有助于抑制过度纤维化。
临床上尚无抑制过度纤维化的有效药物,2-甲氧雌二醇(2-methoxyestradiol,2-ME)是人体内雌二醇的天然代谢产物,与雌激素受体的亲和力几乎为零,无雌激素不良反应[4]。我们前期的研究发现,2-ME能显著抑制正常皮肤成纤维细胞的活化,减少胶原合成[5]。本研究进一步模拟皮肤组织内缺氧环境,应用低氧培养诱发正常皮肤成纤维细胞活化,研究2-ME对活化成纤维细胞的自噬水平及纤维化的影响。
材 料 和 方 法
主要试剂与材料胎牛血清、DMEM高糖培养基、胰蛋白酶(美国Gibco公司);二甲基亚砜(美国Sigma公司);Bafilomycin A1、ECL化学发光显影液(美国Millipore公司);2-ME(美国MCE公司);抗人Ⅰ型胶原、CTGF、微管相关蛋白1轻链3 (LC3)B抗体(自噬标志物,英国Abcam公司);抗人低氧诱导因子-1α(hypoxia-inducible factor 1 alpha,HIF-1α)抗体(美国R&D公司);抗人自噬降解标志物P62抗体(美国CST公司);山羊抗兔或小鼠二抗、鸡抗兔荧光二抗(美国Thermo Fish公司);荧光染料4’,6-二脒基-2-苯基吲哚(美国Roche公司)。CO2恒温培养箱和三相细胞培养箱(美国Thermo公司);荧光倒置显微镜(日本Olympus公司)。
原代细胞培养与传代局麻下切取健康志愿者的前臂正常皮肤组织,采用组织块培养法[6]进行皮肤成纤维细胞原代培养。修剪去除皮下组织后,将皮肤剪成1 mm3左右碎块,均匀接种于25 cm2培养瓶内,加入含10%胎牛血清、100 U/mL青霉素、100μg/mL链霉素的DMEM,置于37 ℃、5% CO2培养箱中培养。组织块边缘可见梭形细胞爬出并呈贴壁生长,待梭形细胞长至80%汇合时,以含0.25%胰蛋白酶的平衡液消化细胞并传代,实验选用第3~6代细胞。本实验方案经复旦大学附属中山医院伦理委员会批准,志愿者知情同意。
细胞低氧培养和药物干预将上述成纤维细胞置于CO2恒温培养箱(37 ℃,21% O2,5% CO2)中进行常氧培养或在三相培养箱中(37 ℃,1% O2,5% CO2)进行低氧培养。Bafilomycin A1和2-ME预先使用二甲基亚砜稀释至16μmol/L和30 mmol/L储存,使用前用细胞培养基稀释为干预浓度。
Westernblot使用含苯甲基磺酰氟和磷酸化蛋白酶抑制剂的RIPA裂解液充分裂解细胞后提取总蛋白。经上样、电泳、转膜、封闭后,依次加入一抗Ⅰ型胶原、CTGF、LC3B、HIF-1α、自噬降解标志物P62、内参β-actin及山羊抗兔或小鼠二抗,ECL显影液显影。图像使用Image J软件(由美国国立卫生研究院开发)分析,其中LC3B的图像分析采用文献[7]推荐的方法进行。
免疫荧光成纤维细胞接种在35 mm共聚焦培养皿中,常氧或低氧培养24 h后,以4%多聚甲醛固定10 min,0.1%Triton ×100破膜30 min,5%FBS封闭30 min,加入LC3B一抗置于4 ℃冰箱过夜,再加入鸡抗兔荧光二抗,室温孵育2 h,加入荧光染料后,在荧光倒置显微镜下观察拍照,采用Image J软件进行分析。
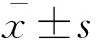
结 果
低氧对人皮肤成纤维细胞的纤维化和自噬相关蛋白质水平的影响成纤维细胞在低氧培养0、6、12、24 h后,HIF-1α水平随低氧时间延长而升高,提示低氧模型成功建立。随着低氧时间的延长,Ⅰ型胶原和CTGF蛋白质水平不断增加,在低氧24 h时Ⅰ型胶原和CTGF水平较低氧0 h显著升高(P<0.05,图1A),呈时间依赖性。自噬标志物LC3Ⅱ水平随着低氧时间的延长而逐渐升高,而自噬降解标志物P62水平随着低氧时间的延长而逐渐减低,在低氧24 h时LC3Ⅱ水平显著升高,P62水平显著降低(P<0.05,图1B),呈时间依赖性。与常氧培养的成纤维细胞相比,低氧培养24 h后成纤维细胞(图2A)表达LC3荧光显著增强(P<0.05,图2B)。
Hypoxia groupvs.normoxia group,(1)P<0.05;(2)P<0.01.HIF-1α:Hypoxia-inducible factor-1α;CTGF:Connective tissue growth factor;LC3:Microtubule-associated protein 1 light chain 3.
图1低氧条件下皮肤成纤维细胞的纤维化(A)和自噬相关蛋白(B)的水平
Fig1Fibrosis(A)andautophagy-relatedproteins(B)expressionofdermalfibroblastsafterexposuretohypoxia
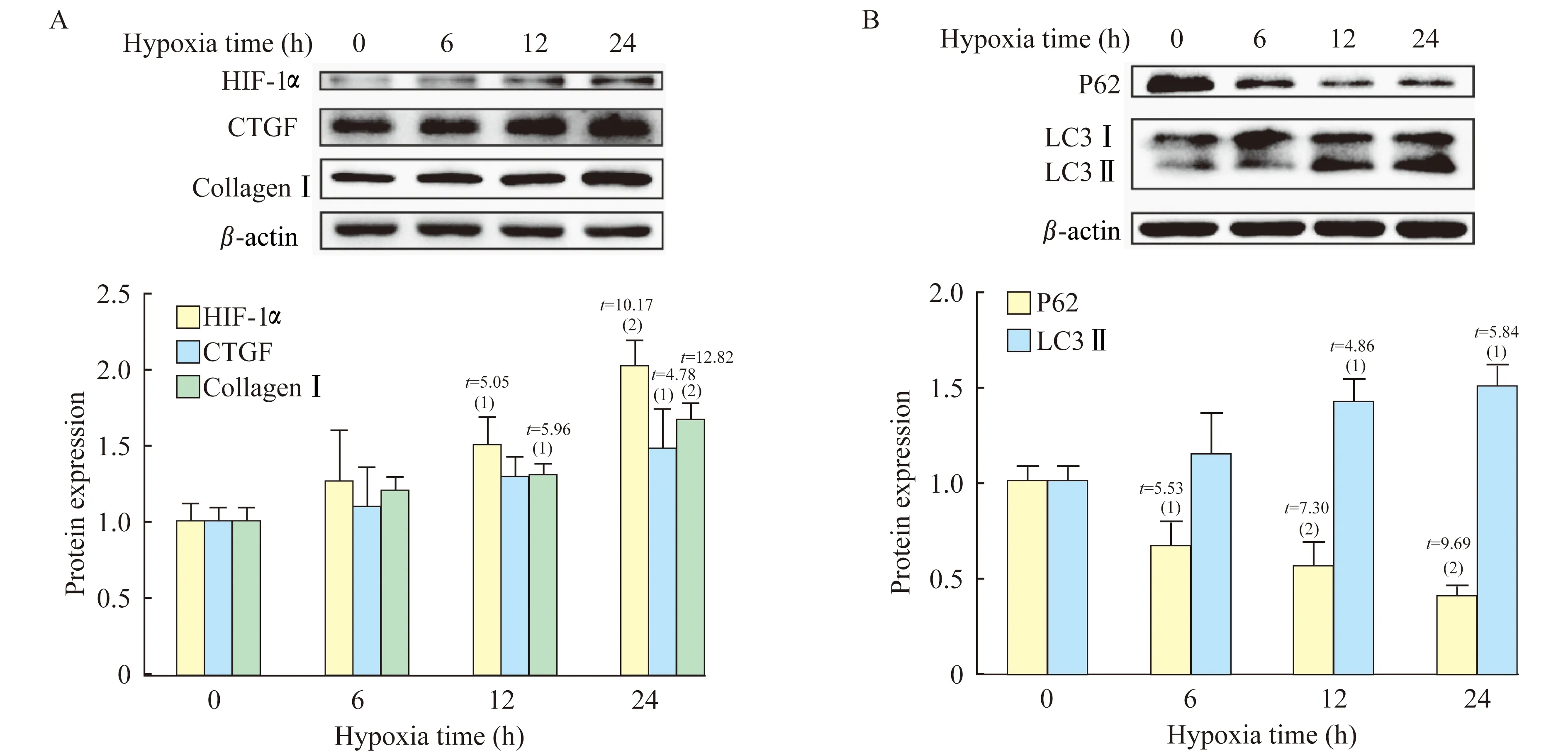
BafilomycinA1对低氧培养的成纤维细胞纤维化和自噬相关蛋白的影响使用不同浓度自噬抑制剂Bafilomycin A1(0、5、10、50 nmol/L)干预并予低氧培养24 h后,成纤维细胞表达Ⅰ型胶原、CTGF减少,且随Bafilomycin A1浓度的升高,Ⅰ型胶原、CTGF水平降低,而HIF-1α和LC3Ⅱ、P62等自噬相关蛋白水平增多。50 nmol/L的Bafilomycin A1干预组较未干预组的Ⅰ型胶原和CTGF水平显著降低(P<0.05,图3),LC3免疫荧光表达(图2C)较未干预组(图2B)显著增强(P<0.05)。
2-ME对低氧培养的成纤维细胞纤维化和自噬水平的影响使用不同浓度2-ME(0、5、10、25μmol/L)干预后,低氧培养24 h成纤维细胞的HIF-1α、Ⅰ型胶原和CTGF水平下降,且随2-ME浓度的升高,HIF-1α、I型胶原和CTGF水平不断下降,自噬相关分子LC3Ⅱ水平下降,而P62水平升高,均呈浓度依赖性。25μmol/L 2-ME处理组与未干预组相比,HIF-1α、I型胶原和CTGF水平显著降低(P<0.05,图4)。25μmol/L 2-ME干预后,低氧培养24 h的成纤维细胞LC3免疫荧光水平(图2D)较未干预组(图2B)显著减弱(P<0.05)。
讨 论
正常的皮肤组织纤维化有助于手术或各种创伤后的皮肤缺损愈合,但过度纤维化会造成皮肤组织强度下降、功能缺失和外观缺陷。目前认为皮肤组织纤维化后缺氧可能是进一步加重皮肤纤维化、形成疤痕增生的重要因素。HIF-1α活化促使成纤维细胞分裂增殖被认为是低氧诱发纤维化的重要机制之一[8]。Hong等[9]进一步研究认为,在低氧情况下,HIF-1α可能通过上调CTGF mRNA介导成纤维细胞胶原合成增加。本研究结果也提示,随着低氧时间的延长,HIF-1α的水平增多,成纤维细胞表达CTGF和合成Ⅰ型胶原也随之增多,这证实了低氧可导致成纤维细胞活化继而引起纤维化。纤维化使血管与组织细胞的间距增加,进一步加剧缺氧,形成缺氧与纤维化的恶性循环。

A:Normoxia (21%O2);B:Hypoxia (1%O2);C:50 nmol/L Bafilomycin A1+hypoxia (1%O2);D:25μmol/L 2-ME+hypoxia (1%O2).
图2BafilomycinA1和2-ME干预组皮肤成纤维细胞低氧培养24h后LC3的水平
Fig2EffectofBafilomycinA1and2-MEonLC3expressionindermalfibroblastsafterexposuretohypoxiafor24h
Bafilomycin A1 treatment groupvs.control group,(1)P<0.05;(2)P<0.01.HIF-1α:Hypoxia-inducible factor-1α;CTGF:Connective tissue growth factor;LC3:Microtubule-associated protein 1 light chain 3.
图3BafilomycinA1干预组皮肤成纤维细胞低氧培养24h后纤维化和自噬相关蛋白的水平
Fig3EffectofBafilomycinA1onfibrosisandautophagyrelatedproteinsexpressionofdermalfibroblastafterexposuretohypoxiafor24h

2-ME treatment groupvs.control group,(1)P<0.05;(2)P<0.01.2-ME:2-methoxyestradiol;HIF-1α:Hypoxia-inducible factor-1α;CTGF:Connective tissue growth factor;LC3:Microtubule-associated protein 1 light chain 3.
图42-ME干预组皮肤成纤维细胞低氧培养24h后纤维化和自噬相关蛋白的水平
Fig4Effectof2-MEonfibrosisandautophagy-relatedproteinsexpressionofdermalfibroblastafterexposuretohypoxiafor24h
低氧环境下的成纤维细胞自噬水平增高被认为是低氧诱发纤维化的另一重要机制。自噬是细胞利用自身衰老或损伤的细胞器和代谢废物,进行物质再循环的过程[10]。自噬加快促使活化的成纤维细胞过度合成大量胶原。为了探究低氧条件下成纤维细胞自噬水平和纤维化的关系,我们检测了低氧培养的成纤维细胞自噬相关蛋白的水平。
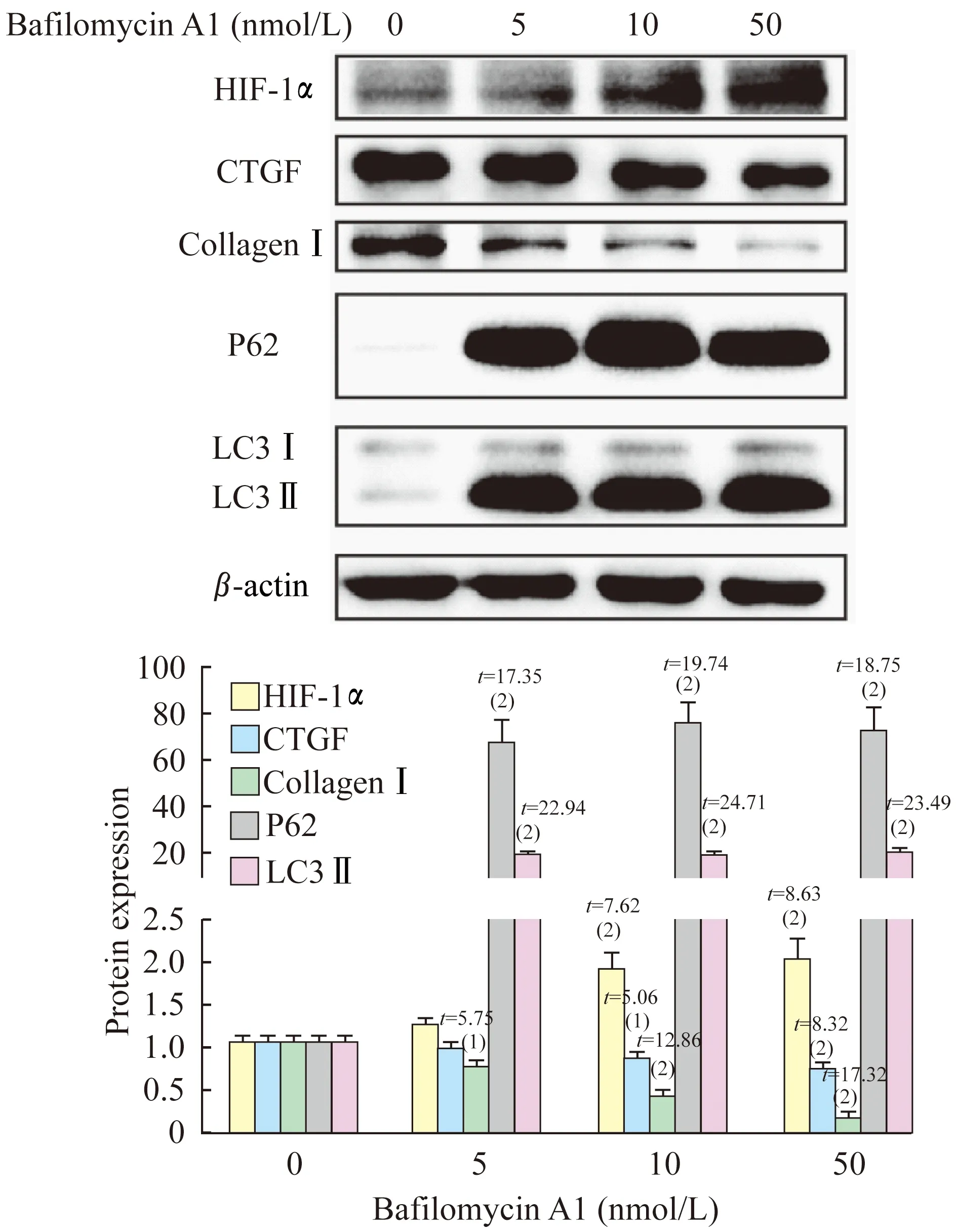
作为自噬的重要标志分子,LC3在细胞内有2种形式:LC3Ⅰ和LC3Ⅱ。LC3Ⅰ经过泛素化修饰后与自噬体膜表面的磷脂酰乙醇胺结合形成LC3Ⅱ,LC3Ⅱ是自噬小体形成的标志。P62是自噬降解的标志物,连接泛素化底物和LC3,最后P62和LC3Ⅱ在自噬溶酶体中一起被降解[11]。经典的自噬抑制剂Bafilomycin A1可抑制自噬小体和溶酶体的结合,自噬小体无法被降解,LC3Ⅱ不断蓄积,同时P62也因无法被降解而含量升高[12]。我们研究发现,随着低氧时间的延长,成纤维细胞表达LC3Ⅱ升高,表明低氧促进了皮肤成纤维细胞的自噬。加用Bafilomycin A1干预细胞自噬后,低氧培养的成纤维细胞过度合成的Ⅰ型胶原和CTGF明显减少,这表明抑制自噬可以显著阻断成纤维细胞纤维化,有可能成为皮肤纤维化疾病的重要治疗靶点。
2-ME是雌二醇的体内代谢产物,失去其雌激素前体的性激素活性,同时具有显著的细胞调节活性[4]。我们曾发现2-ME可以抑制皮肤成纤维细胞活化[5],还有研究发现它通过抑制HIF-1α增强瘢痕疙瘩放疗的效果[13],但2-ME对成纤维细胞自噬水平的影响尚不清楚。本研究采用2-ME干预低氧培养的成纤维细胞,发现其表达HIF-1α、CTGF和Ⅰ型胶原下降,且随2-ME浓度的增高,这种抑制作用越加显著,表明2-ME可抑制低氧导致的成纤维细胞纤维化。同时,在低氧条件下,2-ME处理的成纤维细胞LC3Ⅱ水平减低,LC3荧光减弱,P62水平增多,这提示2-ME可能通过抑制成纤维细胞自噬而阻断低氧导致的纤维化,而且其对自噬作用的靶点很可能在经典自噬抑制剂Bafilomycin A1自噬作用靶点的上游,具体机制有待进一步研究。
综上所述,低氧条件下皮肤成纤维细胞自噬水平增高并过度活化;2-ME可通过抑制低氧条件下成纤维细胞的自噬而阻断纤维化,这为2-ME在皮肤纤维化疾病中的应用提供了新的理论依据。2-ME因不良反应小、不易产生耐药性和口服耐受性好等优点而具有很好的临床应用前景[14]。

