碱催化苯甲酸酯类增塑剂的合成研究
曹凌峰,傅罗平,季铭建,章悦康,姜国平
(浙江合糖科技有限公司,浙江 金华 321016)
脂肪族多元醇苯甲酸酯增塑剂是一个品种繁多、使用广泛、性能突出的增塑剂类型,在较多场合是DOP的理想替代品。关于苯甲酸酯增塑剂合成已有大量报道,其中最具工业化价值的是直接酯化法。直接酯化法通常以多元醇、苯甲酸为原料,在催化剂存在下,回流分水,推动平衡移动,促使反应进行完全。现有工艺使用的催化剂主要为硫酸、固体酸、钛酸酯等酸性、中性催化剂[1-6]。存在腐蚀设备,聚合、分解等副反应严重、生成色素杂质较多等缺点。
聚甘油、山梨醇等与硬脂酸酯化反应常采用碱性催化剂,效果良好[7-8]。受此启发,将碱性催化剂用于多元醇苯甲酸酯增塑剂的合成,可以克服酸性催化剂带来的弊端。该方法的优点:催化剂来源广泛,价格低廉;多元醇自身聚合、分解等副反应少;产品纯度高、色度好;设备耐酸要求低;后处理过程简单易行;苯甲酸可回收套用等。是一种适合工业化生产多元醇苯甲酸酯的方法。
反应式如下所示:

1 实验部分
1.1试 剂与仪器
二丙二醇、丙三醇、季戊四醇、氢氧化锂、氢氧化钾、氢氧化钠、氢氧化钙、氢氧化镁等均为化学纯;甲苯、二甲苯、正辛烷等均为工业级。
HPLC:Waters 515 HPLC Pump,Waters2414示差检测器 (美国Waters公司),色谱柱TSKgel G2000H(日本TOSOH公司);NEX-US670型傅立叶变换红外光谱仪(KBr压片),美国NICOLET公司;AV600型核磁共振波谱仪 (DCCl3为溶剂,TMS为内标),德国BRUKER公司;液质联用:LC-30A型 UPLC仪 (日本岛津公司),Triple TOF4600质谱仪(美国AB Sciex公司)。
1.2 酯化反应
甘油三苯甲酸酯(GTB)合成:在装有回流分水器的250 mL三颈瓶中加入18.4 g丙三醇、76.8 g苯甲酸、100 mL二甲苯 (兼做溶剂与带水剂)、0.76 g氢氧化钾,升温至210℃~220℃,通过体系中溶剂量来调节回流带水和反应的温度。约反应3 h,基本无水蒸出,取样以HPLC监测反应终点,中间产物在0.5%以下时停止反应。保温反应毕。冷却至100℃~110℃,加入200 mL溶剂,溶解澄清。用10%碳酸钠水溶液水洗3次,每次20 mL。再水洗至中性。减压蒸干溶剂后得浅黄色透明粘稠状液体,冷却后为白色固体。收率98.1%,HPLC含量99.6%,MP:70.1℃~70.5℃。
采用类似方法,可制得其他多元醇苯甲酸酯。二丙二醇二苯甲酸酯(DPGDB):浅黄色透明粘稠状液体,收率97.7%,HPLC含量99.1%。季戊四醇四苯甲酸酯(PETB):白色固体,收率99.1%,HPLC含量99.3%,MP:99.1℃~99.6℃。
2 结果与讨论
2.1 催化剂种类的选择
对各种碱的催化作用进行了考察。按1.2节进行实验,考察各种碱的催化效果,如表1所示。

表1 不同碱催化剂对收率的影响Table 1 Effect of kinds of base catalysts on yield
由表1可知,采用碱性催化剂可取得较好收率,其中以氢氧化钾为催化剂时收率最高。碱加入体系后,与苯甲酸反应生成苯甲酸盐溶于体系,在反应温度下呈均相。随反应进行,体系中多元醇逐步转变为多元醇苯甲酸酯,体系极性降低,反应后期有固体析出。与其它苯甲酸盐相比,苯甲酸钾在体系中相容性好,析出时间更晚,体系搅拌效果好,能更好地起到催化效果。
2.2 氢氧化钾的用量
在选定氢氧化钾为催化剂的基础上,对催化剂用量(占苯甲酸质量分数)进行了考察,结果如表2所示。

表2 氢氧化钾用量对收率影响Table 2 Effect of quantity of KOH on yield
由表2可知,氢氧化钾用量为苯甲酸的1%时较为合适。偏低时,反应速度慢,且抑制多元醇聚合、分解副反应作用不明显;偏高时,虽然前期反应速度加快,但是固体析出提早,影响搅拌效果,最终导致收率降低。
2.3 溶剂兼带水剂的选择
按1.2节进行实验,考察不同带水剂对各多元醇苯甲酸酯化反应的影响,结果见表3。
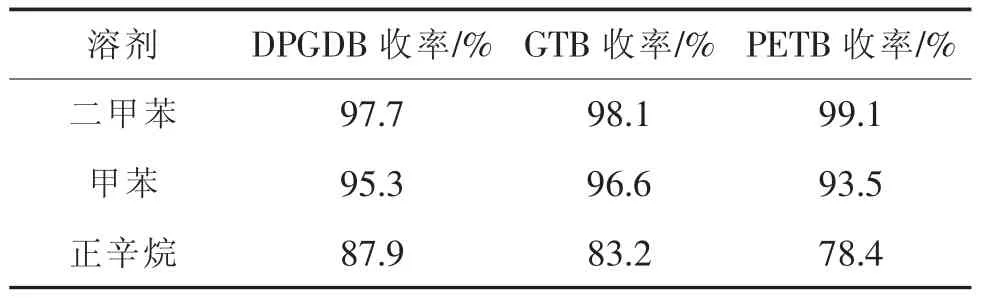
表3 带水剂对收率的影响Table 3 Effect of water-carrying agent on yield
由表3可知,二甲苯为带水剂较为合适。在本反应中,带水剂将反应生成的水及时移出体系是推动平衡移动,使反应进行完全的关键之一。优良的带水剂应具有使体系溶解完全、反应温度适当、带水能力强等特点。二甲苯对多元醇、苯甲酸、苯甲酸钾溶解性能较好,反应前期体系澄清,固体析出阶段较晚;沸点较高,在反应温度下体系仍保持一定量的二甲苯,有利于体系搅拌并有较大回流量,有利于将反应生成的水及时带出体系。
2.4 反应温度的影响
按1.2节进行实验,通过调节体系中二甲苯量来改变体系反应温度。考察温度对各多元醇苯甲酸酯化反应的影响,结果见表4。

表4 反应温度对收率的影响Table 4 Effect of reaction temperature on yield
多元醇苯甲酸酯化是分步进行的,一般反应活性最高的是伯羟基。随着反应进行,部分酯化后,剩余羟基的位阻增加、反应活性降低,须提高反应温度促使底物酯化完全。210℃~220℃较为适宜。
2.5 反应投料配比的影响
按1.2节进行实验,考察苯甲酸用量对酯化反应的影响,结果见表5。
由表5可知,提高苯甲酸用量可提高反应收率,但当 n(苯甲酸):n(羟基)=1.05 ∶1.0 后,进一步提高物质的量之比,收率增加不明显。且过量的苯甲酸会加重后处理负担,因此n(苯甲酸)∶n(羟基)=1.05∶1.0 较为适宜。

表5 反应配方对收率的影响Table 5 Effect of ratio of benzoic acid to polyol on yield
2.6 产物表征
2.6.1 红外光谱分析
图 1~图 3分别为 DPGDB、GTB、PETB 的红外光谱图。
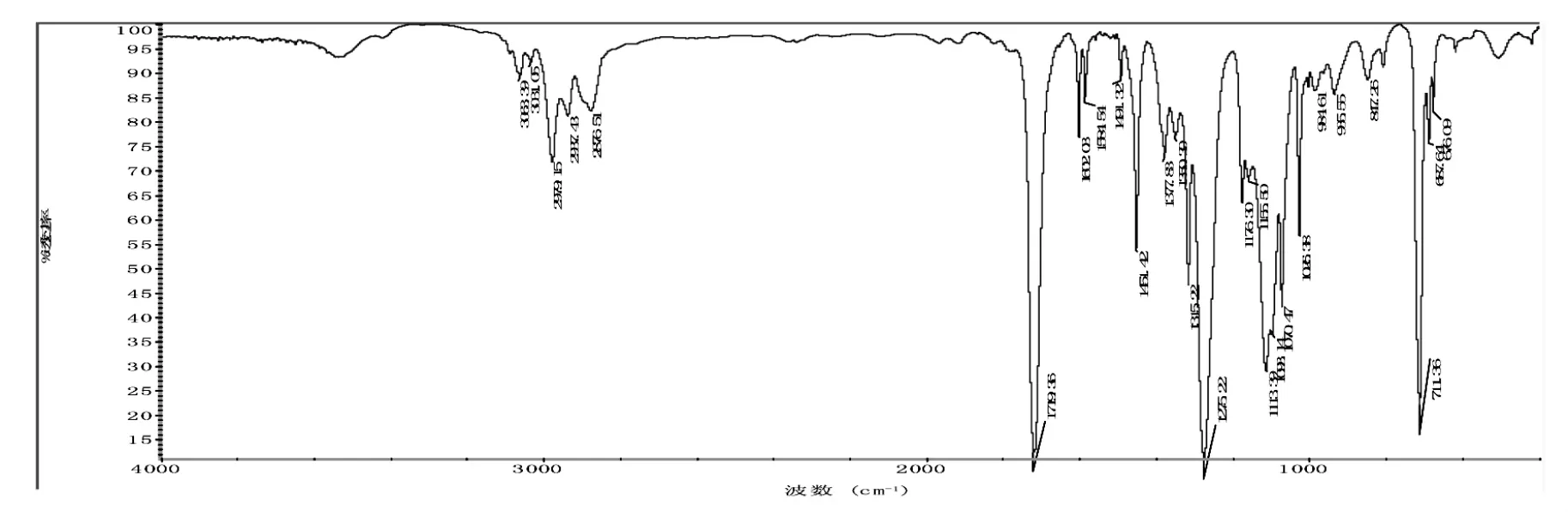
图1 DPGDB的红外光谱图Fig.1 IR spectrum of DPGDB
由图 1 可以看出:3063 cm-1、3031 cm-1为苯环上 C—H的伸缩振动峰;1491 cm-1、1451 cm-1为苯环碳骨架C—C伸缩振动吸收峰;711 cm-1为苯环上C—H弯曲振动吸收峰;1719 cm-1处出现苯甲酸酯中C=O伸缩振动吸收峰,1155 cm-1处出现酯类C-O伸缩振动吸收峰,上述吸收峰的出现证明苯甲酸酯官能团的存在。2979 cm-1、2876 cm-1及1491 cm-1为亚甲基伸缩振动吸收峰;1451 cm-1处出现了甲基伸缩振动吸收峰;1113 cm-1处出现了饱和醚键C-O-C的伸缩振动吸收峰,这说明所测化合物存在醚键。初步表明与产物DPGDB结构相符。3450 cm-1为KBr压片中微量水O—H的伸缩振动吸收峰。
由图 2 可以看出:3086 cm-1、3062 cm-1、3031 cm-1为苯环上C—H的伸缩振动峰,1490 cm-1,1450 cm-1为苯环碳骨架C—C伸缩振动吸收峰;707 cm-1为苯环上C—H弯曲振动吸收峰;1725 cm-1,1716 cm-1处出现苯甲酸酯中C=O伸缩振动吸收峰,1153 cm-1处出现酯类C-O伸缩振动吸收峰,上述吸收峰的出现证明苯甲酸酯官能团的存在。 2968 cm-1、2951 cm-1及 1491 cm-1为亚甲基伸缩振动吸收峰。初步表明与产物GTB结构相符。3122 cm-1为残留未反应的多元醇羟基O—H的伸缩振动吸收峰,与成品HPLC图谱中含有少量中间产物一致。

图2 GTB的红外光谱图Fig.2 IR spectrum of GTB

图3 PETB的红外光谱图Fig.3 IR spectrum of PETB
由图 3 可以看出:3067 cm-1、3036 cm-1为苯环上C—H的伸缩振动峰;1492 cm-1、1451cm-1为苯环碳骨架C—C伸缩振动吸收峰;705 cm-1为苯环上C—H弯曲振动吸收峰;1716 cm-1处出现苯甲酸酯中C=O伸缩振动吸收峰,1178 cm-1处出现酯类C-O伸缩振动吸收峰,上述吸收峰的出现证明苯甲酸酯官能团的存在。2965 cm-1、2904 cm-1及1492 cm-1为亚甲基伸缩振动吸收峰。初步表明与产物PETB结构相符。3430 cm-1处呈宽峰且含有尖峰精细结构,可能为KBr压片中微量水O—H的伸缩振动吸收峰和残留未反应的多元醇羟基O—H的伸缩振动吸收峰形成的复合峰。
2.6.2 核磁共振氢谱与质谱分析
将 DPGDB、GTB、PETB分别进行了1H NMR与UPLC-MS检测。1H NMR以DCCl3为溶剂,TMS为内标。结果如下所示。
DPGDB:1H NMR (600 MHz, Chloroform-d)δ 8.14 ~7.91 (m, 4H), 7.63~ 7.50 (m, 2H),7.51~7.25 (m,4H),4.50 ~ 4.25 (m,2H),4.12~3.22 (m,4H),1.50~1.03 (m, 6H).UPLC-MS,m/Z: (M+H+),实测值 343.38,理论值,342.39。
GTB:1H NMR (600 MHz, Chloroform-d) δ 8.08 (ddd, J=15.5, 8.3, 1.4 Hz, 6H), 7.71~7.53 (m,3H),7.56~7.39 (m,6H),5.98~5.73(m,1H), 4.92~4.66 (m, 4H).UPLC-MS,m/Z:(M+H+),实测值 405.41, 理论值 405.41。
PETB:1H NMR (600 MHz, Chloroform-d) δ 8.05~7.94 (m, 8H), 7.55 (tt, J=7.4, 1.3 Hz,4H),7.45~7.35 (m,8H),4.71 (s,8H).UPLCMS,m/Z: (M+H+),实测值 553.56,理论值 553.57。
DPGDB的1H NMR在δ 8.14~7.25处出现多重峰,共10H,可归属为苯甲酰基苯环上的H。受苯甲酸酯基作用,次甲基H化学位移移向低场,为δ 4.60~4.25,共2H。受氧的作用,亚甲基H化学位移移向低场,为 δ 4.12~3.22,共 4H。 δ 1.50~1.03,共6H,可归属为两个甲基上的H。以此可推断二丙二醇被二苯甲酸酯化。
GTB的1H NMR在δ 8.08~7.39处出现多重峰,共15H,可归属为苯甲酰基苯环上的H。受三个苯甲酸酯基共同作用,次甲基H化学位移移向低场,为 δ 5.98~5.73,共1H,同理亚甲基 H化学位移移向低场,为δ 4.92~4.66,共4H。以此可推断丙三醇被三苯甲酸酯化。
PETB的1H NMR在 δ 8.05~7.35处出现多重峰,共20H,可归属为苯甲酰基苯环上的H。δ4.71出现单峰,共8H,归属为4个亚甲基上的H。以此可推断季戊四醇被四苯甲酸酯化。UPLCMS结果与目标产物分子量一致。
综合以上谱图分析结果,证明产物的分子结构与目标产物的分子结构一致。
3 结论
(1)以二甲苯为溶剂兼带水剂,氢氧化钾为催化剂,n(苯甲酸)∶n(多元醇羟基)=1.05∶1.00,210℃~220℃保温回流分水至基本无水蒸出,液相监测中间产物小于0.5%,各多元醇苯甲酸酯化反应可进行完全,收率97.7%~99.1%。经FTIR、1H NMR、UPLC-MASS 对各产物结构进行表征,证实合成了目标产物。
(2)与酸性催化剂相比,使用碱催化反应产物颜色、多元醇聚合、分解副产物生成、后处理简化等方面均有明显改善,是一条可用于工业化生产多元醇苯甲酸酯类增塑剂的工艺路线。
(3)反应适应范围较广,多元醇及产物为液体、固体时均可采用,且均获得较高收率。

