中药葛根素对青年大鼠峰值骨量的影响研究
葸慧荣 李文苑 杨芳芳 马慧萍 陈克明*
1. 兰州军区兰州总医院骨科研究所,甘肃 兰州 730050 2. 兰州军区兰州总医院药剂科,甘肃 兰州 730050
峰值骨量(peak bone mass, PBM)即骨成熟末期所达到的最大骨量,是人一生中骨矿含量最高、骨硬度最大的时期。研究表明,峰值骨量的高低与骨质疏松症的发生有密切关系,峰值骨量越高,越不易发生骨质疏松。因此,努力提高峰值骨量是骨质疏松防治的重点[1,2]。葛根素是从中草药葛根中提取的异黄酮类化合物,化学名为4’,7-二羟基-8-D-葡萄糖基异黄酮,分子式为C21H20O9[3]。据报道,葛根具有活血化瘀、改善微循环、扩张冠状动脉等作用,其制剂葛根素注射剂临床用于治疗心脑血管疾病及视网膜血管病、眼底病及突发性耳聋等[4]。近年来,关于葛根素影响骨代谢的研究越来越受重视,实验研究表明葛根素在体内外实验中有增加骨量、改善骨代谢、抑制破骨细胞分化、促进成骨细胞生成的作用[5];许多学者又发现葛根素提取液可明显抑制OVX 大鼠的骨吸收率,将骨量维持于接近正常水平[6]。葛根素具有异黄酮结构,其化学结构与雌激素相似,能发挥雌激素样效应,但较雌激素毒副作用小,几乎无子宫增生等不良反应[7]。基于以上研究,我们推测葛根素可能会提高生长期大鼠的峰值骨量。因此,本实验考察了葛根素对青年大鼠峰值骨密度和骨质量的影响,同时考察了其安全性,以期对于葛根素的临床预防和治疗骨质疏松症提供依据。
1 材料与方法
1.1 实验试剂与仪器
葛根素购自陕西宝鸡辰光生物科技有限公司,纯度≥98%;淫羊藿苷购自陕西宝鸡辰光生物科技有限公司,纯度≥98%;双能X线骨密度仪(Prodigy,GE公司,美国),万能材料试验机(AG-IS,岛津公司,日本),硬组织切片机(SP1600,LEICA公司,德国),正置荧光显微镜(奥林巴斯公司,日本),雌二醇、骨钙素和抗酒石酸酸性磷酸酶试剂盒(IDS公司,丹麦),酶标仪(Epoch,BioTek公司,美国)。
1.2 实验设计
1月龄雌性Wistar大鼠36只,体重(114±5)g,SPF级,购自甘肃省兰州市兰州大学医学院实验动物中心(实验动物合格证号:SCXK (甘) 2014-0006-152)。适应性饲养一周后按随机数表法分为3组,每组12只,分别为对照组(control,CON)、淫羊藿苷组(icariin,ICA,阳性对照)和 葛根素组(puerarin,PR)。 ICA组灌胃淫羊藿苷25 mg/(kg·d),PR组灌胃葛根素15.4 mg/(kg·d),CON组灌胃等体积蒸馏水。大鼠饲养于 SPF 级实验室,饲养温度为(25±2)℃,湿度60%~70%,自由摄水和进食,每2周称1次体重,每个月测1次全身骨密度,待组间骨密度出现显著性差异后即处死所有动物,逐项开展以下检测。
1.3 检测项目
1.3.1体重、器官系数和病理学分析:所有大鼠自由进水、进食,每周换一次垫料,同时监测一次体重。两月后处死全部大鼠,剥离其主要内脏肺、肾、子宫,称其湿重,计算器官指数;之后将各器官固定于10%福尔马林溶液中,两周后进行石蜡包埋、切片、HE染色,在显微镜下观察病理切片,进行病理学分析。
1.3.2骨密度检测:10%水合氯醛腹腔注射麻醉大鼠后,用双能X线骨密度仪检测全身骨密度,当发现组间有显著性差异后即处死所有动物,分离出椎骨和右侧股骨,分别置检查床上检测其骨密度值。
1.3.3生物力学分析[8]:股骨进行三点弯曲试验,置于AG-IS型万能试验机,跨距14 mm,加载速度10 mm/min,计算机记录载荷变形曲线及最大载荷、弹性模量和屈服强度等。第四腰椎骨(L4)用于压缩试验,将椎体两面的椎间盘及软组织切除,用砂纸将椎骨打磨成上下两个面平行的圆柱体,将圆柱体垂直放置于不锈钢平台上,逐渐加载压力,加载速度为2 mm/min,记录载荷变形曲线及最大载荷、弹性模量等。
1.3.4血清生化指标检测:采用腹主动脉取血法抽取血样,5 000 r/min,离心10 min,取上层血清,-80 ℃保存;按ELISA试剂盒的说明书制作OC,TRACP 5b标准曲线,并分别于450 nm和405 nm处测定OD值,通过标准曲线计算出含量。
1.3.5股骨VG染色分析:新鲜分离的左侧胫骨用4%多聚甲醛固定后,参考胡蕴玉主编的《骨科实验技术》[9]进行脱水包埋,将包埋好的骨组织用LEICA SP1600锯式切片机切成约50 μm的骨片,用502胶水将骨片封固于载玻片上,用1200~2000目砂纸打磨至显微镜下可见的厚度,进行VG染色。即将打磨好的切片超声润洗10 min,0.1%甲酸浸泡3 min,2%甲醇浸泡2 h,流水冲洗3 min,亚甲基蓝60 ℃水浴5~8 min,水洗至不褪色,苦味酸品红染色15 min,无水乙醇冲洗数秒,二甲苯透明2~3 min,完成染色。镜下观察骨组织形态并通过Image-Pro Plus 6.0软件进行量化分析,量化分析指标包括定量分析包括骨体积/组织体(bone volume/tissue volume,BV/TV)、骨小梁数目(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁分离度(trabecular spacing,Tb.Sp)。
1.4 统计学处理
统计分析均采用SPSS 17.0软件完成,所有检测数据表示均用均数±标准差,不同组间差异采用单因素方差分析(One-way ANOVA),组间两两比较用LSD检验法。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠体重、脏器系数及病理学检测结果
实验过程中,各组大鼠饮食、饮水量及精神状态无明显变化,随时间增长两组大鼠体重均增加,但无统计学差异(表1);脏器系数结果显示,与CON组比较,ICA组和PR组大鼠主要器官肺、肾、子宫的脏器系数无统计学意义(表2),病理学观察也无明显毒副作用(图1)。

表 1 大鼠体重变化结果Table 1 Changes in the body weight of
注: 与CON组相比,*P<0.05,**P<0.01;与CON组相比,#P<0.05,##P<0.01
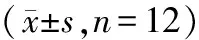
表2 大鼠主要器官的器官指数 Table 2 The organ index of main organs in
注: 与CON组相比,*P<0.05,**P<0.01;与CON组相比,#P<0.05,##P<0.01

图1 大鼠主要脏器病理切片的HE染色(20×)Fig.1 Histopathological sections of rats were stained with HE (20×)
2.2 骨密度检测结果
如表3所示,灌胃给药前,CON组、 ICA组和PR组大鼠全身骨密度均无统计学意义,灌胃4 w时,与CON组比较, ICA组和PR组大鼠全身骨密度有升高趋势,但无统计学意义(P均>0.05);灌胃8 w时ICA组和PR组大鼠骨密度显著升高,且差异具有统计学意义(P均<0.05)。实验大鼠处死后立即剥离椎骨和左侧股骨,检测其离体骨密度,结果出现与全身骨密度相同的趋势,即与CON组相比,ICA组和PR组股骨离体骨密度均显著升高(P均<0.01), 椎骨离体骨密度均显著升高(P均<0.05)(表4),这表明连续灌胃给予葛根素两个月后大鼠骨密度较空白对照组显著提高。



组别0 w4 w8 wCON0.1212±0.003150.135±0.002820.154±0.00187 ICA0.1211±0.01010.139±0.003140.163±0.00295∗ PR0.1219±0.01150.137±0.001310.161±0.00139#
注: 与CON组相比,*P<0.05,**P<0.01;与CON组相比,#P<0.05,##P<0.01



组别股骨椎骨CON0.116±0.001250.118±0.00143 ICA0.123±0.0010∗∗0.126±0.00278∗ PR0.126±0.00198##0.128±0.00214#
注: 与CON组相比,*P<0.05,**P<0.01;与CON组相比,#P<0.05,##P<0.01
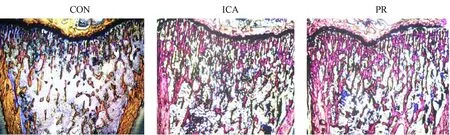
图2 大鼠胫骨近端不脱钙切片VG染色 (4×)Fig.2 The VG staining results of undecalcified sections of tibial epiphysis (4×)
2.3 生物力学结果
股骨三点弯曲试验和椎骨压缩试验显示,与CON组相比,ICA组和PR组大鼠股骨和最大载荷值显著升高(P均<0.01),弹性模量值也显著升高(P均<0.05,)(表5);与CON组相比,ICA组和PR组大鼠椎骨和最大载荷值显著升高(P均<0.05),弹性模量值也显著升高(P均<0.05)(表6)。
2.4 大鼠骨形态计量学分析结果
如图2所示,与CON组相比,ICA组和 PR组胫骨的骨小梁数目显著增加,骨小梁分离度明显减低,连续性较好;各项量化指标出现相同趋势,即与CON组相比,ICA组和PR组股骨中骨小梁数目(Tb.N)、骨小梁厚度(Tb.Th)和骨体积/组织体积(BV/TV)值均显著升高,且差异均具有统计学意义(P均<0.05),而骨小梁分离度(Tb.Sp)显著下降,差异具有统计学意义(P均<0.05)(图3)。

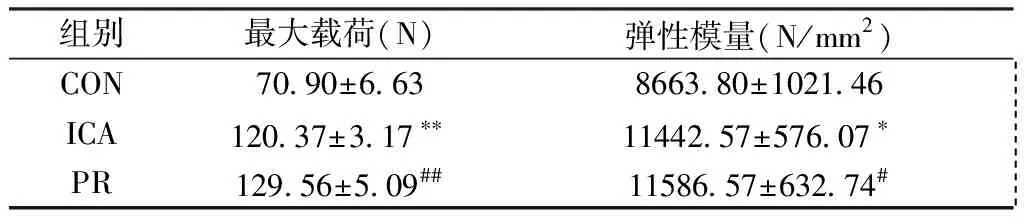
组别最大载荷(N)弹性模量(N/mm2)CON70.90±6.638663.80±1021.46 ICA120.37±3.17∗∗11442.57±576.07∗ PR129.56±5.09##11586.57±632.74#
注:与CON组相比,*P<0.05,**P<0.01;与CON组相比,#P<0.05,##P<0.01
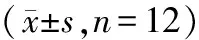
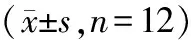

组别最大载荷(N)弹性模量(N/mm2)CON240.60±9.26299.20±17.85 ICA292.14±12.06∗521.43±40.53∗ PR288.31±14.37#440.87±82.02#
注:与CON组相比,*P<0.05,**P<0.01;与CON组相比,#P<0.05,##P<0.01

图3 大鼠胫骨近骺端组织计量学静态参数比较结果Fig.3 Comparison of static histomorphometric parameters in tibial epiphysis of 注:与CON组相比,*P<0.05,**P<0.01;与CON组相比,#P<0.05,##P<0.01
2.5 对大鼠血清 OC, TRACP 5b含量的影响
如表7所示,与CON组比较,ICA组和PR组OC含量值显著升高(P均<0.05),而TRACP 5b含量显著降低(P均<0.05),表明中药葛根素能促进大鼠血清中成骨细胞分泌因子OC含量,降低破骨细胞分泌因子TRACP 5b的含量。
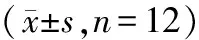


组别OC(ng/mL)TRACP 5b(U/L)CON145.37±55.442.98±1.70 ICA223.42±42.47∗1.08±2.23# PR214.17±39.97#1.52±0.30#
注:与CON组相比,*P<0.05,**P<0.01;与CON组相比,#P<0.05,##P<0.01
3 讨论
骨质疏松症是以骨量丢失、骨组织显微结构破坏,导致骨脆性增加和骨强度下降,并易于发生骨折的一种全身性骨骼疾病,是最常见的代谢性骨病之一[10]。骨质疏松症由峰值骨量和年龄增长相关的骨丢失两方面决定的,任何年龄段的骨量则是成熟期PBM与骨丢失量之差[11]。青年时期PBM值的高低对老年时期的骨量有至关重要的作用,是决定老年期是否发展为骨质疏松症的重要因素,老年期的低骨量主要是由于年轻时的低峰值骨量造成的,PBM的形成受遗传因素的控制和环境因素的影响。不同个体的PBM相差较大,其中60%~80%是由遗传因素决定,20%~40%则是由环境因素如运动、钙摄入、生活方式、身体疾病状态等决定,年轻成人时获得的最大PBM是预防老年性骨折的根本性措施[12,13]。因此,从青年时期开始增加骨骼质量,提高青少年时期峰值骨量已成为预防骨质疏松症的有效方法之一。
本实验以葛根素为实验药物,灌胃剂量参考公认治疗骨质疏松症的药物金雀异黄酮剂量10 mg/kg[14],将其换算成同样摩尔浓度的淫羊藿苷和葛根素,即25 mg/(kg·d)和15.4 mg/(kg·d)剂量对大鼠灌胃给药8 w,实验过程中,实验组大鼠的进食量、进水量和体重与对照组无统计学意义。主要脏器肝脏、肾、子宫等湿重和器官系数均无明显差别,病理学观察也未见异常变化。表明口服淫羊藿苷和葛根素8 w对大鼠饮食无不良影响,也未产生明显毒副作用。但大鼠给药8 w后其全身骨密度明显增加,股骨和椎骨骨密度也明显高于对照组。血清OC 和TRACP 5b 的检测结果表明,葛根素可显著地提高OC水平;同时,降低了TRACP 5b含量,提示葛根素提高青年大鼠峰值骨量可能是通过提高骨形成,抑制骨吸收来实现的。骨生物力学研究内容主要包括股骨三点弯曲试验和椎骨压缩实验,其评价指标通常为骨最大载荷、弹性模量和屈服强度等,上述参数可直接反应其抗骨折能力。而骨形态计量学是对骨组织微结构的重要评价。本实验生物力学结果显示,实验组股骨和椎骨最大载荷值和弹性模量均显著高于对照组,表明葛根素可提高青年大鼠股骨和椎骨的力学性能和强度。骨形态计量学VG染色图及量化结果显示,葛根素能显著增加实验大鼠股骨中骨小梁的数目,增加骨小梁厚度,同时减少骨小梁分离度,从而改善骨微结构。
目前,葛根素预防和治疗骨质疏松症的报道较多,黄彤等[15]证明葛根素对卵巢切除和睾丸切除的动物骨骼有保护作用,能改善骨密度,促进骨形成。孙蓓蓓等[16]证实葛根素可促进体外成骨细胞的生长和功能,抑制骨吸收。而本实验证明葛根素能显著提高生长期大鼠的骨密度和骨生物力学,提高血清中骨形成因子含量,抑制骨吸收因子水平。葛根素作为临床应用药物主要用于治疗高血压、冠心病心绞痛等疾病,但在骨质疏松症上的应用并不广泛,还需要做大量的临床研究。本实验研究为葛根素的临床应用提供了一定依据,在防治骨质疏松症方面进行了新的探讨。

