γ射线对小鼠胸腺淋巴细胞微丝形态及丝切蛋白磷酸化的影响
齐雪松,王春燕,李 辰 ,佟 鹏,邵 帅,曲功霖,苟 巧 ,苏 旭*
(中国疾病预防控制中心辐射防护与核安全医学所,辐射防护与核应急中国疾病预防控制中心重点实验室,北京 100088)
细胞微丝对细胞生物学各个方面都有影响,参与细胞的运动、物质运输、能量转换、信息传递、细胞分化等一系列重要功能[1]。丝切蛋白(cofilin)可促进微丝解离,抑制单体肌动蛋白聚合,最终引起微丝骨架改变[2]。在哺乳动物细胞中存在3种丝切蛋白家族成员,即肌动蛋白聚合因子(actin depolymerizing factor,ADF)、cofilin 1和cofilin 2。其中ADF和cofilin 1主要存在于非肌肉细胞中,cofilin 2主要存在于肌肉细胞中,cofilin 1比ADF在肌动蛋白成核过程和剪切过程起着更重要的作用[3]。cofilin 1蛋白广泛存在于静息细胞的胞质中,一旦细胞活化,它会出现在细胞膜运动的边缘,参与微丝骨架的高速组装和细胞移动[4]。cofilin 1在机体组织中的表达水平不尽相同,在神经系统、肠道、肾脏和睾丸中表达较高,在造血组织、破骨细胞和成纤维细胞中也有较高表达[5-6]。有研究报道,cofilin 1在胃癌细胞中过表达,促进细胞骨架重排,诱导上皮间质转化[7]。下调LIMK1-ADF/cofilin可抑制结肠癌的转移和侵袭[8]。当γ射线诱导小鼠胸腺淋巴细胞时发现微丝随照射剂量增大而损伤加重,cofilin基因表达随照射剂量的增大而上调[9]。这些结果表明cofilin的表达变化对细胞的功能状态发挥着重要调节作用。
淋巴细胞是机体免疫系统的主要参与者,同时具有较高辐射敏感性,大剂量电离辐射时,外周血淋巴细胞的急性损伤严重,是医疗救治的难点。因此,本项目拟通过观察γ射线诱导BALB/c小鼠胸腺淋巴细胞的微丝形态变化和对cofilin蛋白磷酸化的影响,探讨cofilin及相关蛋白在辐射损伤中的作用,为临床救治提供实验依据及探索新思路。
1 材料与方法
1.1 实验动物及分组
SPF级BALB/c小鼠,60只,雄性,4~6周龄(北京维通利华),实验动物许可证号SCXK(京)2011-0039。SPF级动物房饲养,自由饮水,观察无异常后进行实验。将36只小鼠随机分为6组,分别为对照组(0 h组)、照后3、6、9、12和24 h组,除对照组外,其他组给予2 Gy γ射线照射,于照后各时间点颈椎脱臼处死小鼠,解剖取出胸腺,用吸满0.01 mol/L PBS溶液的1 mL注射器(美国BD公司)将胸腺中的淋巴细胞冲出,离心收集细胞。通过cofilin基因mRNA和蛋白的表达检测,确定适宜的取材时间。再将另24只小鼠随机分为4组,分别为未照射(0 Gy)组、2、6和10 Gy组,除未照射组外,其他组给予不同剂量的γ射线照射,于前述确定的适宜时间取材,进行cofilin蛋白、磷酸化cofilin蛋白(phosphorylated cofilin,p-cofilin)、LIM激酶1 (LIM domain kinase 1,LIMK1)、TES激酶2(testicular protein kinase 2,TESK2)和Slingshot家族的磷酸酶2 (slingshot phosephatase 2,SSH2)蛋白表达检测。
1.2 照射条件
分别将小鼠装进照射盒内,剂量率为0.3 Gy/min,60Co γ射 线 (新 华 FCC-7000A)全 身 一 次 均 匀 照 射 , 2 Gy照射时间约为400 s,6 Gy照射时间约为1 200 s,10 Gy照射时间约为2 000 s。
1.3 荧光双标法观察微丝形态
用4%多聚甲醛(美国Sigma Aldrich公司)固定收集的小鼠胸腺淋巴细胞,加入300 μL 0.2% Triton-X 100,室温静置5 min,离心弃上清。加入200 μL 0.5% BSA,室温静置10 min,离心弃上清。加入FITC-鬼笔环肽(Phalloidin,美国Sigma Aldrich公司,针对actin微丝蛋白)和Alex Fluor 594连接的脱氧核糖核酸酶I (美国Invitrogen公司),终浓度均为5 μg/mL,混匀、孵育,离心弃上清。用0.01 mol/L PBS 1 mL清洗2次,调整细胞浓度约为104~ 105/mL。混匀,取10 μL细胞悬液滴片,并用含有DAPI的抗荧光淬灭剂(美国Vector公司)封片。激光共聚焦显微镜观察胸腺细胞微丝的形态变化。
1.4 采用实时荧光定量PCR(real-time quantitative PCR,qPCR)检测cofilin mRNA的表达水平
Trizol法提取小鼠胸腺淋巴细胞总RNA,取1 μL总RNA原液,用紫外可见分光光度计NANODROP 2000(美国Thermo Fisher公司)直接检测,读取D(260)/D(280)比值和浓度值,各组总RNA D(260)/D(280)值在1.78~2.02范围内,符合实验要求。以各组总RNA为模板,按GoScript反转录体系(美国Promega公司)说明书进行cDNA合成。以GAPDH为内参基因,cofilin为目的基因,SYBR染料法(美国Invitrogen公司)检测小鼠胸腺细胞中cofilin mRNA表达水平。
1.5 Western blot检测蛋白表达
取经BCA法定量的蛋白样品25 μg,与5×蛋白上样缓冲液(上海生工)混匀,置于沸水中加热5 min,使蛋白质变性。迅速放入冰中冷却,离心后SDSPAGE电 泳 , PVDF膜 (美 国 Millipore公 司 )转 膜 , 5%
B
SA封 闭 (上 海 生 工 ), 分 别 用 cofilin、 p-cofilin、LIMK1、TEST2、SSH2和GAPDH一抗孵育,4 ℃过夜,二抗孵育,室温1 h(抗体均购自美国CST公司),滴加发光液(美国Santa Cruze公司),用ChemiDoc XRC+成像系统(美国Bio-Rad 公司)拍摄条带图像。
1.6 数据处理与分析
用2-ΔΔCT法对qPCR结果进行相对定量分析,用成像分析系统测量Western blot条带的灰度值,内参蛋白为GAPDH,将目的蛋白与内参蛋白进行灰度值对比校正,得到蛋白的相对表达量。用SAS 9.0软件进行数据统计,数据进行方差齐性检验,方差齐的数据进行方差检验,方差不齐的数据进行秩和检验。
2 结果
2.1 γ射线诱导小鼠胸腺淋巴细胞不同时间cofilin基因表达的变化
由于2-ΔΔCT法要求目的基因与内参基因的扩增效率一致,因此根据cDNA浓度梯度的log值(X)和ΔCT值 (Y),求出两者的线性关系,Y=8.2+0.092X,斜率为0.092,接近于0,说明cofilin基因与GAPDH基因扩增效率一致,可用2-ΔΔCT法对cofilin基因mRNA表达的进行相对定量分析。
经方差齐性检验,各组数据方差齐(F=2.40、1.67、0.12,P>0.05),可用于方差分析。图1A可见,与对照组(0 h组)比较,cofilin基因mRNA表达在照后24 h内,除12 h组外,其余各时间组均呈明显的下调趋势(P<0.05)。cofilin蛋白表达在照后3和9 h组呈明显降低(t=2.58、3.04,P<0.05),其他组变化并不明显,见图1C。p-cofilin蛋白表达变化趋势与cofilin蛋白相似,但与0 h组比较各组差异均无统计学意义(P>0.05)。考虑cofilin基因表达在照后3 h明显下调,且为最早出现变化的时间点,因此选择照后3 h为后续实验取材时间。
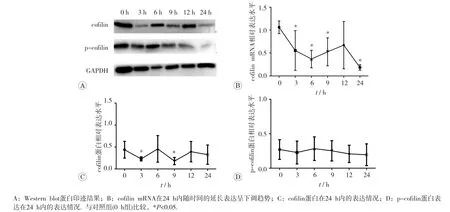
图1 2 Gy γ射线诱导小鼠胸腺淋巴细胞24 h内的cofilin基因表达和p-cofilin蛋白表达变化
2.2 不同剂量γ射线诱导小鼠胸腺淋巴细胞微丝形态的变化
激光共聚焦显微镜下观察,未照射的胸腺淋巴细胞质纤维形肌动蛋白(fibrous actin,F-actin,绿色标记)清晰可见、排列紧密、形态完整、边缘光滑、颜色明亮、球形肌动蛋白 (globular actin,G-actin,红色标记)弥散且均匀分布于胞质中,细胞核(蓝色标记)颜色较淡。2、6和10 Gy γ射线诱导后3 h,细胞的F-actin含量随照射剂量增大而逐渐减少,细胞核明显,有的细胞中可见F-actin疏松的丝状排列或断裂的F-actin小体。G-actin分布不均匀,呈团块状聚集(图2)。
2.3 不同剂量γ射线诱导BALB/c小鼠胸腺淋巴细胞cofilin和p-cofilin蛋白表达的变化
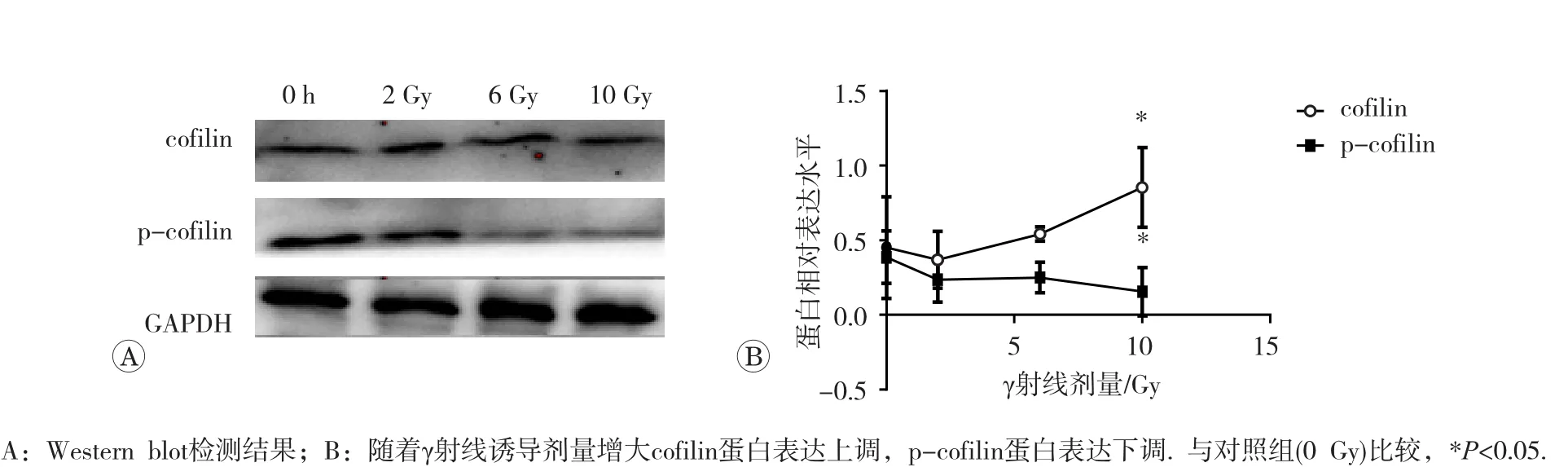
2、6和10 Gy γ射线诱导3 h后取材,与0 Gy组比较,发现随着照射剂量的增加,各照射组cofilin蛋白表达量逐渐上调,其中10 Gy组上调差异有统计学意义(P<0.05),而p-cofilin的表达随射线剂量的增加而下调,其中10 Gy组下调有统计学意义(P<0.05)(图3)。这表明,随着照射剂量的增加,p-cofilin蛋白表达量减少,cofilin蛋白表达量增高,引起F-actin快速解聚,抑制G-actin的聚合,淋巴细胞的迁移能力增强。
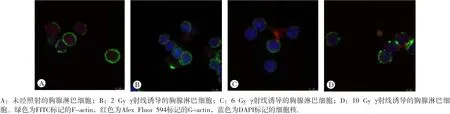
图2 不同剂量γ射线诱导小鼠胸腺淋巴细胞微丝形态的变化
2.4 不同剂量γ射线对cofilin磷酸化酶和去磷酸化酶表达的影响
如图4所示,磷酸化酶LIMK1蛋白和TESK2蛋白表达随γ射线剂量增大而小幅下调。去磷酸酶SSH2蛋白的表达随γ射线剂量增大而增高,但差异均无统计学意义(P>0.05)。
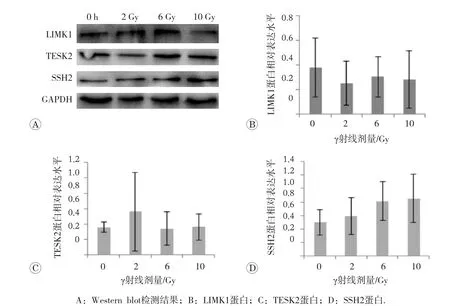
图4 不同剂量γ射线诱导胸腺淋巴细胞cofilin磷酸化酶和去磷酸化酶蛋白表达的变化
3 讨论
cofilin蛋白的活性主要由其Ser3位点磷酸化与否进行调控,LIMK和TESK为主要的磷酸化酶,使Ser3位点磷酸化,cofilin蛋白失活,不能与肌动蛋白丝结合,提高了F-actin的稳定性;SSH为主要的去磷酸化酶,使Ser3位点去磷酸化,激活cofilin蛋白,使其能够与F-actin结合,促进肌动蛋白丝的解聚[10]。由此可见,cofilin的磷酸化进程是肌动蛋白解聚的开关。cofilin可结合G-actin,参与去组装过程,是去组装过程中不可或缺的蛋白,但磷酸化的cofilin与G-actin的亲和性显著降低[11]。对人结肠癌发生进程的研究发现,LIMK/cofilin通路上的LIMK1、LIMK2和SSH2的过表达与结肠癌的进程及其化学抗药性相关,并有望成为结肠癌治疗中的肿瘤标志物和治疗靶标[12]。在脑型疟疾研究中发现,LIMK1/cofilin1通路的失调,使得神经细胞的树突形态发生改变,形成了actin-cofilin小体[13]。这些研究显示了LIMK/cofilin通路在疾病研究中的重要性,但在电离辐射诱导的损伤机制研究中相关的报道并不多见。
本研究检测了γ射线诱导BALB/c小鼠胸腺淋巴细胞cofilin 1、p-cofilin、LIMK1、TESK2和SSH2蛋白表达的变化,发现随着照射剂量的增加,cofilin 1的表达有增加的趋势,而p-cofilin的表达则减少,磷酸化酶LIMK1和TESK2的表达小幅下调,但去磷酸化酶SSH2的表达呈上调趋势,因此可推测,随着照射剂量的增加,更多的SSH2使p-cofilin的Ser3位点去磷酸化,这使得细胞质中cofilin 1的含量增多,参与到微丝骨架组装的过程中,并能使淋巴细胞进入活跃状态,其迁移能力增强,行使各项功能,以增强对射线的抵抗能力。但2 Gy γ射线诱导,随着时间的延长,cofilin 1 和p-cofilin的含量均减少,这可能是细胞内贮存的pcofilin受损或消耗过多,cofilin 1供应不足,淋巴细胞的活化能力降低,辐射敏感性增强。当上调脑胶质瘤细胞U251的cofilin蛋白表达,U251的辐射抗性显著增强,下调cofilin蛋白表达后,U251的迁移能力和辐射抗性均降低[14]。肝癌细胞也有类似的表现,当pcofilin表达的增多可以使肝癌细胞的迁移能力降低[15]。Jurkat T细胞的研究中发现SSH基因沉默会降低细胞的迁移和活化[16]。
放射治疗中的免疫细胞降低一直是影响疗效的首要副作用[17],其产生的机制并未探明。虽然已有一些防治措施,但疗效未达预期。从微丝的角度探讨免疫细胞辐射敏感的机制研究正逐渐成为热点,并具有潜在的临床应用价值。本研究对电离辐射诱导微丝改变的机制进行了初步摸索,发现了一些变化规律,提出假设,进一步验证工作亟待深入。

