体外细胞转化试验的研究与应用进展
王 丹 耿兴超 李 波 王 雪 * 文海若*
( 1.中国药科大学中药学院,江苏 南 京 211198;2.中国食品药品检定研究院国家药物安全评价监测中心,药物非临床安全性评价研究北京市重点试验室,北京 100176 )
癌症是全球范围内严重危害人类健康的疾病。根据美国癌症协会(American Cancer Society,ACS)[1]发布的最新数据,2018年美国将出现新发癌症病例超过173万例,癌症死亡病例接近70万例。随着人口增长、老龄化加剧、以及不健康的生活方式等因素(如吸烟、运动量过少和不健康饮食等),发展中国家癌症的疾病负担日益增加。在众多癌症诱因中,长期接触有害因素与癌症的发生直接相关,其中约90%以上为化学因素。监管部门和企业加强对致癌物的筛查并逐步禁止其生产和销售,或制定出最低接触安全剂量将有效降低整体癌症的发生率。
用于评价新药潜在致癌性风险的致癌试验是安全评价的重要内容。人用药物注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)[2]、美国食品药物管理局(Food and Drug Administration,FDA)[3]等国际机构已颁布了有关新药临床前致癌性评价的技术指导原则或指南,对药物致癌性试验的必要性、试验方法、剂量选择和限度进行了全面阐述。为期两年的啮齿类动物试验在近半个世纪以来一直作为临床前药物致癌性评价的金标准,其试验结果几乎可以辨别所有已知的人类致癌物。然而该方法也存在一定弊端。据统计,检测每种化学物质需要两个物种的动物共计600~800只,加上超过40种组织的病理学检查,需要花费大概100万欧元[4]。长期动物试验并不适用于例如欧盟法规《化学品的注册、评估、授权和限制》(Registration,Evaluation,Authorization and Restriction of Chemicals,REACH)[5]要求下的大量化学物质检测。此外,欧盟自2013年开始禁止使用动物开展化妆品安全评价研究,并禁止出售任何经过动物试验的化妆品产品。可见,监管单位迫切需要确立符合动物试验3R原则的高通量替代试验方法。细胞转化试验(cell transformation assays,CTAs)是从细胞生物学和分子生物学水平上研究肿瘤发生与发展的基本技术,能够较为快速检测化学物的致癌作用,在研究肿瘤的发生、发展及防治方面具有重要意义。本文将就体外CTAs的背景、优化、影响因素以及国内外发展趋势4个方面进行综述,为转化试验的应用提供借鉴。
1 细胞转化试验的背景
Berwald和Sachs[6]于1963年首次发现原代的正常叙利亚地鼠胚胎(Syria hamster embryo cell,SHE)细胞经体外培养后会出现形态学改变,继续培养一段时间并移植回地鼠体内后可致瘤。进一步研究显示,SHE细胞的形态学改变与啮齿类动物致癌性之间有良好的相关性,从而逐渐形成了使用CTAs对化合物致癌性进行研究的想法。SHE转化试验一方面借助SHE细胞形态学改变的能力检测致癌物,另一方面作为体外试验系统也可以研究致癌机制,包括肿瘤发生的多阶段性,致癌物改变DNA 的原理以及在肿瘤形成过程中特定基因的突变等。然而不同试验室间操作变异性较大,且经典的遗传毒理试验也可以检出大部分的致癌物,SHE转化试验的发展受到了限制。直至1996年,Kerckaert等[7]先后报道了培养基的pH值是决定SHE细胞生长和转化能力的关键因素之一,并对该方法进行了改良,形成我们今天所熟知的降低了pH值的SHE转化试验,从而提高了细胞形态转化与啮齿类致癌性结果的一致性。
随着试验方法的不断优化,使用SHE转化试验进行致癌性机制探讨和验证的研究持续至今。以SHE细胞转化试验为基础,Aaronson和Todaro[8]率先建立了体外的小鼠细胞转化试验。与地鼠胚胎细胞不同,小鼠胚胎细胞(其中BALB/c 3T3和C3H 10T1/2最为常见)更易于自发转变为永生化细胞,可以将转化灶的形成作为致癌物诱导细胞转化的检测终点。如Sasaki等[9]利用v-Ha-ras转染BALB/c 3T3后得到的Bhas 42细胞系开展CTAs。此外,人源CTAs被认为是检测人类致癌物的最佳选择,因受细胞来源限制,使用人类永生化细胞系开展转化试验成为当前主要的发展趋势。
啮齿类动物细胞或人类细胞的转化均至少包含4个阶段[10]:①细胞分化阻滞;②通过获得无限寿命、非整倍体的核型以及遗传的不稳定性进行永生性表达;③获得致瘤性;④包括转移在内的完全恶性肿瘤。SHE细胞转化试验采用的是细胞转化的第一阶段作为诱导肿瘤形成前的终点,也就是细胞分化阻滞;而永生化BALB/c 3T3以及人类细胞则依据非致癌永生性到致癌性转变形成灶以及典型的非贴壁依赖型生长作为检测终点。
2 细胞转化试验的优化
2.1 SHE细胞转化试验
SHE细胞转化试验是经典的CTAs方法,自诞生以来经历了一系列的优化和改良。SHE细胞转化试验中细胞接种密度较小,通常使用X射线照射刺激细胞的滋养层供养靶细胞的生长。然而细胞滋养层的背景为分辨转化群落和正常群落造成一定困难。通过将靶细胞接种在培养过原种细胞的条件培养基里而不是滋养层细胞上[11],这一改进,可避免X射线的使用,细胞群落的分辨也变得更为容易。此外,Schechtman等[12]在BALB/c 3T3和C3H 10T1/2细胞系中增加大鼠肝S9活化体系,扩大了可转化细胞系的敏感度。
如何客观准确地判断转化灶,是细胞转化试验标准化需要攻克的一大难题。研究人员正在探索是否能使用红外光谱分析细胞组分(蛋白质、脂质、糖原、DNA、RNA),从而对转化细胞群落进行更为客观的判定并提供机制方面的信息。例如,使SHE细胞在红外反射的载玻片上生长并转化,转化结果通过傅里叶变换衰减全反射红外光谱和常规计数两种方法观察[13],发现前者的计数结果大于常规计数,红外可监测到视觉无法辨认的转化灶。
从地鼠体内分离得到的SHE细胞是多种胚胎细胞的混合物,其中只有一部分子群能发生形态学上的转变。研究显示这种易感性的群体包括间叶和上皮两种细胞中未分化的和定向干细胞样的部分,可通过阻碍这些细胞的分化而发生转化。而癌细胞的来源可能也对应于正常的组织干细胞和定向组细胞[14]。这也成为SHE试验与体内试验有关联性的重要证据。如果能应用现代的分析手段描绘SHE细胞转化中易感子群并确定干细胞与定向组细胞的潜在角色,将有助于促进SHE试验的发展。
2.2 BALB/c 3T3细胞转化试验
BALB/c 3T3细胞转化试验以转化灶计数为评价指标,数据分析是试验的重要组成部分。转化试验中,通常采用每个平皿中三型转化灶的数目作为试验评判标准,然而BALB/c 3T3转化试验可用的草案里没有强调必须用哪种方法进行数据分析,所以有的人就每个平皿中转化灶的数目进行分析,如线性方差分析[15],非参数曼-惠特尼U检验或者泊松分布的参数检验等;另一部分人则对每个平皿中转化灶比例进行分析,如确切概率法[16]。欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECVAM)回顾了这些应用于BALB/c 3T3细胞试验的数据分析方法后,推荐了威廉姆型衰退保护趋势测试的负二项广义线性模型和通过特殊的转换对数据进行归一化两种方法。Hoffmann等[17]对上述两种方法进行了验证,认为它们适于分析BALB/c 3T3试验数据。Kajiwara等[18]则建议使用ITES培养基培养细胞,即在T培养基或者DMEM/F12培养基中加入胰岛素、转铁蛋白、乙醇胺以及硒和2%的胎牛血清以增强转化频率,这种改进同时也让转化灶的形成更为清晰并缩短了试验周期。该方法在日本多个试验室都得以复现,但由于测试的化合物较少,很难得出ITES培养基促进BALB/c 3T3细胞转化的结论。随后Kajiwara等人又用更多的化合物进行验证,证明该方法是可靠的短期检测潜在致癌物的方法。
2.3 Bhas 42细胞转化试验
在Bhas 42细胞转化试验中,与人类肿瘤相关的生物标志物也被认为是评价细胞转化较为客观的方法。乙酰胆碱酯酶(acetyl cholinesterase, AChE)和 丁 酰 胆 碱 酯 酶(butyrylcholinesterase,BChE)在肿瘤细胞的增殖与分化过程中扮演着重要角色,其基因会发生结构上的改变或是其产物可在多种组织的肿瘤中异常表达。在体外研究中已证实AchE可以促进非贴壁依赖型肿瘤细胞的生长[19]。肺、睾丸、输卵管、胃肠道肿瘤中也发现了碱性磷酸酶(alkaline phosphatase,ALP)的异常表达。在Bhas 42细胞转化试验中,未转化的Bhas 42细胞为单层,并且很少或几乎不表达AchE、BChE和ALP,而三型转化灶(转化灶的特征为强嗜碱性,形态异于单层生长的细胞,生长密集,在转化灶的边缘细胞随机定位)与二型转化灶(生长密集,复层生长,嗜碱性弱于三型转化灶)相比,AchE、BChE和ALP活性和表达量都更高[20]。这些生化指标也可以用于BALB/c 3T3细胞转化试验,但并不适宜SHE细胞转化试验,因为大多数肿瘤标志物在胚胎细胞中活性也很好(SHE细胞转化试验与Bhas 42细胞转化试验的比较见表1)。
Bhas 42细胞转化试验也进行了高通量改良。从平皿到6孔板,以及目前使用的96孔板,将该方法的高通量筛选致癌物的能力逐步提升。Sasaki等[21]采用96孔板培养细胞,简化了转化灶的计数,无论孔中有1个或是几个转化灶都记作1个,最终记录每块孔板上有转化灶的孔数,实现了对转化灶的高通量筛选。王颖等[22]采用H22O来区分未转化细胞和转化细胞,因低浓度的H2O2可以杀伤大部分正常细胞,而对转化细胞影响较小,在对活细胞进行CCK-8染色后,可以采用酶标仪等记录数据,并进行统计分析,增加了结果的客观性。Bhas 42细胞转化试验中启动试验与促癌试验分别进行,记种板日为第0天。启动试验在第1天给药,然后在第4、7、10、14天更换新鲜培养基;促癌试验在第4、7、10天给药,第14天更换新鲜培养基(以阳性剂为例,试验流程图详见图1和图2)。

表1 细胞转化试验的比较
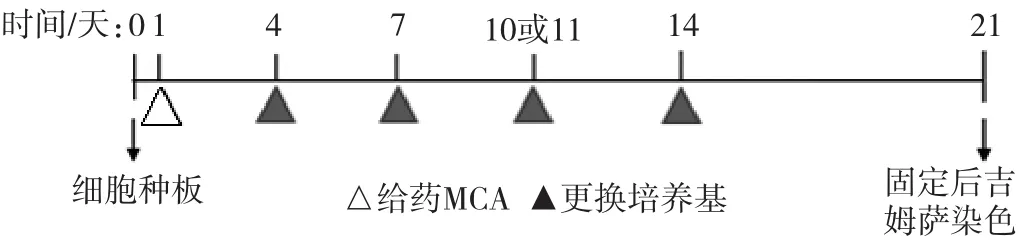
图1 细胞转化试验流程-启动试验
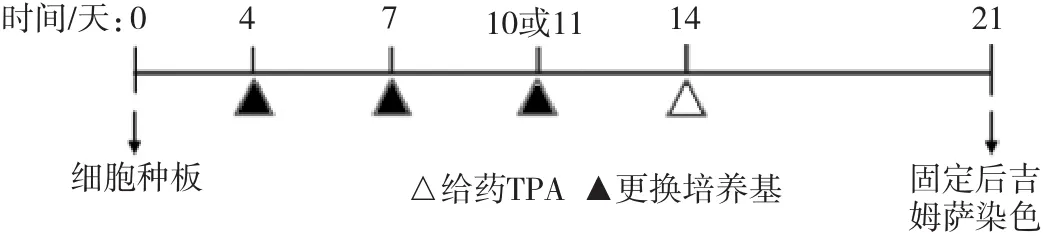
图2 细胞转化试验流程-促癌试验
2.4 两阶段细胞转化试验
Lasne等在1974年首次采用小鼠成纤维细胞系模拟两阶段的细胞形态恶性转化,其后Sasaki等[23]在BALB/c 3T3细胞转化试验的基础上提出了两阶段转化试验模型。这种改进根据肿瘤发生的多阶段理论,从试验设计上将启动剂和促癌剂的检测区分为两阶段,同时检测遗传毒性致癌物与非遗传毒性致癌物的活性。Sasaki等[24]经过长期试验对这种方法进行了改进,最终推荐使用以BALB/c 3T3(clone A31-1-1)为基础的两阶段细胞转化试验方法的标准化方法。Bhas 42细胞中导入了癌基因,因此可视为已处于启动阶段,在检测促癌物时可以不必经过启动剂预处理便可检测促癌活性,缩短了试验周期。由于细胞分裂在肿瘤启动阶段起着很重要的作用,而在肿瘤促长阶段细胞间通讯则占有重要地位。因此可以通过接种不同浓度的细胞,调整待测物质与细胞共同培养的时间,采用不同的培养间隔可区分启动剂和促癌剂。两阶段细胞转化即是在细胞对数生长期给予启动剂进行短暂处理,引起细胞基因突变而诱发转化。而在细胞融合后的生长静止期用促癌剂处理较长的时间,阻断细胞间通讯从而诱发转化,这样可以提高细胞恶性转化的频率。然而,肿瘤启动阶段被认为是涉及一个或多个突变的不可逆的过程,采用Bhas 42细胞筛查启动剂时,启动剂仍能诱导转化可能是引起其他转化相关基因的突变从而引起细胞转化。ECVAM[25]于2013年指出,Bhas 42细胞高通量转化试验是一种体外致癌性的检测方法,但该试验方法并不用于明确区分致癌物属于遗传毒性致癌物或非遗传毒性致癌物。
2.5 人源细胞转化试验
除了基于啮齿类动物细胞的转化模型,利用人源细胞通过在生理条件下促进其转化来鉴别致癌物方面也不失为一个理想模型。然而转化人源细胞比啮齿类需要更多的基因。例如,SV40大T抗原和癌等位基因H-RAS的引入足以让啮齿类细胞发生转化但却一直无法诱导人类细胞发生转化,这也是基于人源细胞的CTAs还没有作为常规方法而建立起来的主要原因之一[4]。另外,复制性衰老是人类细胞永生化和发生恶性转化的主要障碍,这个障碍也限制了人源CTAs的发展。啮齿类动物试验为绕过促进恶性转化的癌基因/应激诱导衰老提供了有用的方式,但是依旧不能克服复制性衰老。而对克服复制性衰老所需基因的认识正在增加,这将有助于模拟人类端粒酶活性和复制性衰老旁路试验的发展。
3 细胞转化的影响因素
适于开展转化试验的细胞需具备以下3个特点:在体外生长过程中具有稳定的生物学特性,对致癌因子的作用反应敏感,以及较低的细胞自发转化率。常用的细胞系包括:以SHE试验为主的原代正常双倍体细胞和永生化的非整倍体小鼠细胞系(传代细胞系,BALB/c 3T3和C3H 10T1/2和Bhas 42细胞系转化试验最为常见)。原代细胞系容易制备和培养,自发转化率低,转化后容易识别并能以定量的方式获得数字结果。与原代细胞相比,传代细胞则具有细胞群落稳定性高,试验重复性好,剂量反应关系明显等特点。
细胞转化可能受到其他因素的制约:①细胞性质。细胞分化程度与转化潜伏期长短呈负相关,如妊娠12天的鼠胚细胞和20个月龄的金黄地鼠皮肤成纤维细胞诱发转化的潜伏期分别为20.3和10.8个细胞群体倍增时间[26]。②培养条件。血清浓度降低,细胞转化率降低;有滋养层细胞存在时,细胞转化率提高;培养基的组成,ITES培养基能促进BALB/c 3T3细胞的转化;培养温度降低、加入两性霉素和长期缺氧会使已转化的细胞失去转化细胞的生物学性质。③给药方式与活化酶的使用。因细胞转化试验给药周期较长,而S9等体外活化酶系统本身存在一定细胞毒性不适于与该方法结合长期重复给药,可能无法检出需代谢活化后产生致癌性物质。然而,研究显示Bhas 42细胞本身含有CYP1A1等P450细胞色素酶,可代谢多环芳烃、乙酰氨基芴和环磷酰胺等物质[27]。
4 细胞转化试验的发展趋势
CTAs当前已被广泛应用于化学物、农药、化妆品、环境污染物等[28-29]的检测。当其试验结果与遗传毒性数据、构效分析、药代动/毒代动信息相结合时,可对化合物潜在致癌性进行相对综合的评估。目前CTAs的应用前景包括:①解释体外遗传毒性结果;②评估在低预测性传统遗传毒性试验中化学物的分类,筛选遗传毒性或非遗传毒性致癌物;④考察肿瘤的启动和促进行为;⑤研究特定致癌物的致癌机制等。
CTAs对于尚未实施致癌试验的化合物(如REACH法规下大范围的检测项目)或常规遗传毒性试验方法不适用的化合物(如无法经细菌代谢的医用纳米材料或抑菌性强的化合物,不适合开展Ames试验),尤其是化妆品和医疗器械的早期致癌性预测方面有重大意义。其最重大的价值是对非遗传毒性致癌物进行鉴别,并提供低剂量条件下化合物的遗传毒性作用机制,以验证阈值下遗传毒性化合物的特征。
近年来有研究发现地鼠细胞可克服癌基因应激/诱导衰老屏障的研究对CTAs试验的预测能力是有力的支持[4]。BALB/c 3T3和Bhas 42试验中转换后生化指标的鉴别也比传统方法更具客观性。然而很多科学家仍旧对CTAs持保留意见,该方法目前尚未被国际安全监管体系完全接受。有待改进的关键内容是如何通过CTAs对致癌机制进行探讨以及如何增加计数的客观性等。Sasaki等通过对Bhas 42 CTAs的试验操作方法和评价方法进行规范化,已形成指导原则草案并递交OECD[30],有望在今后应用于致癌性安全性评价。就目前应用较多的Bhas 42细胞来说,限制该试验发展的主要问题是细胞活性,活性的强弱直接影响了细胞的转化力和最终转化灶形成的多寡。当前迫切需要改善其细胞活性的方法,在试验过程中务必对其活性进行密切观察。
5 结语
CTAs是应用较为广泛的潜在致癌物检测方法。尽管该方法与啮齿类生物试验存在良好的相关性,但并不能完全模拟体内的整个致癌过程,而且考虑到用形态学标准来鉴定转化细胞较为主观以及对机制理解的缺乏,较难作为标准被接受。然而CTAs可以同时检测遗传毒性与非遗传毒性致癌物,并确定化合物毒性的阈值。以Bhas 42细胞转化试验为例,它可用于化合物致癌性进行早期的初步筛选,是对体内多终点遗传毒性评价结果的良好补充。随着分子生物学、生物化学、遗传学等相关学科的发展,研究人员对机制的研究和了解不断深入。通过不断地对方法学优化和改良,将会形成更为客观准确的细胞转化灶判断标准,CTAs将在临床前致癌性早期评价的舞台上发挥更重要的价值。

