适合纳米材料遗传毒性评价方法的选择
文海若邵安良陈 亮 淡 墨 胡燕平王 雪 * 徐丽明*
( 1.中国食品药品检定研究院国家药物安全评价监测中心,药物非临床安全性评价研究北京市重点实验室,北京 100176;2.中国食品药品检定研究院医疗器械检定所,北京 102629 )
国际标准《纳米技术-术语和定义-第二部分:纳米对象》(Nanotechnologies-Vocabulary-Part 2: Nano-objects, ISO/TS 80004-2:2015)对纳米粒子(nanoparticle)的定义[1]为:微小的物体(长度范围约1~100 nm),所有外部尺寸在纳米级,其中纳米物体最长和最短轴的长度无显著差异。如果尺寸差异显著(通常超过3倍),则为纳米纤维或纳米板。纳米材料独特的物理化学性质及其与生物体相互作用的特性为其在食品加工、抗菌产品生产、药物载体开发、肿瘤诊疗、体内示踪等领域提供了广泛的应用前景[2],与此同时,也可能带来潜在的安全风险。大量纳米材料的涌现,极大程度上增加了人体与纳米材料接触的机会,因此纳米材料的安全性评价成为关注的热点。如何合理评价纳米材料对人体的潜在毒性,特别是慢性或者长期毒性,预测其潜在毒性风险是目前学术界及各相关监管部门亟需解决的问题。
遗传毒性研究是非临床安全性评价的重要内容,是食品添加剂、化妆品、医疗器械、药物等产品进入临床试验及上市前必须开展的研究项目。对纳米材料的潜在遗传毒性、致癌和致畸作用评估,是评价纳米材料对人体安全性风险中极为重要的一环[3]。纳米材料的遗传毒性研究,已发展成一个专门的亚分支研究领域——纳米遗传毒理学[4]。大量文献研究显示某些纳米材料存在遗传毒性,且遗传毒性可能与纳米尺度有关。如非纳米尺度的二氧化钛(TiO2)的遗传毒性为阴性,而成为纳米尺度的TiO纳米材料时遗传毒性试验结果可为阳性[5]。纳米粒子的尺
2寸效应和表面活性高等特点使它极易透过细胞膜,可在表面活性和蓄积性的共同作用下,对细胞遗传物质产生直接或间接的相互作用。尤其是携带金属离子的纳米粒子进入体内后有可能通过氧化应激等作用机制诱发染色体或DNA断裂[6]。然而,当前经典的遗传毒性试验方法对纳米材料的评价存在一定局限性。
本文就当前安全性评价常用的遗传毒性试验方法评价纳米材料遗传毒性的优势和局限性进行综述,根据遗传毒性试验选择的基本原则,经济合作与发展组织(The Organization for Economic Cooperation and Development,OECD)纳米材料产品工作 组 (Working Party on Manufactured Nanomaterials, WPMN)于2014年发布的《纳米材料产品遗传毒性:OECD专家专题研讨会报告 纳米材料产品安全性系列文件N0.43》[7]和OECD遗传毒性指导原则[8],就适宜纳米材料的遗传毒性评价方法组合提出可选择的遗传毒性试验方法,以及推荐使用的试验组合方案,供纳米材料毒性评价和审评工作者参考。
1 纳米材料遗传毒性的特殊性
遗传毒性试验的目的是通过一系列试验预测受试物是否有遗传毒性,从而对受试物的潜在致癌性进行预测。就纳米材料开展遗传毒性评价,有助于降低人群接触纳米材料的毒性风险。遗传毒性试验方法众多,根据试验系统不同可分为体外和体内试验;根据检测方法针对与肿瘤相关的遗传终点,可大致分为3类,即基因突变、染色体损伤和DNA断裂。目前没有任何单一的试验方法可同时涵盖所有遗传终点。为全面考察受试物的潜在遗传毒性风险,通常需开展一系列机制上互相补充的试验,即标准化试验组合,来进行综合性评价[8]。人用药物注册技术要求国际协调会议(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use)在遗传毒性标准试验组合S2(R1)中要求,标准试验组合的选择应针对不同的遗传终点,包括体外和体内研究[8]。
纳米材料缓慢进入细胞又缓慢从细胞中释放,以及体内脏器分布(易于分布于肝、肾、肺、脑及免疫器官等)、蓄积性和缓释效应这些特点,与普通化合物和小分子生物制品有所区别,现行经典的遗传毒性评价方法可能无法有效而可靠地进行评价。比如,与啮齿类动物肿瘤相关度最高的传统细菌回复性突变试验无法有效检出纳米粒子的潜在致突变性,而体外微核试验、染色体畸变试验及彗星试验却通常可以得到阳性结果[9]。此外,纳米材料进入体内后,长期存在并蓄积于某些脏器无法排出,是否会对细胞的增殖产生影响进而诱发肿瘤也是需要考虑的重要因素之一。研究显示大鼠静脉注射纳米粒子后血液中纳米粒子短时间内快速清除,大量纳米粒子由循环系统进入组织[10]。而主要针对化学药物设计的体内遗传毒性研究通常使用外周血作为监测窗,采样时间较短,容易对纳米粒子的遗传毒性进行误判。在开展体内毒性研究时,需要结合其体内代谢和分布研究结果来进行毒性评价,并重点关注其靶器官遗传毒性。
法国药监局(Agence Nationale de Sécurité d u Mé dicament et des Produits de Santé,ANSM)在2011年发布的《含纳米材料医疗器械的生物学评估》的科学报告中指出由于大量纳米材料遗传毒性研究缺乏关于纳米材料理化性质鉴定的数据以及标准化而统一的试验方法和试验条件,不同研究中纳米材料的遗传毒性研究结果并不一致,难以对很多纳米材料的遗传毒性进行判断[11]。欧洲的NANOGENOTOX纳米遗传毒理计划就15种代表性纳米材料(包括5种纳米二氧化钛,4种合成无定形二氧化硅,6种多壁碳纳米管)使用一致的评价方法和评价标准开展试验研究并获得一定研究数据可用于分析参考[11]。OECD WPMN 在《纳米材料产品遗传毒性:OECD专家专题研讨会报告 纳米材料产品安全性系列文件N0.43》就纳米材料遗传毒性评价中的共性问题达成7项共识[7]。与会专家建议继续对纳米材料遗传毒性相关研究数据进行深入挖掘,以确定是否需要在可能的范围内对遗传毒性试验指导原则进行相应的调整。
2 遗传毒性评价方法存在的问题及建议
2.1 细菌回复性突变试验
2.2 哺乳动物细胞基因突变试验
基于哺乳动物细胞的小鼠淋巴瘤细胞tk基因突变试验(mouse lymphoma assay,MLA)和HPRT基因突变试验除检测致突变外,也可用于检测致断裂剂。从试验方法的角度上分析,避免了Ames试验中试验对象与受试物无法充分接触的多种因素,可作为检测致突变剂的体外备选方法。然而,该方法当前主要用于安全性评价,较少应用于科研领域,因此使用其开展纳米材料评价的文献很少。回顾目前文献报道[9],其试验结果基本与体外微核试验相符。Kirkland等[15]根据文献数据分析了MLA的预测效果,认为Ames试验和体外微核试验已足够用于预测啮齿类动物致癌性和体内遗传毒性;在两者的基础上增加MLA后,检出率仅从78%(316/405)提高至79.5%(322/405)。此外,也有文献报道使用啮齿类动物细胞系开展的与人源细胞开展的HPRT基因突变试验检测纳米二氧化钛和碳纳米管的试验结果存在一定矛盾,提示不同细胞系的敏感性及对DNA损伤的修复能力有所差异,从而对结果产生影响[16-17]。因此使用哺乳动物细胞基因突变试验检测纳米材料遗传毒性的可靠性和灵敏性尚有待确认,然而由于Ames试验的不适用性,缺乏适宜的平行对照试验方法来进行相应验证工作。
2.3 体外微核试验
微核试验是检测染色体或有丝分裂器损伤的一种遗传毒性试验方法。无着丝粒的染色体片段或因纺锤体受损而丢失的整个染色体,在细胞分裂后期仍留在子细胞的胞质内成为微核。体外微核试验是常见的评价纳米材料遗传毒性的试验方法,然而当前文献报道的体外微核试验方法缺乏一致性[9],在纳米材料暴露时间、添加细胞松弛素B(cytochalasin B,cytoB)的方法、全血清或低血清培养条件,以及细胞系的选择上存在很大差异。这些试验条件均可能对研究结果产生重要影响,导致无法对结果的可靠性进行判断。
如纳米材料进入细胞发挥作用的时间较久,建议增加细胞与纳米材料接触的时间。体外哺乳动物细胞试验受试物处理时间至少为24 h,以保证纳米材料与遗传物质(直接或间接)充分地接触。研究显示细胞与纳米材料作用24 h的检出率优于48 h及更长时间,以及不超过6 h作用时间[9]。纳米材料作为异物进入细胞,大多可对细胞周期产生影响。胞质分裂阻断法微核试验添加cytoB形成双核细胞模型,通过计数单核、双核、三核及更多核细胞形成率,可验证其纳米颗粒对细胞增殖的影响。针对双核细胞计数微核的优势是可以排除自发微核率(单核细胞微核)对背景值的影响。而胞质分裂阻断法微核试验中添加的双核细胞造模试剂cytoB可干扰细胞骨架的形成,从而影响细胞对纳米材料的内吞作用。cytoB的给药方法可采用后处理或延迟的共同处理方法,从而保证纳米材料可与细胞培养系统在无cytoB的情况下充分暴露。当前大多数研究中使用全血清,考虑到全血清条件可能更接近体内环境,然而血清含量可能对细胞的内吞作用产生影响,进而导致纳米材料进入细胞后对遗传物质的影响有所差异。有研究显示培养基中的血清含量可对细胞内吞作用产生影响,具体作用可因细胞类型和纳米粒子不同而异。如血清可降低人宫颈癌细胞(HeLa细胞)对二氧化硅包被的纳米粒子的摄取能力,并抑制MCL-5(人类淋巴母细胞B细胞) 对超细超顺磁性氧化铁纳米粒子的摄取;却可提高RAW 264.7 (巨噬细胞)对阴离子磁性纳米颗粒的摄取能力[18]。当前就体外研究中低血清条件或全血清条件哪一个更为适宜尚无定论。此外,研究显示细胞系的选择可能对评价结果产生重要影响,肿瘤细胞系较正常细胞系更易于获得阳性结果。这可能与肿瘤细胞分化增殖能力旺盛,抗氧化应激能力相应较差,以及对纳米材料的摄取能力较强等因素有关[19]。建议评价时结合受试物实际用途和检测目的,并结合受试物的主要暴露靶器官,选择适宜的细胞系开展试验[9]。常用的细胞系包括A549细胞(人肺腺癌细胞)和HepaRG细胞(正常人终末分化肝细胞)等。
2.4 体外染色体畸变试验
染色体畸变试验是除微核试验以外,另一项以染色体损伤为检测终点的常用遗传毒性评价方法。该方法通过分析中期分裂相细胞中染色体结构和数目的变化,并计数异常染色体结构和数目出现的频率来评价受试物对染色体的影响。开展体外染色体畸变时在细胞系的选择、血清的使用和纳米材料与细胞作用时间上的考量与2.3体外微核试验相同。含金属离子的纳米材料染色体畸变试验多显示为致断裂性。值得注意的是,某些细胞周期抑制作用明显的纳米材料(如纳米银)可诱导多倍体发生率显著升高[20]。该现象不排除与其抑制细胞分裂有关,可开展相关研究,如染色着丝粒的FISH法体外哺乳动物细胞微核试验[21],区分纳米材料是否有诱发非整倍体形成的可能,并明确其产生的原因。
2.5 体内及体外Pig-a基因突变试验
位于人的X染色体上的Pig-a基因及其同源基因的编码区在人、小鼠、大鼠乃至酵母中高度保守,Pig-a基因突变可导致糖化磷脂酰肌醇(Glycosylphosphatidyl inositol,GPI)合成障碍,致使细胞GPI锚蛋白缺失,该缺失可使用流式细胞术(Flow Cytometry,FCM)针对细胞表面GPI锚连蛋白(如CD59、CD55蛋白)的表达水平检出。Pig-a基因突变率可用以评价受试物对基因突变的作用。体内试验以红细胞(red blood corpuscle,RBCs)或网织红细胞(reticulocytes,RETs)表面缺失CD59或者CD55蛋白的发生率作为Pig-a基因体内突变的检测终点[22];体外试验备选细胞系包括TK6细胞和L5178Y细胞,以表型为GPI(-)的细胞出现率为Pig-a体外突变的检测终点[23]。Pig-a基因突变试验作为新兴的致突变剂检测方法当前尚处于开发阶段,未经过大规模实验室间验证,未形成相关指导原则,在纳米材料毒性评价方面的应用更为少见。然而纳米材料致突变性的检测方法有限,该方法或可成为有效的纳米材料致突变性检测方法。
2.6 其他试验方法
体内试验方法选择时,需根据受试物作用机制和体内分布蓄积情况进行选择。其中体内红细胞微核试验、体内染色体畸变试验和体内彗星试验的具体方法均有相应指导原则参考。彗星试验可较为灵敏地检测致断裂剂的作用[3],通常体内试验采样的时间在末次给药后3 h左右,其中部分断裂可自行修复,因此不作为常规的遗传毒性评价方法。然而彗星试验有可针对多种脏器/组织开展研究的优势,可结合组织分布研究评价受试物的细胞毒性和遗传毒性。在有证据显示受试物可致断裂的情况下,可通过彗星试验进一步分析其对不同脏器的影响。氧化应激是纳米材料诱导DNA损伤的重要作用机制。建议开展彗星试验时增加细菌甲酰嘧啶DNA糖基化酶(FGP)、核酸内切酶III、8羟基鸟苷DNA糖基化酶(hOGG1)等预处理,有助于分析断裂作用是否与氧化应激有关[24]。正式试验之前,需对FGP的处理条件进行充分验证,避免获得假阳性结果。针对DNA双链断裂的γ-H2AX作为遗传毒性生物标志物或有一定的应用价值。
在体内致突变性方面,考虑到纳米材料体内蓄积引起的毒性,啮齿类转基因动物模型,如MutaMouse,BigBlue®,Gptdelta转基因小鼠均可结合重复给药试验检测纳米材料的潜在长期致突变效应[25]。
而使用放射性试剂3H-TdR标记的体内哺乳动物肝细胞非程序性DNA合成试验,在使用条件上存在一定局限性。
家住在石门乡间,前后有两个小小的院子,于是,也种了不少杂七杂八的植物,按着季节,也会开出不少好看的花。有时候在廊前一坐,桂花送来淡淡的清香,觉得自己好像也安静古雅了起来。夏天的傍晚,茉莉会不停地开,摘下两三朵放在手心里,所有青春的记忆都会随着它的香气出现在我眼前。我想,我爱的也许并不是花,而是所有逝去的时光,在每一朵花后面,都有着我珍惜的记忆。
综上所述,按遗传毒性评价终点对评价方法进行分类,就这些方法存在的问题和可能的改良建议进行总结,见表1。
3 遗传毒性试验方法的特殊关注点
3.1 纳米材料的制备
纳米材料的物理化学性质是其毒性强弱和毒性特点的重要影响因素。相同组分的材料成为纳米材料时,其生物体内代谢动力学、长期体内分布及蓄积的特征可发生明显改变[9],其毒性与其粒径,表面修饰和分布密切相关[5]。纳米材料在理化性质上的微弱差异可直接导致其安全窗和毒性靶器官的不同。因此安全性评价需强调纳米材料的理化性质鉴定。在开展毒性评价之前,可参考OECD ENV/JM/MONO(2016)2、ISO/TR 13014:2012、ISO/TC229等相关标准,充分考察其物理化学性能和稳定性[26-28]。对于理化性质和稳定性不同的相同纳米材料,需要分别评价。如果拟评价受试物为医用纳米材料或者含纳米材料产品,应为可充分代表临床试验或上市后人拟用产品质量和安全性的样品。
受试物制备的总体原则是最大程度上模拟受试物与人体实际接触的方式。分散介质可影响聚集体的大小,从而影响受试物的沉降、聚集、细胞暴露、细胞毒性、剂量选择和遗传毒性试验结果。单纯的纳米材料受试物,需充分考虑其分散性,选择合适的介质,确保分散均匀,减少团聚。当特殊金属纳米材料可能会释放金属离子的情况时,需考虑所释放的金属离子与分散介质中离子的反应,可能会影响结果的判断。如纳米银会释放带正电荷的银离子,在分散介质,如氯化钠(NaCl)中,当银离子的浓度足够高时可与介质中的氯离子形成氯化银颗粒物。此时,应采取相应措施避免颗粒物形成,并充分评价非纳米材料颗粒物对试验体系和结果的影响。由于有些纳米材料具有极强的吸附特性,特别是对蛋白成分的吸附。因此,在样品制备时如采用含有机成分的生理介质,应充分评价纳米材料对介质中有机成分的吸附,及其对试验体系和试验结果解释的影响。

表1 遗传毒性试验方法用于纳米材料毒性评价的问题与优化建议
3.2 体外遗传毒性试验方法的关注点[7]
体外纳米材料遗传毒性试验可根据ICH S2(R1)细胞增殖和细胞毒性试验结果,选择最高受试物处理浓度[12]。某些情况下可考虑增加浓度设置间隔,设置大于标准范围(√√ 1100倍)并在无细胞毒的情况下开展试验,以保证获得较好的浓度-效应关系。
为保证纳米材料在体外实验系统的生物和物理环境中的状态与体内应用时的微环境的检测结果有可比性,应使用现有的方法对给药处理开始和给药处理结束的细胞培养基中纳米材料的表征进行鉴定。
考虑到纳米材料可能区别于普通化合物,不会在肝脏经过复杂的代谢过程,且S9作为高蛋白组分可影响纳米材料与细胞的相互作用,含纳米粒子受试物的体外研究通常不设置添加S9代谢活化的试验条件。然而尚没有数据明确指出在安全性评价可不设置S9处理组,该试验条件是否有意义还有待进一步考察。
纳米材料细胞摄取程度也是解释检测结果的关键因素,因此建议开展体外遗传毒性试验时同时对细胞摄取能力进行分析。通常从直接遗传毒性的角度分析,如哺乳动物对纳米材料摄取能力有限,可提示为较低的内在风险。当前细胞纳米材料摄取水平的定量分析方法通常使用电感耦合等离子体质谱(Inductively coupled plasma mass spectrometry,ICP-MS)的方法。细胞经受试物处理后,反复经PBS洗涤后收集细胞进行检测。如纳米材料粘附于细胞表面,细胞外的纳米材料难以冲洗干净,则检测结果可产生一定偏差。
3.3 体内遗传毒性试验方法的关注点
考虑到动物实验3R原则[替代(replacement)、减少(reduction)和优化(refinement)],体内评价方法并非纳米材料遗传毒性评价的首选。然而体外试验可能无法充分反应体内的条件,比如遗传物质损伤可能是刺激免疫系统炎症反映而间接诱导遗传毒性,尤其是纳米材料介导的短期强炎症反应和慢性持续的炎症反应都值得引起关注。不过当前评价免疫毒性的体外细胞因子释放等方法与体内评价方法的一致性尚未得到充分证明,与遗传毒性有关的具体的炎症或免疫作用通路并不明确,且炎症、遗传毒性和致癌性之间的关联还有待深入了解[25]。故开展体内研究应基于一定的体外研究基础。此外,开展体内遗传毒性研究前,需进行一些毒代动力学研究以确定纳米材料是否到达遗传毒性非接触部位靶组织。在缺乏相关数据的情况下,如纳米材料没有到达靶组织,则相应试验方法不适用于检测初级遗传毒性。在给药方式上,目前没有足够的数据支持某种给药方式优于另一种给药方式。试验给药方式需根据人最常见的暴露途径选择[7]。
4 遗传毒性试验组合优化的考虑
根据OECD遗传毒性试验方法评价指导原则,以及当前文献报道的纳米材料遗传毒性评价的特殊性,本课题组初步提出在对纳米材料开展遗传毒性评价时的试验组合优化的关注点。具体如图1。
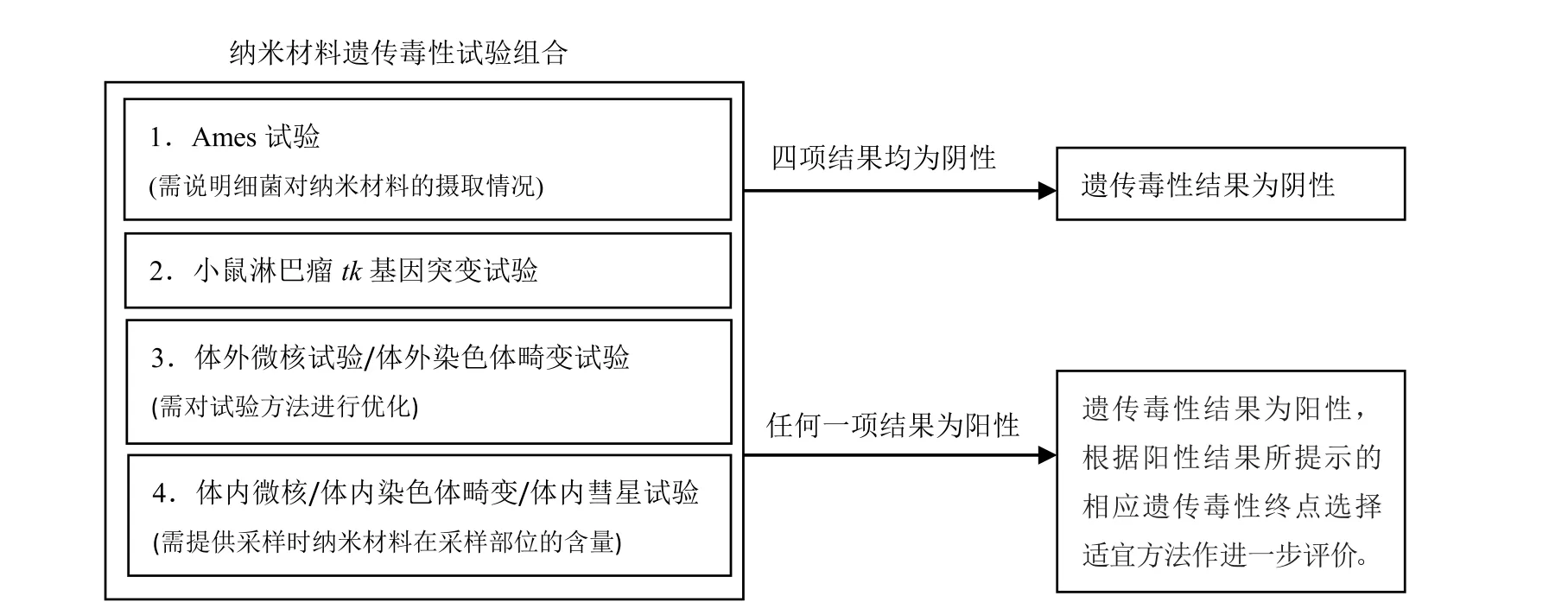
图1 纳米材料遗传毒性试验组合优化方案
尽管当前观点认为传统Ames试验不适用于纳米材料遗传毒性检测,但Ames试验作为对啮齿类动物肿瘤发生率预测效果最好的遗传毒性试验方法,不应完全排除在现阶段纳米材料遗传毒性评价组合之外。应在提供研究所用试验条件下细菌对该纳米材料摄取能力的基础上,考虑是否选择Ames试验,或者作为Ames试验结果判定的参考。而小鼠淋巴瘤tk基因突变试验涵盖了基因突变和染色体断裂两个检测终点,可作为第2项纳米材料潜在致突变能力检测方法。体外微核试验或体外染色体畸变试验针对致断裂剂在检测终点上与Ames试验和MLA互补,可任选一项作为第3项遗传毒性评价方法。在提供相应研究数据的同时应提供研究所用试验条件下细胞对该纳米材料摄取能力的证据,作为试验结果判定的参考。此外,纳米材料的遗传毒性试验组合应参考药物遗传毒性试验包括一项体内研究。可在啮齿类动物红细胞微核试验、哺乳动物骨髓染色体畸变试验或啮齿类动物体内彗星试验中任选一项作为组合中的第4项试验。
如体外研究中获得阳性结果再根据出现阳性结果的遗传毒性终点选择相应的体内评价方法。如果4项遗传毒性试验结果均为阴性,且根据受试物毒性作用机制分析不存在潜在致遗传毒性的风险,则判断受试物遗传毒性结果为阴性,无需进一步评价其遗传毒性。如果在4项遗传毒性试验中至少一项研究结果为阳性,则判定遗传毒性试验结果为阳性,考虑受试物存在遗传毒性风险。可进一步开展与检出阳性结果的评价终点一致的体内试验,并针对靶器官(组织)进行研究。
5 小结
纳米材料的诞生为人类带来机遇的同时也带来了挑战。与普通化合物相比,纳米材料的遗传毒性评价方法和试验条件均有所差异。如何科学地评价纳米材料的遗传毒性,成为当前亟需解决的问题。部分方法需要在传统方法上进行一定调整和优化,而一些试验及试验条件,如体外细胞摄取能力评价方法的优化、体外研究是否有必要添加S9和血清含量的选择尚有待深入探索,另有一些尚不成熟的新方法或可通过一系列条件摸索和验证工作成为适宜纳米材料的评价方法。深入开展纳米材料遗传毒性评价方法标准化和优化的工作,势必将推进一系列新兴的遗传毒性评价方法进入安全评价领域。本文回顾了现有常用遗传毒性评价方法用以评价纳米材料的优势与劣势,总结了纳米材料遗传毒性评价时的关注点,并基于OECD专家工作组的相关建议及相关遗传毒性评价指导原则初步提出纳米材料遗传毒性试验组合优化方案,以填补相关领域的空白,为纳米材料毒性评价和含纳米材料产品技术审评工作提供有益的借鉴。

