白花丹素对人类风湿关节炎成纤维样滑膜细胞凋亡的影响
刘 玉,朱德强,高 薇
(锦州医科大学1. 附属第一医院风湿免疫科、2. 基础医学院病理与病理生理教研室,辽宁 锦州 121000)
类风湿关节炎(rheumatoid arthritis,RA)为进展性的自身免疫性疾病,以关节滑膜组织内反复发作的慢性炎症为主要病理特征,并逐渐浸润关节内软骨和软骨下骨质,严重可以累及患者全身多个大小关节、器官和系统,发病率和致残率较高。大量文献证实,滑膜细胞在RA病程中呈类肿瘤性异常增殖,并侵入到软骨和骨,产生多种致炎因子,导致软骨和骨内慢性炎症。成纤维样滑膜细胞(fibroblast-like synoviocytes,FLSs)是RA病程中的主要效应细胞之一,其过度增殖及凋亡不足在关节破坏和慢性持续性炎症中起关键性作用[1-2]。因此,诱导关节内FLSs凋亡,抑制其增殖,在RA的临床治疗中至关重要。
临床上多采用来氟米特、甲氨喋呤等免疫抑制剂及靶向生物制剂治疗RA[3],但是其副作用和不良反应多,并且生物制剂价格昂贵,给患者造成了巨大的负担,延误了疾病的治疗。因此,研制高效、副作用小的抗RA新药势在必行。近年来,中药单体得到越来越多的关注,为治疗RA提供了新方法。白花丹素(plumbagin,PLB)的结构见Fig 1,为中药单体,提取自中药白花丹根和茎中,已有研究表明,PLB有抗肿瘤[4]、抑制肝纤维化[5]、抑制炎症[6]、抑菌[7]等多种效应,且在低浓度时对正常细胞毒性相对较小,但有一定的肝毒性[8]。近年来,PLB治疗炎症性疾病的作用受到越来越多的关注。本研究观察PLB对RA患者FLSs凋亡的影响,探讨PLB用于RA治疗的可行性。
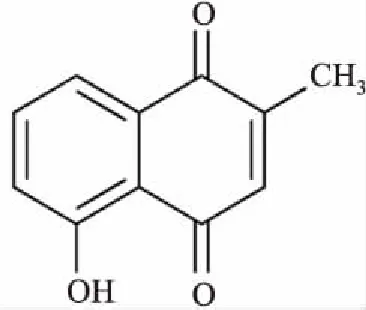
Fig 1 Chemical structural formula of PLB
1 材料
1.1滑膜组织标本人滑膜组织标本取自锦州医科大学附属第一医院2016年11月-2017年9月骨关节外科,行关节镜滑膜切除的活动期RA患者关节内切取的病变滑膜组织,患者症状符合美国风湿病协会(ACR)1987年修订的诊断标准,标本采集术前已获得患者知情同意。
1.2试剂白花丹素单体(纯度97%,CAS号:481-42-5,产品编号:P7262,分子质量:188.18)、LPS(产品编号:L2880)购自美国Sigma公司;甲氨蝶呤(methotrexate,MTX),CAS号:59-05-2,购自北京索莱宝科技有限公司;DMEM高糖培养基、胎牛血清(FBS)、二甲基亚砜(DMSO)购自美国Hyclone公司;细胞凋亡试剂盒购自美国BD公司;Bcl-2、Bax、cleaved caspase-3、p-JAK2、p-STAT3、GAPDH兔单抗,细胞凋亡Hoechst 33342染色试剂盒,均购自美国Cell Signaling Technology公司;抗血管细胞黏附分子1(vascular cell adhesion molecular 1,VCAM-1)兔单抗、辣根过氧化物酶标记的羊抗兔二抗、人 TNF-α ELISA试剂盒、人IL-6 ELISA 试剂盒、ECL Plus试剂盒,均购自上海碧云天生物技术有限公司。
1.3仪器倒置显微镜、倒置荧光显微镜(日本奥林巴斯公司);CO2培养箱(日本SANYO公司);酶标仪(美国Bio-Rad公司);流式细胞仪(美国BD Biosciences公司)。
2 方法
2.1RA患者关节FLSs的分离及培养将在无菌条件下分离的滑膜组织,浸入含DMEM高糖培养基的离心管,在0.5 h内采用酶消化法对滑膜组织进行处理:除去脂肪、纤维组织、血管等,无菌PBS反复冲洗5次,然后用高温高压灭菌的眼科剪将滑膜组织尽量粉碎成2~3 mm3小块,0.4%Ⅱ型胶原酶和0.25%胰蛋白酶分别于37℃、5% CO2培养箱中消化2、0.5 h,加血清终止消化。纱网过滤,1 000 r·min-1离心10 min,弃上清,加20% FBS培养基重悬,混匀,接种至培养瓶内培养,24 h后换液,弃去未贴壁细胞,余下细胞长满后传代。待传代3次后,可见长梭形或菱形,呈巢状生长的FLSs,约占98%以上,取第3代细胞进行细胞鉴定,第4~7代进行实验。
2.2FLSs的鉴定取第3代细胞接种至6孔板中,每孔预先铺好盖玻片,待每孔细胞长至约70%时,吸出培养液, PBS漂洗后,4%多聚甲醛固定液4℃固定过夜,PBS洗去固定液,0.5% Triton X-100室温通透20 min,PBS漂洗3次,每次5 min,吸尽液体,封闭液封闭1 h,去封闭液,用1 ∶200稀释的抗VCAM-1一抗置于湿盒内4℃孵育过夜,PBS洗涤去除一抗,吸尽液体,滴加1 ∶1 000稀释的二抗,湿盒内避光孵育1 h,PBS洗涤3次,避光操作,DAPI避光孵育5 min,PBST洗涤5次,每次5 min,吸尽液体,滴加抗荧光淬灭封片液于载玻片,盖上贴有细胞的盖玻片,于荧光显微镜下观察并拍照。
2.3MTT法检测RAFLSs活力及增殖能力将RA患者第4~7代的FLSs均匀铺至96孔板,每孔约6×103个细胞。置于37℃、5% CO2的细胞培养箱内培养,细胞贴壁后,将其分组:第1组为空白对照组(Control组),第2~4组为PLB组(0.5、1.5、3 μmol·L-1PLB处理细胞),第5组为模型组(1 mg·L-1LPS处理细胞),第6~11组为LPS+PLB处理组(1 mg·L-1LPS+0.5、1.5、3、5、7.5、10 μmol·L-1PLB处理细胞),第12组为LPS+MTX处理组(1 mg·L-1LPS+ MTX 1.0 mg·L-1)。药物作用24 h后,加入MTT溶液,37℃、5% CO2孵育4 h ,轻轻抽掉培养液,每孔加入100 μL DMSO,室温震荡溶解甲臜结晶,用酶标仪检测490 nm处的OD值。本实验重复6次,每次每组设置5个复孔。
2.4ELISA检测RAFLSs致炎因子的分泌量将第5~7代RA FLSs接种在96孔板,每孔约6×103个细胞,置于37℃、5% CO2孵箱中培养24 h,将细胞分为5组:对照组、模型组(1 mg·L-1LPS)、LPS+0.5 μmol·L-1PLB组、LPS+3 μmol·L-1PLB组、LPS+1.0 mg·L-1MTX组。24 h后收集各组细胞培养液,10 000×g离心5 min以去除杂质,按照ELISA说明书操作,酶标仪检测各组OD值。根据绘制好的标准蛋白曲线,计算各组细胞培养液上清TNF-α、IL-6的浓度。
2.5克隆形成实验检测RAFLSs的克隆形成能力取第4~7代FLSs,铺6孔培养板,每孔细胞约5×105个,根据上述分5组用药物处理。药物作用时间2周,期间每3 d换液1次,并保证药物浓度不变。然后用PBS轻轻漂洗2次;5%的甲醛固定30 min,PBS轻轻漂洗3次;结晶紫染色30 min,PBS漂洗3次;晾干,相机拍照。
2.6Hoechst33342染色法观察RAFLSs细胞核的凋亡形态按说明书处理的盖玻片放入6孔板中,取第4~7代的FLSs,均匀铺至6孔板内,每孔内细胞密度约80%时,按上述分成5组处理。24 h后吸出孔内液体,固定,PBS漂洗,每孔0.5 mL Hoechst 33342染色液染色20 min,PBS轻轻冲洗3次,封片,用荧光显微镜随机选择不同区域观察并拍照。活力较强的细胞胞核为微弱荧光,凋亡细胞的核呈浓染的蓝色荧光。
2.7流式细胞术(flowcytometry,FCM)检测RAFLSs凋亡率取第4~7代的FLSs,均匀接种到6孔培养板中培养,分组同上。药物处理24 h后消化、离心,预冷PBS重悬,将细胞密度调至1×108·L-1,按Annexin V-FITC/PI试剂盒说明书染色,流式细胞仪上机检测。
2.8Westernblot检测相关蛋白表达提取细胞蛋白,各组药物作用24 h后,消化、离心;RIPA裂解液处理细胞,4℃、12 000×g离心25 min;按BCA定量说明书进行蛋白定量,根据定量结果配制样品,样品100℃水浴5 min;SDS-PAGE凝胶电泳,将蛋白转至PVDF膜上,留取目标条带;1%的BSA封闭1 h;一抗(1 ∶1 000)4℃孵育过夜,TBST漂洗3次;二抗(1 ∶1 000)室温孵育1 h,TBST漂洗3次,ECL显影,本实验重复3次。
3 结果
3.1RA患者FLSs形态鉴定RA FLSs培养2 d观察到少量散在的FLSs已贴壁(Fig 2A)。1周后有少量集落形成,细胞数目明显增多,细胞之间有明显空隙,形态为长梭形、菱形、三角形(Fig 2B),换液,继续培养2 d(Fig 2C)传代,经2~3代后细胞形态均一,镜下观察细胞形态为长梭形,与相邻细胞相互交织,呈巢状生长,符合FLSs形态。
3.2RAFLSs细胞标志物鉴定Fig 3的免疫荧光结果显示,分离培养得到的第3代滑膜细胞标志物VCAM-1均呈阳性表达,而其他组织来源的成纤维细胞VCAM-1均为阴性表达,故本实验分离培养得到的细胞均为FLSs,符合实验要求。
3.3PLB对RAFLSs活力及增殖能力的影响如Fig 4所示,单独PLB处理组(0.5、1.5、3 μmol·L-1)与对照组相比,RA FLSs活力差异无统计学意义(P>0.05)。与模型组(1 mg·L-1LPS)相比,LPS+PLB组、LPS+MTX组细胞活力明显降低(P<0.05),PLB对细胞增殖的抑制能力呈浓度依赖性。说明0.5、1.5、3 μmol·L-1PLB对对照组细胞活力无明显影响,对LPS诱导的炎症细胞有明显的抑制作用。PLB对LPS炎症诱导细胞的抑制率IC50为3.149 μmol·L-1,故选择浓度为0.5、3 μmol·L-1PLB处理细胞24 h进行后续实验,以MTX处理细胞作为阳性对照。
3.4PLB对LPS诱导的RAFLSs致炎介质分泌的影响Fig 5的ELISA结果显示,与对照组相比,模型组上清中TNF-α、IL-6浓度均明显增高(P<0.01),说明造模成功;LPS+PLB处理组及LPS+MTX处理组TNF-α、IL-6水平与模型组相比明显降低,说明PLB与MTX能抑制LPS诱导的炎症因子的分泌。
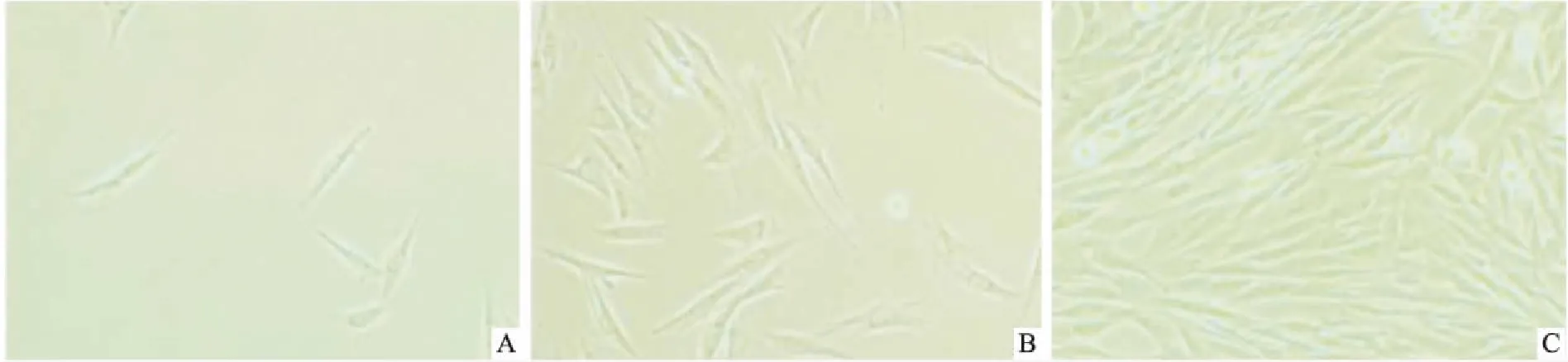
Fig 2 Synovial fibroblasts isolated by enzyme digestion method in patients with rheumatoid arthritis(×200)
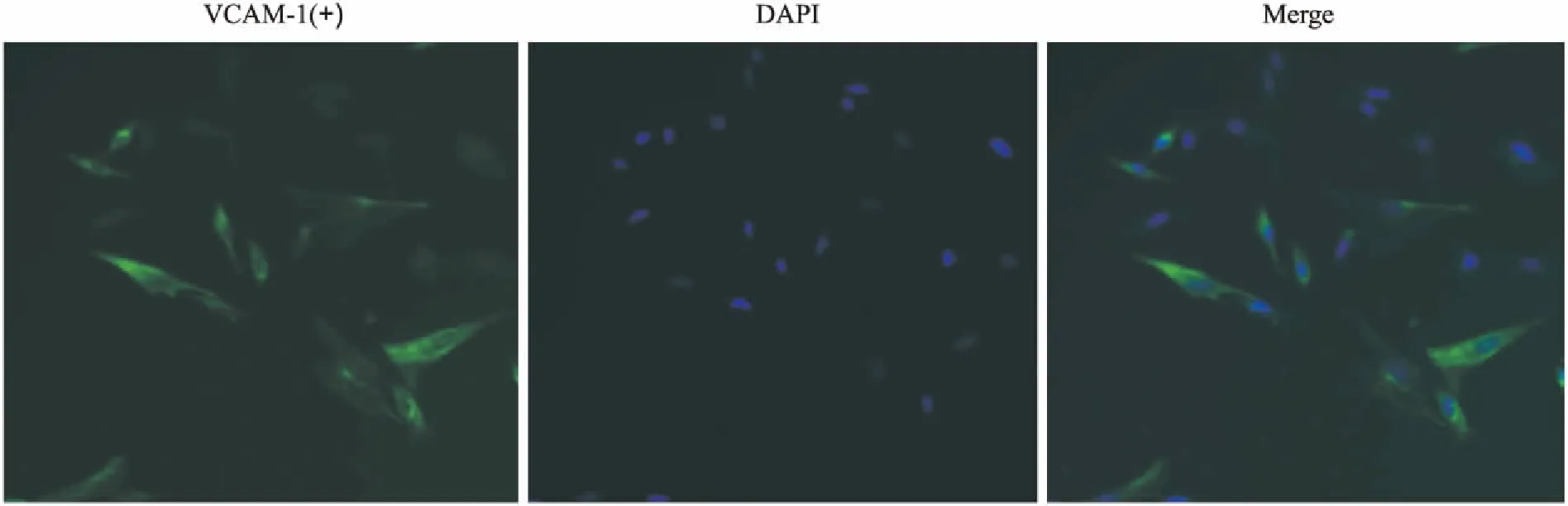
Fig 3 Expression of VCAM-1 in RA FLSs by immunofluorescence staining(×200)
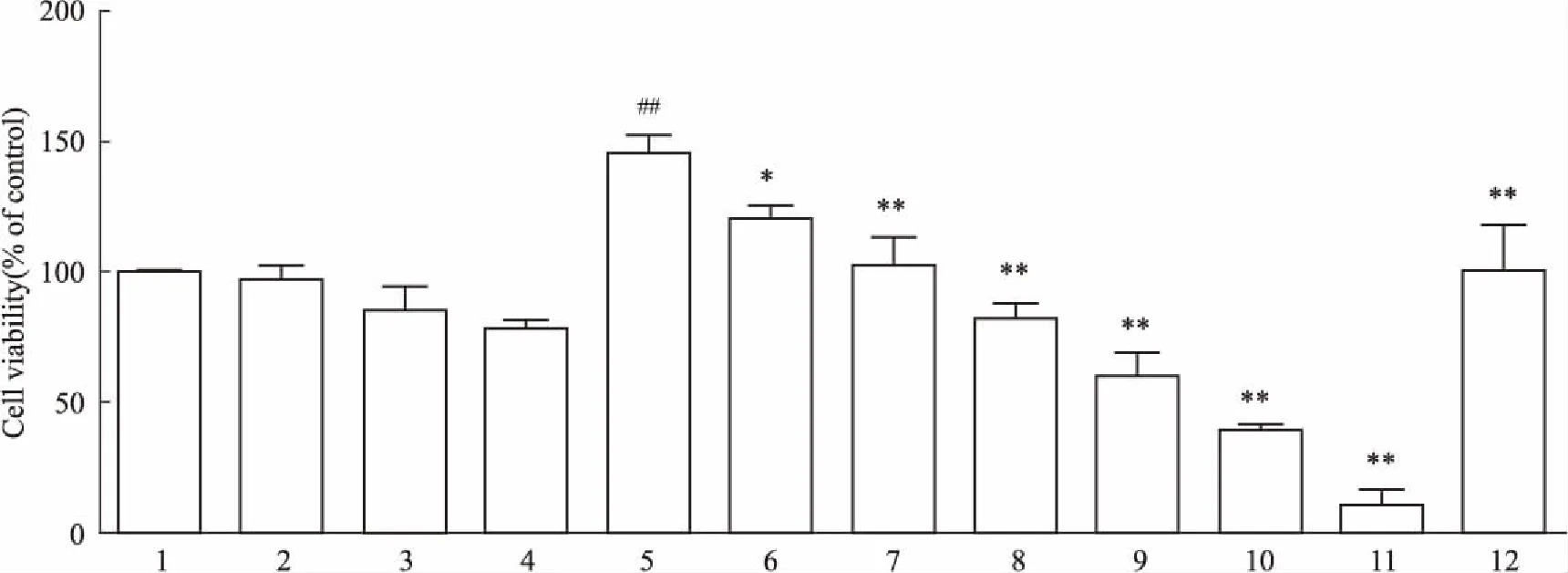
Fig 4 Effect of PLB on viability of RA
1:Control group;2:0.5 μmol·L-1PLB;3:1.5 μmol·L-1PLB;4:3.0 μmol·L-1PLB;5:Model group (1 mg·L-1LPS);6:LPS+0.5 μmol·L-1PLB;7:LPS+1.5 μmol·L-1PLB;8:LPS+3.0 μmol·L-1PLB;9:LPS+5.0 μmol·L-1PLB;10:LPS+7.5 μmol·L-1PLB;11:LPS+10 μmol·L-1PLB;12:LPS+MTX(1 mg·L-1).##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group.
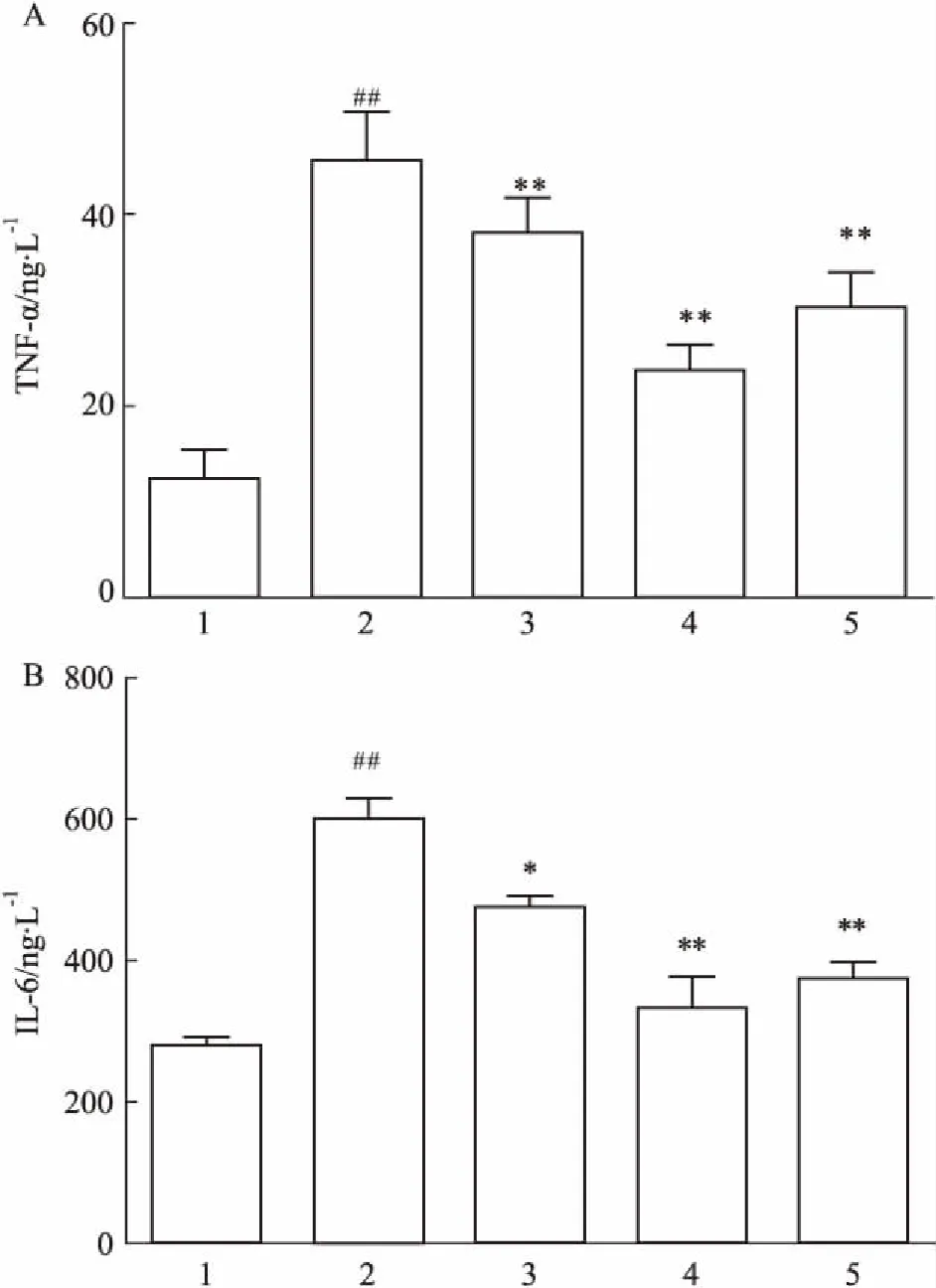
Fig 5 Inhibitory effect of PLB on LPS- induced TNF-α(A)and IL-6 (B) levels in RA
1:Control;2:Model;3:LPS+0.5 μmol·L-1PLB;4:LPS+3.0 μmol·L-1PLB;5:LPS+1.0 mg·L-1MTX.##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group.
3.5PLB对RAFLSs克隆形成能力的影响如Fig 6所示,以对照组细胞克隆形成能力为100%,模型组增殖能力增强,差异有统计学意义(P<0.01);与模型组相比,LPS+PLB处理组及LPS+MTX处理组细胞增殖能力明显降低(P<0.05)。
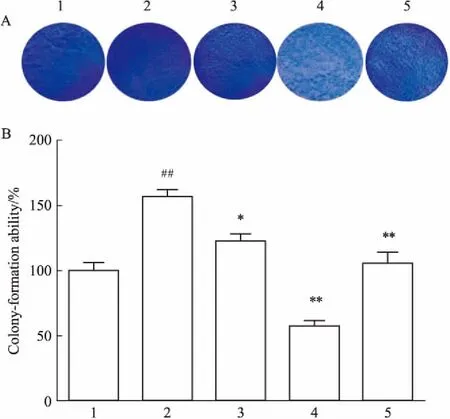
Fig 6 Effect of PLB on colony-formation ability
1:Control;2:Model;3:LPS+0.5 μmol·L-1PLB;4:LPS+3.0 μmol·L-1PLB;5:LPS+1.0 mg·L-1MTX. A:The density of RA FLSs captured by camera;B:Bar graph of proliferation rate in RA FLSs.##P<0.01vscontrol group;*P<0.05,**P<0.0 1vsmodel group.
3.6PLB对RAFLSs凋亡的影响Hoechst 33342染色时,一般正常细胞胞核在荧光显微镜下观察呈微弱淡蓝色荧光,凋亡细胞核呈致密浓染的亮蓝色荧光。如Fig 7所示,对照组FLSs核呈微弱荧光,模型组较对照组胞核荧光更弱,1 mg·L-1LPS+ PLB(0.5、3 μmol·L-1)组较模型组胞核荧光增强,且与PLB浓度呈正比;LPS+MTX处理组细胞核荧光较模型组增强。各组细胞凋亡率如Fig 8所示,与模型组相比,LPS+PLB组及LPS+MTX组细胞凋亡率明显增加,差异有统计学意义(P<0.01)。
3.7PLB对凋亡相关蛋白Bax、Bcl-2、cleavedcaspase-3表达的影响与对照组相比,模型组Bcl-2表达明显增多 (P<0.01),Bax、cleaved caspase-3表达水平差异无统计学意义(P>0.05)。与模型组相比,不同浓度PLB处理组及MTX处理组Bax、cleaved caspase-3蛋白表达增高,Bcl-2蛋白表达降低(P<0.05)。LPS+3 μmol·L-1PLB组较LPS+0.5 μmol·L-1PLB组Bax、cleaved caspase-3表达增多,Bcl-2蛋白表达降低。见Fig 9。
3.8PLB抑制JAK2/STAT3信号转导通路如Fig 10所示,与对照组相比,模型组p-JAK2、p-STAT3表达增多,差异有统计学意义(P<0.05)。与模型组相比,不同浓度PLB处理组及MTX处理组p-JAK2、p-STAT3蛋白表达降低(P<0.05)。LPS+3 μmol·L-1PLB组较LPS+0.5 μmol·L-1PLB组p-JAK2、p-STAT3蛋白表达降低。

Fig 7 Effects of PLB on nuclear morphometry change of RA FLSs(×200)
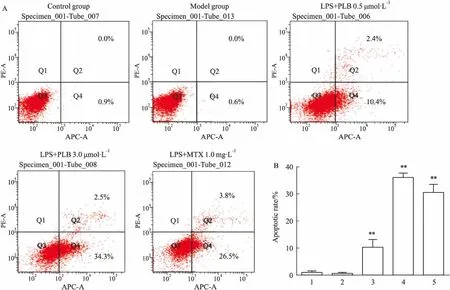
Fig 8 Effects of PLB on apoptosis of RA
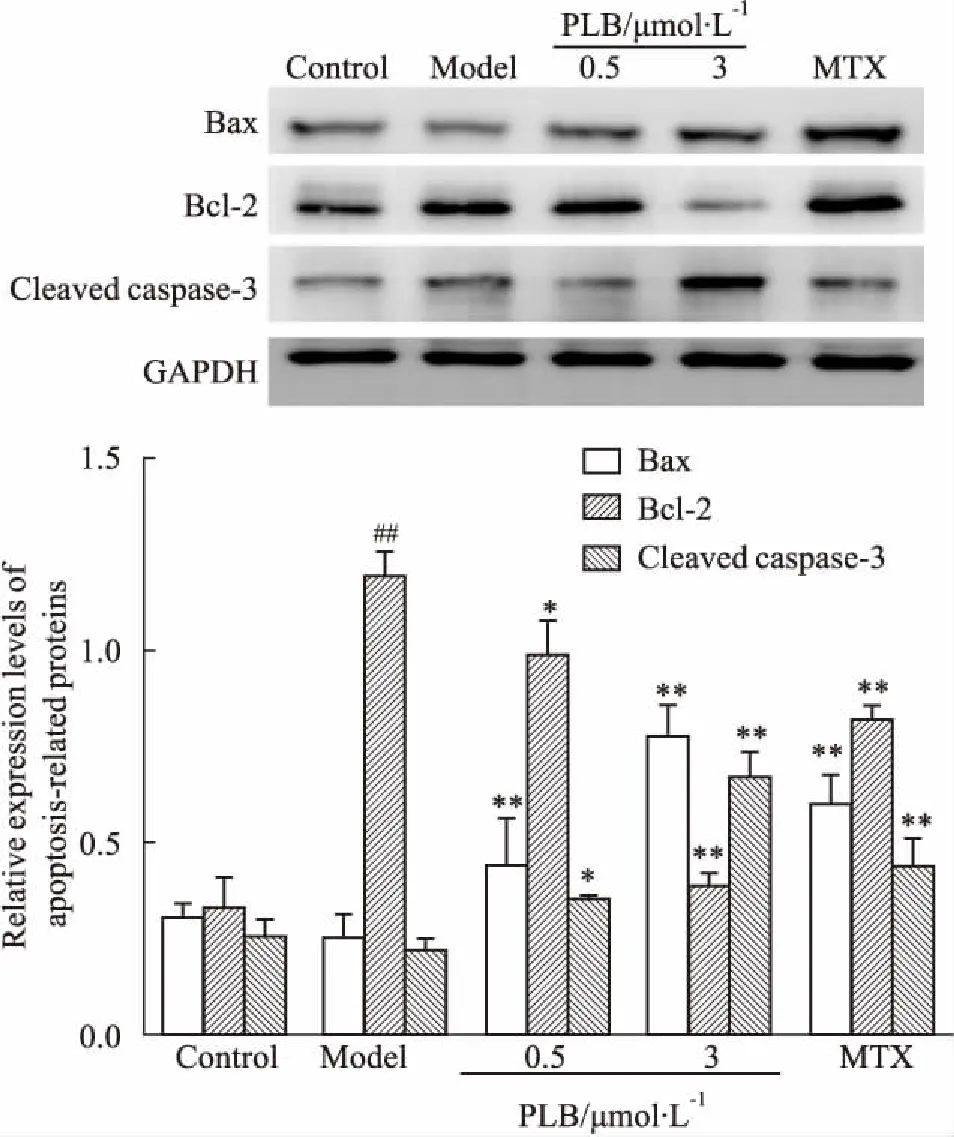
Fig 9 Effect of PLB on expression of Bax,Bcl-2 andcleaved caspase-3 proteins of RA
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group

Fig 10 Effect of PLB on expression of p-JAK2,p-STAT3proteins of RA
#P<0.05vscontrol group;*P<0.05,**P<0.01vsmodel group
4 讨论
RA作为一种临床比较常见的风湿性疾病,其病理改变为关节腔内滑膜炎、血管翳形成,滑膜细胞类肿瘤样增生,并能逐渐侵蚀关节软骨和骨,最终可能导致关节畸形和功能丧失[1]。正常人关节滑膜衬里层由1~2层滑膜细胞构成,而RA患者关节滑膜衬里层滑膜细胞可过度增殖成多层。滑膜细胞主要有FLSs及巨噬细胞样滑膜细胞,FLSs呈长梭形[9],FLSs为RA患者病程中的主要效应细胞[2]。因此,促进FLSs凋亡可以有效减轻RA患者的关节炎症状,延缓疾病进展,降低致残率。本研究细胞形态及细胞生物标记物鉴定结果显示,在体外分离培养RA患者关节内的FLSs呈长梭形,且第3代RA FLSs表达VCAM-1阳性,证实了本实验中所用细胞均为RA FLSs。本实验选用LPS处理RA FLSs以模拟细胞在患者体内的长期慢性炎症环境[10],ELISA检测结果显示,模型组炎症介质分泌较空白组增多,说明细胞造模成功,MTT和集落形成实验结果进一步显示,PLB能明显抑制LPS诱导后的RA FLSs的增殖活力,本研究均在此模型基础上进行。
目前已知的细胞凋亡通路有多种,线粒体在细胞凋亡中处于凋亡调控的重要位置。Bcl-2家族的凋亡相关蛋白,如Bcl-2、Bax、Bcl-xl等都定位于线粒体膜上,它们都能阻止或促进线粒体内Cyt C的释放,进而引发caspase级联反应,诱导细胞凋亡[11]。本研究Hoechst 33342染色实验结果证实,PLB能促进细胞核各种凋亡形态的产生,流式实验结果也显示,PLB能促进RA FLSs的凋亡。Western blot实验进一步说明,PLB能抑制RA FLSs中抗凋亡蛋白Bcl-2的表达,并使促凋亡蛋白Bax、凋亡下游执行因子cleaved caspase-3蛋白的表达增加,从而促进RA FLSs凋亡。
有研究表明,JAK/STATs信号通路是重要的细胞因子转导通路,也是人体内调节细胞增殖、分化、凋亡等许多生理和病理过程的共同通路之一。JAK/STATs信号通路被激活时,首先JAK蛋白相互磷酸化,再激活STATs蛋白,其中激活态的p-STAT3蛋白有明显抑制FLSs、巨噬细胞凋亡的作用,与其最密切的上游蛋白即为JAK2[12-14]。经证实,在体外培养的 RA FLSs中,JAK/STATs信号通路被大量激活,Bcl-2处于高表达的状态,Bax、cleaved caspase-3均处于低表达水平,在特异性阻断STAT3通路后,Bcl-2基因及蛋白水平明显降低,Bax、cleaved caspase-3表达水平相应上升[15],因此,抑制JAK2/STAT3通路可以促进RA FLSs的凋亡。本研究发现,PLB处理RA FLSs细胞后,p-JAK2、p-STAT3蛋白量明显降低,说明PLB能明显抑制JAK2/STAT3信号通路的传导。
综上所述,本实验证明PLB对RA FLSs有促凋亡作用,其机制可能与抑制JAK2/STAT3信号通路有关,并进一步证实了PLB对RA的治疗价值。本研究只说明了PLB能够抑制JAK2/STAT3信号通路,并通过降低Bcl-2蛋白的表达,促进RA FLSs凋亡,其中具体的联系还有待进一步研究。目前,已有很多PLB应用于其他肿瘤疾病及关节炎的动物体内研究,为下一步探讨PLB作用于RA的信号通路研究提供了指导。
(致谢:本实验于锦州医科大学附属第一医院骨科实验室完成,感谢实验室老师和同学的指导和帮助!)