环氧化酶-2与骨形态发生蛋白9诱导血管平滑肌钙化的关系研究
廖云鹏,何 芳,江 芬,4,王 涵,朱茄慧,马 妍,胡 莹,李福书,李 沁,周 娅,何百成
(1. 重庆市生物化学与分子药理学重点实验室;2. 重庆医科大学药理学教研室;3.重庆医科大学附属第一医院肾内科,重庆 400016;4. 湖北省蕲春县人口和计划生育服务中心,湖北 蕲春 436300)
慢性肾脏病(chronic kidney disease,CKD)是引起心血管相关疾病发病率和病死率升高的重要原因之一。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)钙化是CKD的并发症之一,该过程可能是由高钙和(或)高磷引起[1-2]。文献报道,高磷诱导血管钙化的作用与促进细胞凋亡和成软骨分化有关[3]。参与该病理过程的信号包括BMPs/Smads、Wnt/β-catenin信号等[4]。血管钙化和骨形成有很多相似之处,BMPs属于TGF-β超家族成员,对骨发生、发育和骨折愈合具有重要调节作用,目前发现20余种BMPs。其中,BMP2和BMP7具有成骨分化诱导能力,已被FDA批准用于脊柱融合以及骨移植的融合治疗[5]。 BMP9与BMP2具有相似的成骨诱导作用,且诱导成骨分化能力明显强于BMP2[6]。文献报道,BMP9可通过ALK1依赖的方式诱导VSMCs钙化[7]。但是,在血管钙化过程中,BMP9与磷酸盐的关系以及BMP9诱导血管钙化的详细机制并不明确。环氧酶-2(cyclooxygenase-2, COX-2)作为一种促炎因子,是前列腺素合成的限速酶。此外,COX-2也参与骨折愈合以及干细胞骨分化的调节。研究显示,敲除COX-2能引起骨折愈合延迟,COX-2抑制剂能够减轻临床外科手术术后的异位骨化[8]。BMP9在诱导间充质干细胞(mesenchymal stem cells, MSCs)骨向分化时,能促进COX-2表达[8]。因此,COX-2可能对VSMCs钙化有促进作用。但也有相关研究显示,抑制COX-2能促进VSMCs钙化,即COX-2可能具有降低血管钙化的作用[9]。这种现象可能与所用细胞和诱导因子的不同,以及微环境有关。但是,COX-2在VSMCs钙化中的作用需要进一步明确。本研究主要探索BMP9与高磷诱导VSMCs钙化的关系, COX-2与BMP9诱导VSMCs钙化的关系,以及可能的分子机制。
1 材料与方法
1.1材料
1.1.1实验动物 ♂ SD大鼠购自重庆医科大学动物实验中心,合格证号:SCXK (渝) 2017-0001。所有的动物实验均符合重庆医科大学医学科学院实验动物研究所实验动物使用与管理委员会规定。
1.1.2试剂 所用一抗均购自圣克鲁斯生物技术公司(Santa Cruz);COX-2抑制剂(NS-398)购自Sigma-Aldrich公司。
1.1.3仪器 细胞培养箱(美国Thermo公司);倒置荧光显微镜(日本Nikon公司);定量PCR仪及凝胶成像仪(美国Bio-Rad公司);电泳仪、垂直电泳槽、湿式转膜仪(北京六一仪器厂)。
1.2原代大鼠VSMCs的分离与培养用颈椎脱臼法处死大鼠,取主动脉血管,小心地去除内层和外层血管平滑肌,收集中层平滑肌并切分成小部分,在DMEM培养基中培养。将VSMCs培养在含有10%胎牛血清、100 kU·L-1青霉素以及100 μg·L-1链霉素的高糖DMEM中。培养条件为37℃、5% CO2。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是VSMCs的特异性标志物,提取的原代细胞经α-SMA免疫荧光检测,超过90%的细胞为VSMCs。本实验所用的细胞为第3~8代。
1.3重组腺病毒BMP9、COX-2、绿色荧光蛋白载体(GFP)构建重组腺病毒采用AdEasy系统构建。用PCR将BMP9、COX-2以及GFP编码序列扩增,然后克隆到穿梭载体上。然后将穿梭质粒与AdEasy-1质粒在BJ5183细菌中进行重组。最后将重组好的质粒线性化,并转染到HEK293细胞进行重组腺病毒包装。重组GFP腺病毒作为载体对照。研究BMP9对VSMCs及离体器官培养影响时,用低、中、高BMP9腺病毒(AdBMP9)滴度处理。
1.4总RNA提取、cDNA制备及PCR实验总RNA用TRIzol提取,采用逆转录反应将RNA逆转录成cDNA。所得产物稀释5~10倍作为real-time PCR的模板。所有的结果都使用GAPDH作为内参。每组实验重复3次。本实验所用引物序列见Tab 1。

Tab 1 The primer sequences used for this investigation
1.5蛋白免疫印迹实验将细胞种于6孔板中,按实验设计加入相应处理因素。在相应的时间点裂解细胞,并煮沸10 min。将样品在SDS-PAGE中分离后,转移到聚偏氟乙烯膜上,用10%的脱脂奶粉封闭。用相应的一抗和二抗分别进行孵育,最后用超敏ECL化学发光法测定靶蛋白表达情况。每组实验重复3次。
1.6茜素红染色实验将细胞种于24孔板,按实验设计加入相应处理因素,14 d后进行检测。染色过程简述如下:将细胞用0.05%的戊二醛在室温固定10 min,然后用PBS洗2次。最后用0.4%茜素红染料孵育5 min,小心洗去染料。茜素红的定量分析采用10%乙酸溶解,吸光度测定波长为405 nm。 每组实验重复3次。
1.7主动脉环器官离体培养胸主动脉取自♂ SD大鼠,将血管切割成2~3 mm厚度的动脉环,在DMEM培养基中培养24 h后达到稳定状态。用AdGFP、AdBMP9、NS-398和(或)AdBMP9处理主动脉环7、14 d。标本用10%褔尔马林固定后,用石蜡包埋、切片,进行组织化学染色。每组实验重复3次。
1.8VonKossa染色石蜡包埋的主动脉切片在紫外光下2%硝酸银处理60 min,用双蒸水清洗5 min;然后用5%硫代硫酸钠处理2 min,再用双蒸水清洗5 min,苏木精伊红复染1~2 min。乙醇脱水后,用二甲苯透明处理,最后进行封片,并在显微镜下拍照。每组实验重复3次。
2 结果
2.1磷与VSMCs钙化的关系Fig 1免疫荧光检测结果显示,超过90%的细胞α-SMA表达阳性。蛋白印迹的结果显示,磷酸盐一方面下调α-SMA表达,另一方面则增加Runx2、骨桥蛋白(osteopontin, OPN)、骨钙素(osteocalin, OCN)的表达。茜素红染色结果显示,磷酸盐明显诱导VSMCs矿化。以上结果进一步证实,高浓度磷酸盐可诱导VSMCs钙化。
2.2高磷对VSMCs中BMP9表达的影响Fig 2的Western blot结果显示,高磷能上调BMP9在VSMCs中的表达。Real-time PCR结果显示,高表达BMP9能上调Runx2、Dlx-5、碱性磷酸酶(alkaline phosphatase,ALP)的mRNA水平,但降低SM22α的水平。以上结果提示,BMP9可能参与磷酸盐诱导VSMCs钙化的过程。
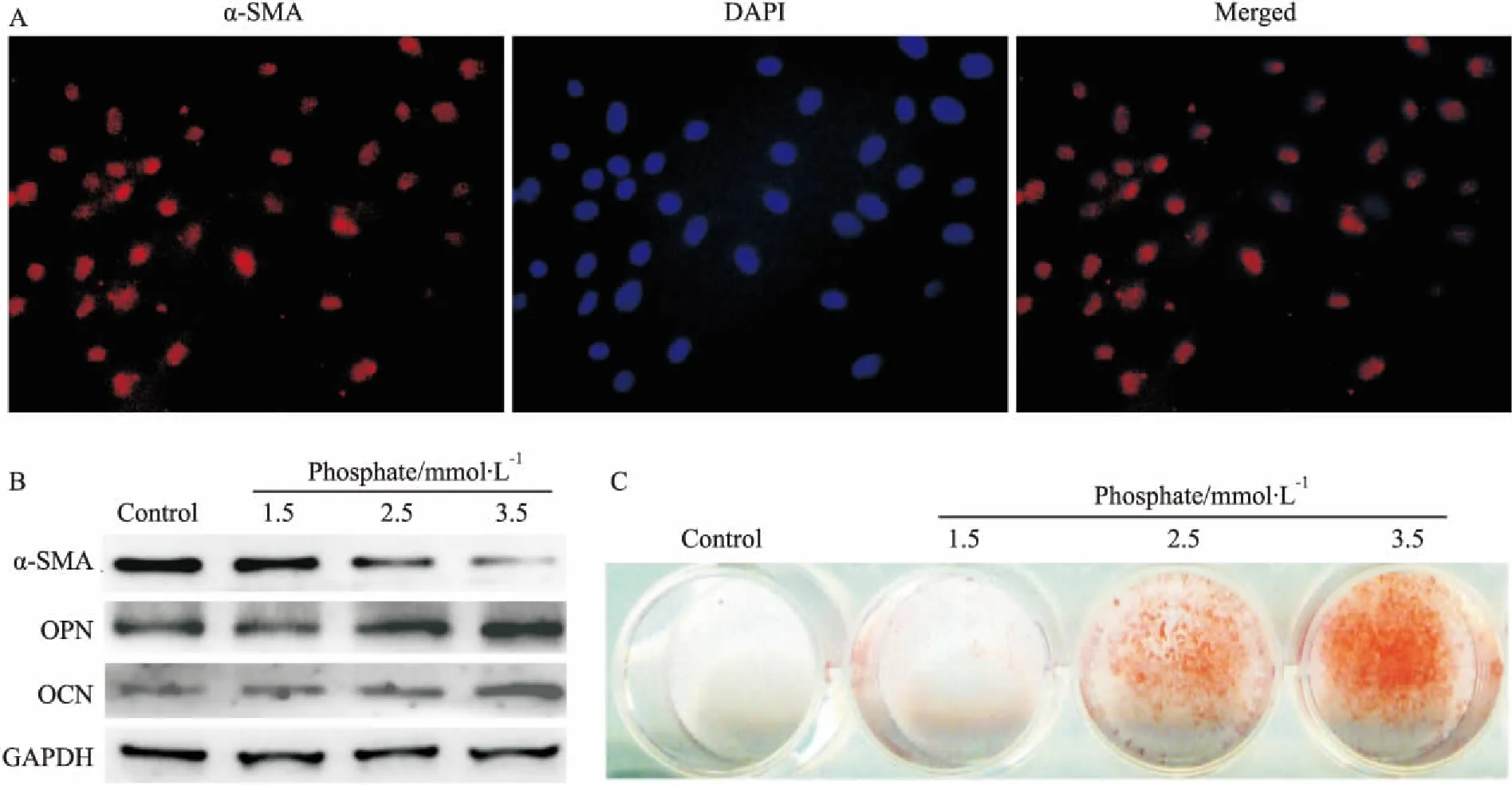
Fig 1 Effects of phosphate on inducing calcification in VSMCs
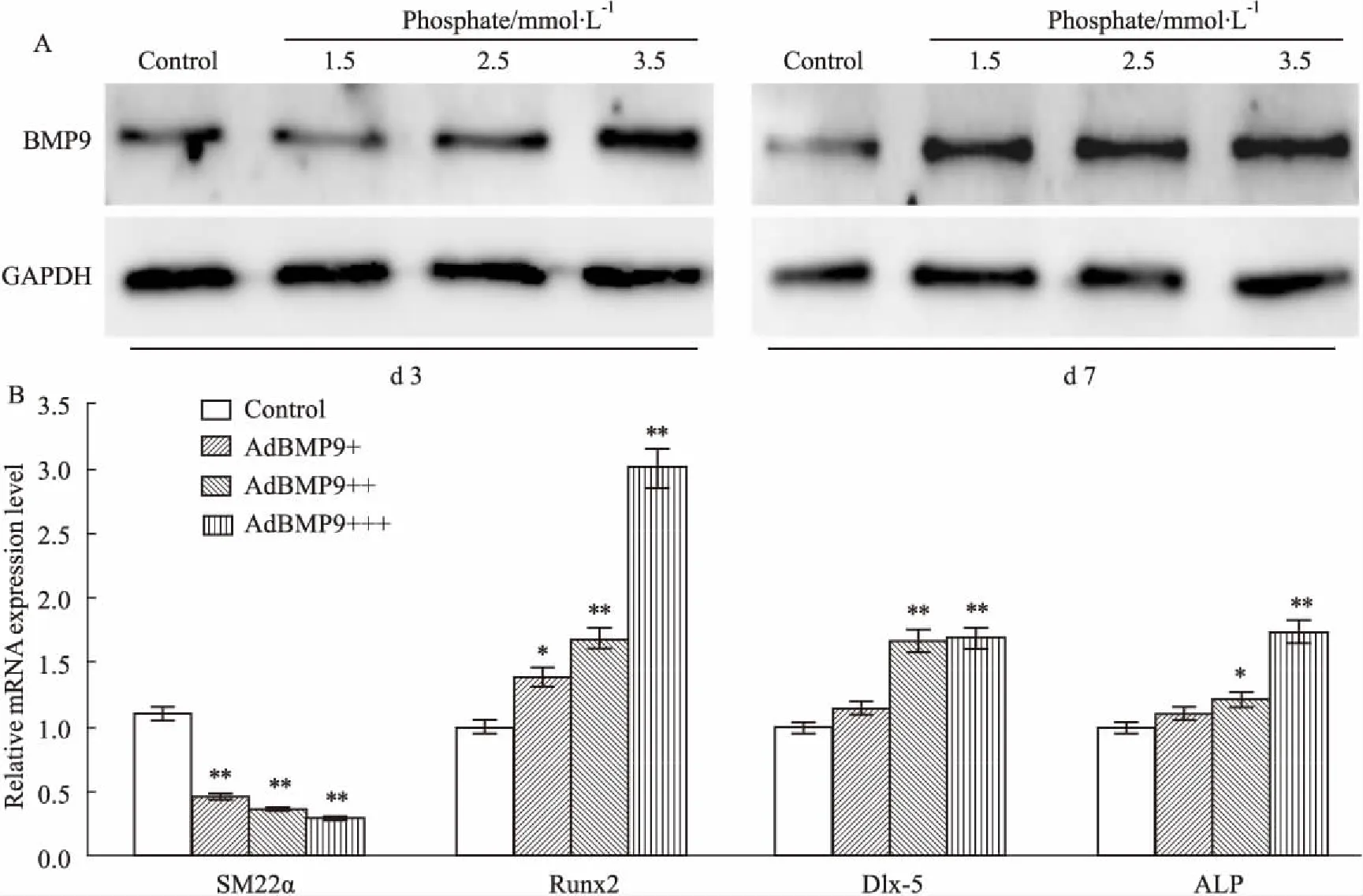
Fig 2 Effects of BMP9 on expression of early osetogenic markers in VSMCs
2.3BMP9对VSMCs与胸主动脉钙化的影响Fig 3的Western blot分析结果显示,过表达BMP9能上调OPN和OCN的水平,但降低α-SMA的蛋白水平。同时,BMP9也能直接在VSMCs中明显诱导矿化。ALK2突变能明显降低BMP9在VSMCs中诱导钙盐沉积的能力。主动脉环硝酸银染色结果显示,过表达BMP9也能明显促进血管平滑肌钙化。以上结果提示,BMP9能诱导血管钙化,但具体机制还不清楚。
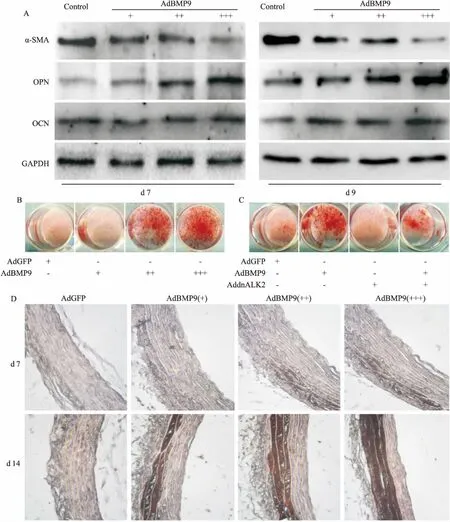
Fig 3 Effects of BMP9 on calcification in VSMCs and thoracic aorta
2.4磷酸盐对VSMCs中COX-2表达的影响Fig 4的Western blot分析结果显示,磷酸盐呈浓度依赖性上调COX-2水平。同时,BMP9也能明显增加COX-2在VSMCs中的水平。以上结果提示,COX-2可能也参与血管钙化的过程。
2.5COX-2对BMP9诱导VSMCs与胸主动脉钙化的影响Fig 5的Western blot分析结果显示,过表达COX-2能增强BMP9下调α-SMA和促进OPN与OCN表达的作用;COX-2抑制剂(NS-398)能减弱BMP9下调α-SMA和促进OPN与OCN表达的作用。茜素红染色结果显示,BMP9能明显诱导VSMCs钙化,但NS-398可明显减弱BMP9的这种作用。以上结果表明, COX-2可能参与介导BMP9诱导VSMCs钙化的作用。
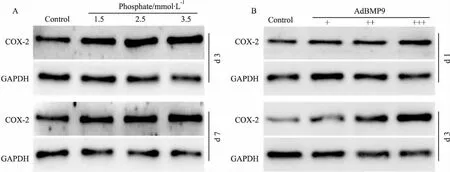
Fig 4 Effects of phosphate on expression of COX-2 in VSMCs
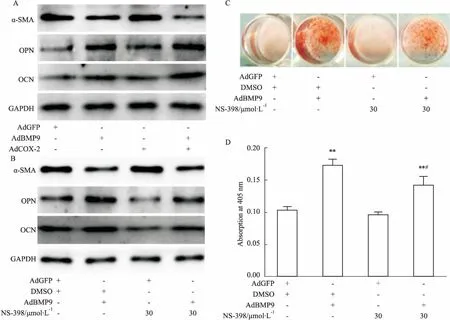
Fig 5 Effects of COX-2 on BMP9-induced calcification in VSMCs and thoracic aorta
3 讨论
血管钙化是CKD的主要并发症之一,但VSMCs钙化的具体分子机制迄今仍不明确。本研究证实,磷酸盐能诱导VSMCs钙化并促进BMP9的表达; 同时,BMP9能直接诱导VSMCs钙化,磷酸盐及BMP9均能诱导COX-2表达,且COX-2可能参与介导BMP9诱导VSMCs钙化的作用。
来自血管壁的VSMCs可以分化为成骨样细胞[10],这一过程可能与BMPs/Smads和Wnt/β-catenin信号活性增加有关[11],也提示高磷诱导VSMCs血管钙化可能也与上述因素有关。BMPs作为促进骨发育和骨折修复的因子,能诱导干细胞骨向分化,其中BMP2和BMP7已经被证实参与血管钙化的过程[12]。BMP2能增加血液中磷酸盐水平,并参与RANKL促进VSMCs钙化的过程。出生以后,BMP7主要在肾脏中表达,并参与调控骨重建和VSMCs的表型;同时,BMP7的多态性对血管钙化也存在不同的影响[13]。BMP9是目前研究相对较少的BMP成员,但其诱导MSCs骨向分化的能力明显强于其他BMPs。据报道,BMP9可通过经典BMPs/Smads和非经典BMPs/Smads信号发挥作用,其受体可能主要是ALK1和ALK2[14]。BMP9除能诱导MSCs骨向分化外,还可经ALK1依赖的方式诱导VSMCs钙化。但是,高磷酸盐诱导VSMCs钙化是否与BMP9有关,目前尚不清楚。本研究结果显示,磷酸盐以浓度依赖性方式增加BMP9在VSMCs中表达。过表达BMP9能诱导VSMCs钙化,并降低α-SMA的水平;ALK2突变明显降低BMP9在VSMCs中诱导钙盐沉积的能力。结果表明,高磷酸盐诱导VSMCs钙化与促进BMP9表达有关,BMP9本身可以通过依赖ALK1和ALK2的方式诱导VSMCs钙化。但是,BMP9诱导VSMCs钙化的具体机制仍不清楚。
炎症与多种疾病有关,包括血管平滑肌钙化。一些炎症因子也参与VSMCs钙化的过程,如肿瘤坏死因子-α(TNF-α)。高磷水平可以诱导血管平滑肌钙化,同时也可以激活炎症系统。COX-2是主要的炎症诱导因子之一,其抑制剂在临床上作为抗炎镇痛和解热药物使用。但是,磷酸盐诱导血管钙化与COX-2的关系目前还尚不明确。我们前期的研究显示,在MSCs骨向分化的过程中,BMP9能明显上调COX-2表达;沉默或抑制COX-2能明显减弱BMP9诱导MSCs骨向分化的作用[8]。因此,我们推测在VSMCs中,高磷促进BMP9表达的同时,也会上调COX-2,且COX-2可能也参与BMP9诱导的VSMCs钙化。研究结果显示,高磷能增加COX-2的表达;在VSMCs细胞中,过表达COX-2能促进BMP9诱导的成骨指标表达;相反,COX-2抑制剂则明显减弱BMP9的这种作用。但是,也有研究表明COX-2有逆转血管钙化的功能[15]。COX-2对钙化的不同影响可能与诱导因子的不同、抑制剂的浓度以及微环境不同有关。
本研究显示,高磷酸盐诱导VSMCs钙化与促进BMP9表达有关;同时,BMP9能诱导VSMCs钙化,该作用可能与上调COX-2表达有关。结果提示,非甾体类药物可能在临床对血管钙化具有一定的预防作用。
[致谢:本研究的主要工作完成于重庆市生物化学与分子药理学重点实验室,课题组感谢芝加哥大学医学中心何通川教授(T.C. He)为本研究提供重组腺病毒。]