化学实验的跨接思维——定量实验
李宏华
北京
定量实验在近几年的高考命题中异军突起,2017年的全国卷Ⅰ、全国卷Ⅱ、全国卷Ⅲ、北京卷、天津卷等都考查了定量实验。定量实验是将化学实验与化学计量有机地结合在一起测定物质化学组成与含量的探究性实验,是近几年高考的常考题型。命题设计中先通过实验测出相关的有效数据,然后经计算得出物质的组成与含量。定量实验目的性、实用性强,能给予出题人较大的创造空间。复习过程中教师要注重定性实验拓展到定量实验的探讨。随着理科综合能力测试对定量思维能力以及实验设计能力要求的提高,预计今后的高考试题中对实验的考查会在定性实验的基础上渗透定量要求甚至直接要求进行定量实验设计。
一、定量实验所涉及的范围
定量实验是中学化学的重要实验,主要有一定物质的量浓度溶液的配制、中和滴定(包括滴定曲线)、中和热测定等。从中学化学实验和高考实验考查的要求来看,定量实验主要有以下几种类型:①确定物质组成与含量的定量实验,如确定物质化学组成(确定化学式)、测量物质中某组分的质量分数等实验;②测量某溶液的浓度(溶质质量分数、物质的量浓度等)的定量实验,如中和滴定实验;③测量某些化学计量的定量实验,如测定某分子(或原子)的相对分子(原子)质量、阿伏加德罗常数等实验;④研究反应热效应的定量实验,如教材中关于中和热测定实验;⑤研究物质(分子)结构的定量实验,如有机物分子结构确定的实验。
二、定量实验应试策略
1.定量实验的方案设计
定量实验是在定性实验基础上为研究某些量及相关量间关系而展开的,因此能力要求和试题难度等将有所提升。如何有效地进行定量实验方案的设计呢?为明确定量实验设计的解题关键,先回顾一下中和滴定实验:

定量实验待测量实验原理可测量中和滴定实验酸或碱等溶液的物质的量浓度利用酸碱中和时反应物间物质的量的关系,用已知物质的量浓度的酸(碱)来测定未知碱(酸)的物质的量浓度待测液的体积和反应中消耗的标准液的体积
根据上述分析可知,待测量必须通过某种化学原理,寻求在限定实验条件下可测的关系量(即“可测量”),利用两者间量的关系计算而得。因此,确定可测量并准确予以测定便成为定量实验的关键。
2.测量数据的注意事项
明确可测量范围及测定方法,同时掌握减小实验误差的方法,定量实验设计问题就会迎刃而解,并获得较高的精确度。
常见的定量测定实验包括混合物成分的测定、物质纯度的测定以及化学式的确定等。该类试题常涉及物质的称量、物质的分离与提纯、滴定、一定物质的量浓度溶液的配制等实验操作。
三、实验数据筛选与处理策略
对实验数据筛选的一般方法和思路为“五看”:
一看数据是否符合测量仪器的精确度,如用托盘天平测得质量的精确度为0.1 g,若精确度值超过了这个范围,说明所得数据无效;
二看数据是否在误差允许范围内,若所得的数据明显超出误差允许范围,要舍去;
三看反应是否完全,是否是足量反应物作用下所得的数据,只有完全反应时所得的数据才能应用;
四看所得数据的测量环境是否一致,特别是气体体积,只有在温度、压强一致的情况下才能进行比较、运算;
五看数据测量过程是否规范、合理,错误和违反测量规则的数据要舍去。
四、高考命题中定量实验的高频考点
高频考点一:考查计量仪器的特点和使用
高考中对定量实验涉及的计量仪器的考查主要包括托盘天平、量筒、容量瓶、滴定管、温度计和pH试纸等,从考查的要求看,主要是识记层次,考查学生对常见计量仪器的结构、用途、读数和使用方法的认识。
【例1】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):
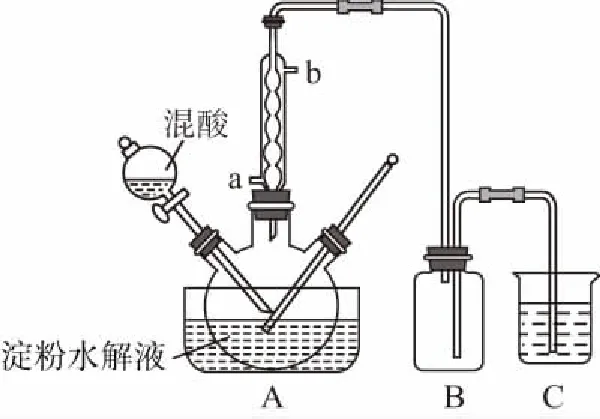
实验过程如下:
①将1∶1的淀粉水解液与少许质量分数为98%硫酸加入烧杯中,水浴加热至85~90℃,保持恒温30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为4∶3)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:



请回答下列问题:
(1)冷凝水的进口是________(填“a”或“b”)。
(2)装置B的作用为__________________。



【答案】(1)a(2)作安全瓶 (3)无色 浅紫色 84.0%
高频考点二:定量实验的基本操作
现行高中教材中通过配制一定物质的量浓度的溶液、酸碱中和滴定等基本定量实验的完成,都是基本操作技能的训练。
【例2】三草酸合铁酸钾是一种重要的光敏材料和有机反应的催化剂,化学式为K3[Fe(C2O4)3]·3H2O,为翠绿色晶体,溶于水,难溶于乙醇。110℃下失去三分子结晶水,230℃时分解。该配合物对光敏感,光照下即发生分解。
Ⅰ.三草酸合铁酸钾的制备
①溶解:在托盘天平上称取4.0 g FeSO4·7H2O晶体,放入250 mL烧杯中,加入1 mL 1 mol·L-1H2SO4溶液,再加入H2O 15 mL,加热使其溶解;
②沉淀:在上述溶液中加入1 mol·L-1H2C2O4溶液20 mL,搅拌并加热煮沸,使形成FeC2O4·2H2O黄色沉淀,用倾斜法倒出清液,洗涤该沉淀3次以除去可溶性杂质;
③氧化:在上述沉淀中加入10 mL饱和K2C2O4溶液,水浴加热至40℃,滴加3%H2O2溶液20 mL,不断搅拌溶液并维持温度在40℃左右,使Fe2+充分氧化为Fe3+。滴加完后,加热溶液至沸腾以除去过量的H2O2;
④生成配合物:保持上述沉淀近沸状态,趁热滴加1 mol·L-1H2C2O4使沉淀溶解至呈现翠绿色为止。冷却后,加入15 mL 95%的乙醇水溶液,在暗处放置,结晶。减压过滤,抽干后用少量乙醇洗涤产品,继续抽干,称量,计算产率,并将晶体放在干燥器内避光保存。

请回答下列问题:
(1)步骤①溶解时应加入少量的稀硫酸,目的是__________________
__________________。
(2)步骤②要维持微沸几分钟,但FeC2O4·2H2O晶体易暴沸,则适宜采取的加热方式是________。
(3)生成的FeC2O4·2H2O晶体上易沾有硫酸盐,如何证明晶体已洗涤干净?________。
(4)步骤③需保持恒温40℃,原因是__________________。
(5)用乙醇洗涤的作用是__________________。


【答案】(1)防止Fe2+的水解 (2)沸水浴加热 (3)取最后一次洗涤液少许于试管中,加入BaCl2溶液,若没有白色沉淀产生,则证明晶体已洗涤干净 (4)温度太低,Fe2+氧化速度太慢;温度太高,易导致H2O2分解,影响Fe2+氧化结果 (5)加入乙醇降低溶解度,有利于产品结晶析出 (6)溶液变为浅红色,且半分钟不褪色 55%。
高频考点三:重量分析法
重量分析法就是根据可测量物的重量来确定被测物质组分含量的方法,一般是先使被测组分从试样中分离出来,转化为一定的称量形式,然后用称量的方法测定该成分的含量。根据被测成分与试样中其他成分分离的不同途径,通常应用的重量分析法又分为沉淀法、气化法等。


回答下列问题:
(1)a的作用是__________________。
(2)b中放入少量碎瓷片的目的是________。f的名称是________。
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是_____________________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是__________________。
②e中主要反应的离子方程式为 ___________________,e采用中空双层玻璃瓶的作用是__________________。
(5)取某甘氨酸(C2H5NO2)样品m克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸VmL,则样品中氮的质量分数为________%,样品的纯度≤________%。

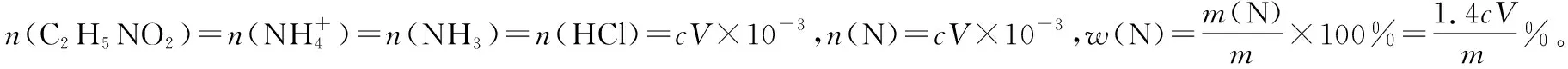
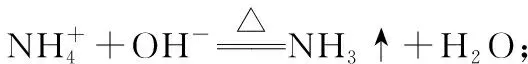
高频考点四:滴定分析法
滴定分析法是传统化学分析法中重要的分析方法之一,是将一种已知其准确浓度的试液滴加到未知物质的溶液中,通过指示剂的变化判断反应完全时,根据所用试剂的浓度和体积求得被测组分的含量。滴定分析法要求发生的反应要完全、反应速率要快、要选择恰当的指示剂。
【例4】(2017天津卷)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.025 0 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1NH4SCN标准溶液,放在棕色试剂瓶中避光保存,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:

实验序号123消耗NH4SCN标准溶液体积/mL10.2410.029.98
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是__________________。
(3)滴定应在pH<0.5的条件下进行,其原因是__________________________________。
(4)b和c两步操作是否可以颠倒?________,说明理由:__________________。
(5)所消耗的NH4SCN标准溶液平均体积为______mL,测得c(I-)=______mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为__________________。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”“偏低”或“无影响”):
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果________。
【解析】(5)根据所提供的三组数据,第一组数据误差较大,舍去,二、三两组数据取平均值即可,所以所消耗的NH4SCN标准溶液平均体积为10.00 mL,测得c(I-)=0.060 0 mol·L-1。(6)在滴定管中装入NH4SCN标准溶液前应用NH4SCN标准溶液进行润洗。(7)①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,造成溶质减少,所配制AgNO3标准溶液浓度偏低,则测定结果偏高。②若在滴定终点读取滴定管刻度时,俯视标准液液面,造成读数偏小,则测定结果偏高。


