江苏省学业水平测试“实验计算综合题”试题评析
王建华
江苏
江苏省化学学业水平测试中实验计算综合题模块(第26题),题型传统,但考查角度灵活,有创新,近年来主要以实验流程为载体考查实验技能、信息素养、数据处理和运用化学原理解决实际问题的能力。本文仅对该题近九年的分析和归纳,从中能发现一些命题规律,找出一些答题方法,提出对此题的复习方向。
一、2009年至2017年实验计算综合题考查统计
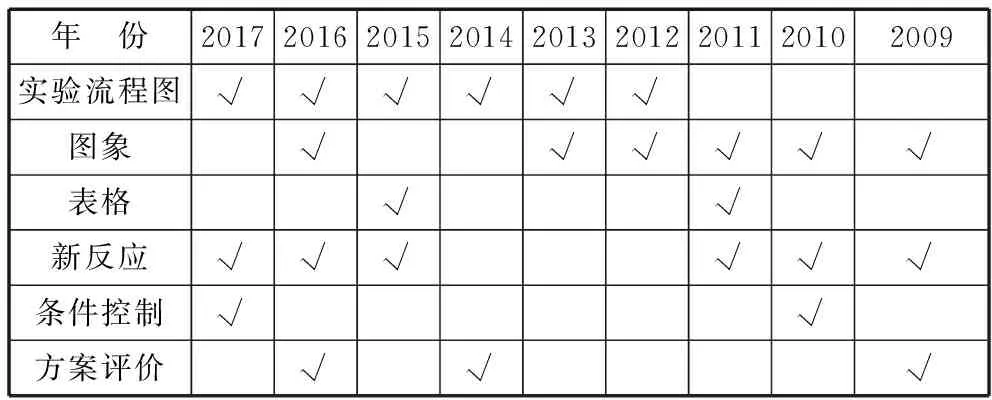
年 份201720162015201420132012201120102009实验流程图√√√√√√图象√√√√√√表格√√新反应√√√√√√条件控制√√方案评价√√√
基于以上分析,教师应着力培养学生以下基本能力:
(1)信息加工能力:流程解读,化学曲线解读,实验数据解读,陌生转化关系解读;
(2)实验探究能力:实验目的分析,实验条件控制,实验方案评价;
(3)证据推理能力:依据反应规律推理,依据化学图表推理,依据实验数据推理。
二、实验条件控制
从近几年试题考查来看,实验条件的控制多数为温度、pH和投料控制,答题的一般思路如下:
1.温度控制
温度可以影响反应速率,反应程度(浸出率),副反应,溶解度、挥发等方面,答题时多数从下面几个方面入手。
(1)温度控制在××℃以下。答题一般为温度过高,会××。
(2)温度控制在××℃以上。答题一般为温度过低,会××。
(3)温度控制在××℃~××℃。答题一般为温度过高,会××,温度过低,会××。
(4)温度控制的方法:反应体系插入温度计,水浴[热水浴、沸水浴、冰(冷)水浴],试剂加入速率(放热显著的反应)。
2.pH控制
pH一般影响反应速率,副反应,沉淀,促进或抑制物质的溶解(吸收)等方面,答题时多数从下面几个方面入手。
(1)加入××(试剂),调节pH至××。答题一般为使××离子完全沉淀。
(2)加入××(试剂),调节pH至××~××。答题一般为使××离子完全沉淀,同时保证××离子不沉淀。
(3)pH控制的方法:加入酸、碱、氧化物、碳酸盐等。
3.投料控制
(1)试剂过量。答题一般为使××充分反应;充分吸收××(气体)、充分溶解××(固体);提高××(物质或元素)浸出率。
(2)固体粉碎/液体喷雾。答题一般为增大接触面积,加快反应速率;增大接触面积,使××充分反应(溶解、转化)。
(3)气体流量/流向。控制流量,答题一般为使××充分反应(溶解、吸收);采用逆流,答题一般为延长××与××接触时间,使××反应(溶解、吸收、冷却)。
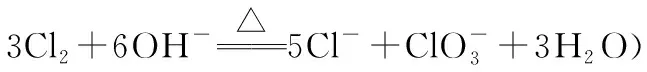

分析:由信息可知,反应温度不能高,所以要采用控制温度较低的方法,用冷水浴较好。
答案:将丙装置浸在盛有冷水的水槽中
三、物质的除杂、分离
1.关键词——沉淀
沉淀是否完全的判断:静置,往上层清液中滴加××(沉淀剂),若没有沉淀生成,则已沉淀完全。
沉淀洗涤的方法:向沉淀中加水至浸没沉淀,等水流出后,重复2~3次。
冰水洗涤的作用:降低沉淀或晶体在水中的溶解量。
挥发性的有机溶剂(例如酒精、乙醚)洗涤的作用:既能降低沉淀或晶体在水中的溶解量,又能快速干燥。
检验沉淀是否洗净的方法:取最后一次洗涤液少许于试管中,加入××溶液,若无沉淀生成,说明沉淀已洗涤干净。
2.关键词——结晶
缓升型(NaCl)——蒸发结晶,趁热过滤,洗涤,干燥;
陡升型(KNO3)——蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
结晶水合物——蒸发浓缩,冷却结晶,过滤,洗涤,干燥。
3.关键词——检验
答题顺序为操作→现象→结论。
答题一般为取待检液少许于试管中,滴加××,产生××现象,说明试样中含××。
例2某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:
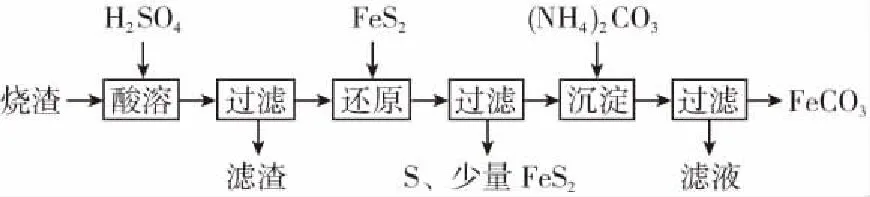
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:

(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为________。
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是___________________。“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 ________。

答案:(1)KSCN溶液 (2)取最后一次洗涤液少许放入试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,表明已洗涤干净,反之,则说明没洗干净 Fe(OH)3
四、陌生方程式的书写
一般书写步骤如下:
(1)根据流程信息写出关键性的反应物或生成物的化学式;
(2)根据守恒(电子、电荷、原子)完成方程式配平;
(3)完善书写细节(如反应条件、物质状态等)。
例3铁黑(Fe3O4)是常见的铁系颜料。一种制取铁黑的实验流程如下图所示:

制取铁黑的反应原理可表示为

(1)加入氨水调节pH至7~9时,发生反应的离子方程式为___________________。
分析:在“调节pH至7~9”这个环节注意物质的流入(FeSO4、NH3·H2O),所以反应物自然就确定了。

五、化学计算类型归纳
1.定量的反应物与变量的混合物计算(读表格)
例4某氮肥硫酸铵中混有硫酸氢铵。为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用。已知:


称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量。部分实验数据如下:
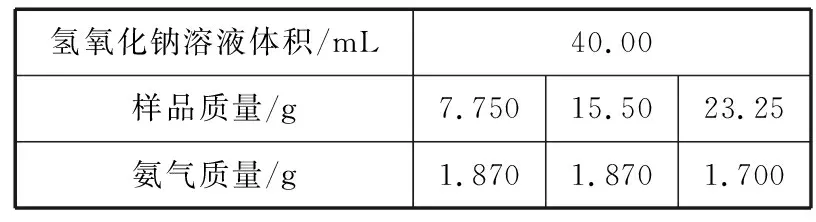
氢氧化钠溶液体积/mL40.00样品质量/g7.75015.5023.25氨气质量/g1.8701.8701.700
请计算(计算结果保留两位小数):
①样品中氮元素的质量分数是___________%。
②所用氢氧化钠溶液的物质的量浓度为___________mol/L。
③若样品质量为31.00 g,则生成氨气的质量为___________g。
分析:由表中数据可知,第一组实验中NaOH明显过量,第三组实验中NaOH明显不足。要计算样品中的有关组成,则要让样品完全反应,故以第一组实验计算;要计算有关NaOH,则要让NaOH完全反应,故以第三组实验计算。
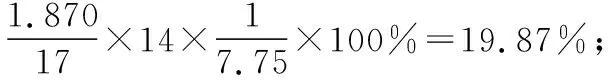
②以第一组实验,计算出样品中NH4HSO4和(NH4)2SO4的组成比例。设样品中NH4HSO4物质的量为xmol、(NH4)2SO4物质的量为ymol,根据关系式:NH4HSO4~NH3和(NH4)2SO4~2NH3,列方程组:
解得:x=0.01 moly=0.05 mol

先发生:

0.03 mol 0.03 mol 0.015 mol

0.10 mol 0.10 mol

③若样品质量为31.00 g(正好是第一组的4倍),可知NH4HSO4物质的量为0.04 mol,(NH4)2SO4物质的量为0.20 mol,NaOH量更不足了。据下列两个反应:
先发生:

0.04 mol 0.04 mol 0.002 mol
后发生:

(0.13-0.04) mol 0.09 mol
所以m(NH3)=0.09 mol×17 g/mol=1.53 g
答案:①19.87%;②3.25 mol/L;③1.53 g
点评:解答这种类型题目时要读懂表格上的数据,确定哪一组实验数据中哪一反应物是否过量。若要求某一反应物的组成时,一定要让该反应物全部反应完,才能计算。
2.方案评价类计算(含滴定)
例5国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,质量分数≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。
①方法Ⅰ:称取2.570 g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过滤、洗涤、干燥后称重,质量为4.660 g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)。
②方法Ⅱ:称取1.326 g产品,配成100 mL溶液。取25.00 mL该溶液,滴加0.125 0 mol·L-1I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00 mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)。
③判断Na2SO3产品的等级,并说明理由。

答案:①据比例Na2SO3~Na2SO4~BaSO4,2.570 g产品中
m(Na2SO3)=2.000×10-2mol×126 g/mol=2.520 g

②据比例Na2SO3~I2,25.00 mL溶液中
n(Na2SO3)=n(I2)=0.125 0 mol·L-1×0.020 L=2.500×10-3mol
1.326 g产品中Na2SO3的质量


点评:这种类型题目的特点是方案评价,解题的特点是理解题意,结合滴定反应方程式,列出反应比例,进而计算。类似的方案评价还有2014年的学测最后一题。


