右美托咪定对顽固性癌痛的镇静及镇痛效果观察
徐慧胜 徐 慧 王 建
晚期恶性肿瘤治疗的目的主要是减少痛苦,消除焦虑、恐慌等不良心理,改善患者的生存质量。癌痛是晚期恶性肿瘤常见症状,严重影响患者的身心健康,引发睡眠障碍,加重焦虑、烦躁等负性情绪,导致生存质量显著下降[1-2]。1982年,世界卫生组织(WHO)提出癌痛的三阶梯疗法,目前已经在世界范围内受到广泛认可。经三阶梯方案规范治疗后,80%以上的癌痛患者疼痛得到有效控制,但仍有部分患者疼痛不能缓解,称为难治性癌痛或顽固性癌痛[3]。阿片类药物是晚期癌痛患者最常使用的镇痛药物,但长期大量应用易引发一系列不良反应,导致患者耐受性下降[4]。为减少阿片类药物的不良反应,同时保证镇痛效果,临床在使用阿片类药物治疗的同时多联合其他药物治疗,其中右美托咪定应用十分广泛[5]。本研究在采用吗啡静脉自控镇痛(PCIA)的基础上联合小剂量右美托咪定,观察其对顽固性癌痛的镇静、镇痛作用,现报道如下。
1 临床资料
1.1 一般资料 2015年12月—2017年2月我院收治的顽固性癌痛患者60例,采用随机数字表法分为对照组30例,男17例,女13例;年龄35~84岁,平均(63.1±10.3)岁;平均口服盐酸羟考酮缓释片(80.52±10.46)mg,每 12h 1次;其中胃癌 7 例,肺癌7例,肝癌5例,直肠癌4例,卵巢癌3例,乳腺癌3例,胰腺癌1例。治疗组30例,男16例,女14例;年龄 34~85 岁,平均(61.8±9.6)岁;平均口服盐酸羟考酮缓释片(81.37±11.32)mg,每 12h 1 次;其中胃癌 8例,肺癌5例,肝癌4例,直肠癌5例,卵巢癌4例,乳腺癌4例。两组基线资料比较差异无统计学意义(P>0.05),具有可比性。本研究获医院医学伦理委员会批准。
1.2 纳入与排除标准 纳入标准:(1)经细胞学或病理检查确诊为晚期恶性肿瘤[6];(2)年龄>18 岁;(3)存在全身或广泛区域转移,无放化疗、手术指征;(4)预计生存期>1个月;(5)予口服盐酸羟考酮缓释片等药物三阶梯规范化治疗后效果不佳,即爆发痛>3次/天,疼痛数字评分法(NRS)≥4 分[6],(6)盐酸羟考酮缓释片口服剂量为60~100mg,每12h 1次,增加口服剂量,疼痛仍无法缓解[7];(7)临床表现为剧烈的腹部、胸部或盆腔疼痛;(8)对该研究知情,签署同意书。排除标准:(1)合并Ⅱ~Ⅲ度房室传导阻滞、心动过缓(心率<60 次/min)[8-9];(2)对吗啡或右美托咪定过敏;(3)合并严重全身系统性疾病;(4)合并精神异常、认知障碍等,不配合镇痛效果评估。
2 方法
2.1 治疗方法 采用临床上常用的首次量(负荷量)+背景剂量+自控给药行静脉自控镇痛。镇痛药配制方法:治疗组为盐酸吗啡注射液(东北制药集团沈阳第一制药有限公司,批号150609-1,规格1mL:100mg)1000mg+右美托咪定(江苏恒瑞医药股份有限公司,批号 15110132,规格 2mL:200μg)400μg+0.9%生理盐水(安徽双鹤药业有限公司,批号1510124K,规格250mL∶2.25g)200mL;对照组为盐酸吗啡注射液1000mg+0.9%生理盐水200mL。两组药物均使用自控镇痛泵(江苏人先无线镇痛泵系统REHN(11)-206,最小注射速度0.1mL/h)。首先根据患者口服药物剂量,换算出24h吗啡针剂总量(24h吗啡针剂总量≈50%盐酸羟考酮缓释片日口服剂量)[10],并据以上数据设置无线镇痛泵参数。具体参数:首次量为患者当日10%吗啡总剂量;背景输注剂量为当日吗啡针剂总量,以匀速输注;当爆发痛发生时,采用10%当日吗啡总剂量作为解救剂量,1h最大极量为30%当日吗啡总剂量。启动镇痛泵后,及时评估镇痛效果并调节输注参数。常规监测心电图、呼吸、血压、血氧饱和度等。当心率<50次/min时,给予硫酸阿托品注射液(天津金耀药业有限公司,批号1509221,规格1mL∶0.5mg)0.5mg静注;当血压降低>基础血压20%时,给予盐酸麻黄碱注射液(东北制药集团沈阳第一制药有限公司,批号151101-2,规格1mL∶30mg)5mg静注;当呼吸频率<10次/min或血氧饱和度<90%时,降低给药剂量或暂停给药、吸氧或给予辅助呼吸。
2.2 观察指标 (1)疼痛数字评分法(NRS)评价镇痛效果,总分 0~10 分,评分越高疼痛越显著[11]。(2)Ramsay评分[12]评价镇静效果,总分1~6分,1分为清醒,6分为过度镇静,强力摇动无反应,评分越高镇静越明显。(3)统计两组患者用药期间30min内入睡、觉醒>1次例数、爆发痛次数以及10d吗啡用量。(4)匹兹堡睡眠质量指数量表(PSQI)[13]评价睡眠质量,总分0~21分,评分越高睡眠越差。PSQI评分>7分表明存在睡眠障碍。(5)统计两组治疗10d内不良反应发生情况,如恶心呕吐、瘙痒、心动过缓、嗜睡等。
2.3 统计学方法 应用SPSS20.0软件处理数据,其中计数资料采用χ2检验,计量资料采用t检验,重复测量数据采用重复测量的方差分析。以P<0.05为差异有统计学意义。
3 结 果
3.1 两组患者给药前后各时点NRS评分比较 两组给药后 2、4、24、48h、10d NRS 评分较给药前均有显著降低(P<0.01),但两组组间比较差异无统计学意义(P>0.05)。见表 1。
表1 两组顽固性癌痛患者给药前后各时点NRS评分比较(分,±s)
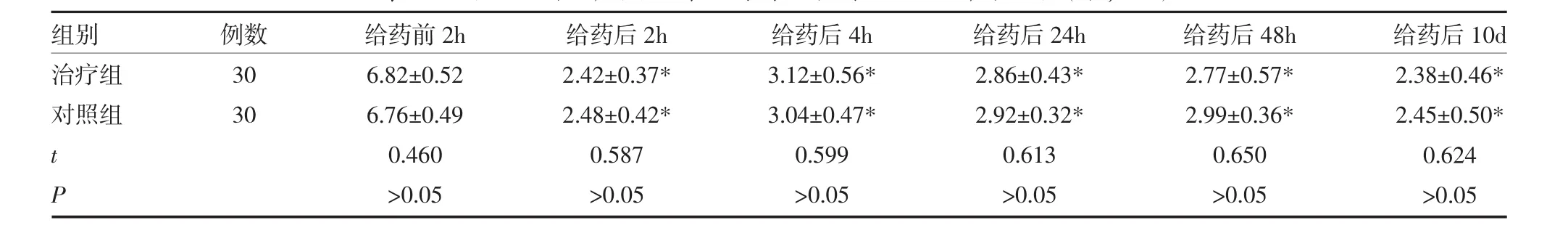
表1 两组顽固性癌痛患者给药前后各时点NRS评分比较(分,±s)
注:与治疗前 2h 比较,*P<0.01;NRS:疼痛数字评分法
组别治疗组对照组例数30 30 t P给药前2h 6.82±0.52 6.76±0.49 0.460>0.05给药后2h 2.42±0.37*2.48±0.42*0.587>0.05给药后4h 3.12±0.56*3.04±0.47*0.599>0.05给药后24h 2.86±0.43*2.92±0.32*0.613>0.05给药后48h 2.77±0.57*2.99±0.36*0.650>0.05给药后10d 2.38±0.46*2.45±0.50*0.624>0.05
表2 两组顽固性癌痛患者给药后各时点Ramsay镇静评分比较(分,±s)

表2 两组顽固性癌痛患者给药后各时点Ramsay镇静评分比较(分,±s)
注:与治疗前比较,*P<0.01
组别治疗组对照组给药前2.54±0.12 2.55±0.11 0.337>0.05例数30 30 t P给药后2h 2.25±0.18*1.79±0.34*6.549<0.01给药后4h 2.54±0.27 1.48±0.39*12.239<0.01给药后24h 2.78±0.30*2.16±0.57*5.272<0.01给药后48h 2.64±0.45*2.07±0.62*4.075<0.01给药后10d 2.59±0.51 2.02±0.43*5.132<0.01

表3 两组顽固性癌痛患者用药期间30min内入睡、觉醒>1次、爆发痛次数、10d吗啡用量比较
3.2 两组患者给药后各时点Ramsay镇静评分比较
治疗组给药后 2、4、24、48h、10d Ramsay镇静评分较对照组同时点均显著增加(P<0.01)。见表2。
3.3 两组用药期间30min内入睡、觉醒>1次例数、爆发痛次数、10d吗啡用量比较 治疗组用药期间30min内入睡占比为86.67%,显著高于对照组(P<0.01);治疗组觉醒>1次占比16.67%,显著低于对照组(P<0.01);治疗组用药期间平均每日爆发痛次数、10d吗啡用量均显著低于对照组(P<0.01)。见表3。
3.4 两组患者治疗前后睡眠障碍发生率比较 治疗组治疗前后睡眠障碍发生率分别为18例(60.00%)和6例(20.00%),对照组治疗前后睡眠障碍发生率分别为17例(56.67%)和14例(46.67%),治疗组治疗后睡眠障碍发生率显著低于对照组(χ2=4.800,P<0.05)。
3.5 两组患者不良反应比较 治疗组恶心呕吐、便秘发生率均为10.00%,与对照组比较均显著降低(P<0.05,P <0.01); 治疗组心 动过缓 发 生 率 为20.00%,与对照组比较显著上升(P<0.05);两组嗜睡、尿潴留、低血压发生率比较,差异无统计学意义(P>0.05)。见表 4。
4 讨论
顽固性癌痛患者多伴有无法忍受的疼痛,癌痛患者在忍受疼痛的同时,多可伴睡眠障碍、烦躁、谵妄、焦虑等,可对生存质量产生严重影响[14]。因此,在对顽固性癌痛患者给予镇痛处理的同时,应兼顾镇静、改善焦虑、睡眠障碍等伴随症状。在镇痛治疗上,虽然阿片类药物不良反应较多,但因其给药方便、经济、无创,目前仍是最常使用的镇痛药物[15-16]。静脉自控镇痛作为一种新型给药方法,相对于传统镇痛给药方法优势明显[17-18],患者可根据自身情况调整给药剂量,有效防止了血药浓度波谷、波峰导致的镇痛不全或过度镇痛;医务人员的工作量也相应减少。本研究两组患者在行静脉自控镇痛给药后2、4、24、48h、10d NRS 评分均显著低于给药前(P<0.01),表明静脉自控镇痛能起到有效的镇痛作用。

表4 两组顽固性癌痛患者不良反应比较[例(%)]
右美托咪定是美托咪定的右旋异构体,属新型肾上腺素能激动剂,可通过选择性地结合α2肾上腺素能受体,从而起到镇痛、镇静效果[19]。既往研究发现,阿片类药物联合右美托咪定可减少阿片药物约30%~50%的用量,且能提高镇痛效果,增强患者的耐受性[20]。右美托咪定具有一定的镇痛作用,在与阿片类药物联合使用时可发挥协同作用,减轻由疼痛导致的不良情绪及睡眠障碍,减少阿片类药物剂量,从而减少由阿片类药物引起的不良反应[21-22]。本研究显示,治疗组患者给药后 2、4、24、48h、10d Ramsay 镇静评分均显著高于对照组(P<0.01),提示右美托咪定镇静作用明显,能有效缓解患者的焦虑、紧张等不良心理。原因主要是右美托咪定能激动α2肾上腺素受体,对大脑脑干蓝斑核突触后神经产生负反馈抑制,使觉醒下降,从而形成类似于生理睡眠的效应[23]。另外,本研究中治疗组10d吗啡用量显著低于对照组(P<0.01),其原因与右美托咪定具有的辅助镇痛作用有关。右美托咪定和吗啡的作用机制不同,因此两者具有协同镇痛作用[24]。治疗组患者用药期间30min内入睡占比显著高于对照组,觉醒>1次占比显著低于对照组(P<0.01),平均每日爆发痛次数显著少于对照组(P<0.01)。另外,治疗组治疗后睡眠障碍发生率相对于对照组治疗后有显著降低(P<0.05)。这些均提示右美托咪定复合吗啡静脉自控镇痛能有效提高镇痛及镇静效果,从而显著改善患者的睡眠质量。
吗啡镇痛过程中易引起便秘、恶心呕吐等,本研究结果显示治疗组患者恶心呕吐、便秘发生率均显著低于对照组(P<0.05,P<0.01),这可能与右美托咪定有效减少了吗啡用量有关,同时右美托咪定本身也能减少恶心呕吐的发生[25]。治疗组患者心动过缓发生率则显著高于对照组(P<0.05),这可能与右美托咪定对中枢交感神经系统的抑制作用有关。但治疗组在联合右美托咪定治疗后,嗜睡发生率与对照组相比有所升高,但差异无统计学意义(P>0.05)。两组共8例患者嗜睡发生在给药后12h以内且均处于轻度嗜睡状态,减少25%背景输注剂量,症状即改善。此外本研究调整镇痛泵给药剂量较为及时,两组患者治疗过程中并未出现呼吸抑制。适度镇静、减缓心率有利于稳定血流动力学,减少心肌耗氧量,增强患者的舒适度,但药物使用剂量增大的同时也应警惕发生过度镇静。
综上所述,右美托咪定可减少顽固性癌痛患者吗啡用量,增强镇静镇痛效果,减少由吗啡引起的恶心呕吐、便秘等不良反应,提高患者的睡眠质量。但因右美托咪定易引起心动过缓,使用过程中需加强监测,以提高用药的安全性,吗啡与右美托咪定何种使用剂量、给药速度更有效、安全,后续仍有待进一步研究。

