刺梨黄酮对心力衰竭大鼠心脏结构、功能及心室肌信号传导子和转录活化子1蛋白表达的影响
李 丹,王一迪,蔡新华,陈敬芝,吕玉珠,梁乾坤
(1.新乡医学院2013级本科,河南 新乡 453003;2.新乡医学院组织学与胚胎学教研室,河南 新乡 453003)
阿霉素属蒽环类抗生素,广泛用于骨肉瘤等肿瘤的治疗,可引起多种不良反应,其中以心脏毒性危害最大[1-2]。信号转导与转录激活子1 (signal transducers and activators of transcription 1,STAT1)是STAT家族成员,STAT蛋白介导多个信号通路,参与细胞生长、增殖分化、凋亡等病理生理过程[3]。刺梨黄酮是刺梨果实中提取的黄酮类生物活性物质,具有调节血脂、抗动脉粥样硬化等作用[4-5]。本研究采用阿霉素诱导大鼠来建立心力衰竭模型,并给予刺梨黄酮干预,探讨刺梨黄酮对阿霉素所致心肌损伤的保护作用及其对心室肌中STAT1表达的影响。
1 材料与方法
1.1实验动物健康成年雌性Sprague Dawley大鼠24只(由新乡医学院实验动物中心提供),体质量140~200 g,给予专用饲料和蒸馏水,分笼喂养,自由进食水,每2 d换1次垫料。
1.2主要试剂与仪器注射用盐酸阿霉素(美国辉瑞公司,国药准字H20130186),刺梨黄酮(第四军医大学徐萍博士提供,专利号:ZL201010570876.1),生物素-链霉卵白素免疫组织化学检测试剂盒(北京中杉金桥生物技术有限公司),羊抗兔异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、羊抗兔Cy3 (美国Invitrogen公司),兔抗大鼠factor Ⅷ因子多克隆抗体(武汉博士德生物工程有限公司),羊抗兔STAT1抗体(美国Santa Craz公司),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)(上海碧云天生物技术研究所)。免疫组织化学孵育箱(浙江余姚仪器厂),H7500透射电子显微镜(日本日立公司),CM 1850冰冻切片机(德国徕卡公司),Vevo 2100 成像系统(加拿大VisualSonics公司),激光扫描共焦显微镜(日本Olympus公司)。
1.3方法
1.3.1实验分组及各组大鼠干预措施将大鼠随机分为对照组(n=6)、模型组(n=9)和刺梨黄酮组(n=9)。模型组和刺梨黄酮组大鼠腹腔注射 0.5 g·L-1的盐酸阿霉素溶液(2 mL·kg-1)制备心力衰竭模型,每日1次,共10 d;空白对照组大鼠仅腹腔注射等量的生理盐水,共10 d。造模的同时,刺梨黄酮组大鼠于每次注射阿霉素后给予 0.1 g·L-1刺梨黄酮溶液灌胃(2 mL·kg-1),每日1次,共 10 d;模型组和对照组大鼠给予等量生理盐水灌胃,共10 d。
1.3.2动物一般体征观察观察各组大鼠饮食、活动、精神状况、皮毛变化、体质量等。
1.3.3心脏超声检查各组大鼠心功能大鼠完成刺梨黄酮灌胃后次日进行超声评估,以左心室射血分数(left ventricular ejection fractions,LVEF)<45% 作为心力衰竭评估的主要参数。大鼠麻醉后仰卧位于平台上固定四肢,脱去胸部毛发,利用Vevo®2100成像系统对大鼠心脏进行扫查,扫查深度为2.0~3.0 cm,分别以大鼠心电图的QRS波群和t波作为收缩期和舒张期的标志,并结合图像上二尖瓣的开闭,测量各组大鼠EF、左心室收缩末期内径(left ventricular end-systolic dimension,LVESD)和左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)。
1.3.4标本采集心脏超声检测后,处死大鼠,迅速开胸取大鼠心脏,剪除心尖及周围大血管和结缔组织,暴露心腔,以生理盐水冲洗后将心室肌组织分为2份,1份置于预冷蜡板上,滴加预冷的体积分数2.5%戊二醛固定液,使用双面刀片沿冠状沟下约 1 mm 做水平切,取约1 mm×1 mm×1 mm心室肌组织块,迅速置于体积分数2.5%戊二醛固定液中,应用透射电镜观察超微结构。另1份置于40 g·L-1多聚甲醛中固定8 h,置于150、300 g·L-1蔗糖溶液中梯度脱水,待组织块沉液面以下后,取出组织块,滤纸吸干,置于4 ℃冰箱保存待用。
1.3.5透射电镜观察各组大鼠心室肌超微结构心肌组织块常规电镜技术方法进行包埋,超薄切片,透射电镜下观察心室肌超微结构并采集图像。
1.3.6苏木精-伊红(hematoxylin-eosin,HE)染色观察大鼠心肌组织病理学改变制备切片标本时,采用鸟氨酸氨基甲酰转移酶(optimal cutting temperature,OCT)包埋,于-20 ℃冰冻切片机制备标本,片厚6 μm,切片置于37 ℃温箱烤片40 min,置于低温冰柜中保存待用,切片标本复温,苏木精染色7 min,自来水返蓝2 min,伊红染色40 s,常规梯度酒精脱水、二甲苯透明、中性树胶封片,光镜下观察并采集图片。
1.3.7免疫组织化学法检测各组大鼠心肌组织中STAT1蛋白表达切片标本复温,体积分数0.3%过氧化氢37 ℃孵育10 min,漂洗3次,每次5 min;加入羊抗兔STAT1抗体(应用50 g·L-1牛血清白蛋白1200稀释),置于4 ℃冰箱过夜,其他步骤按照生物素-链霉卵白素免疫组织化学检测试剂盒说明书操作,二氨基联苯胺显色,室温孵育6 min。常规脱水、透明中性树胶封片,光镜下观察并采集图片,利用Image J图像分析系统对STAT1蛋白进行定量分析。
1.3.8免疫荧光双标染色观察模型组大鼠心室肌中STAT1蛋白与factorⅧ蛋白表达部位切片复温、水化,100 g·L-1脱脂奶粉溶液室温封闭30 min后加入兔抗大鼠factor Ⅷ因子多克隆抗体(应用 50 g·L-1牛血清白蛋白1100稀释),置于 4 ℃冰箱孵育过夜;加入羊抗兔FITC(应用100 g·L-1脱脂奶粉溶液11 000 稀释),室温孵育60 min (避光),漂洗3次,每次5 min;加入STAT1于4 ℃冰箱孵育过夜,加入羊抗兔Cy3(应用100 g·L-1脱脂奶粉溶液11 000 稀释),室温孵育60 min (避光),漂洗3次,每次5 min;加入DAPI室温孵育 10 min,漂洗3次,每次5 min。抗淬灭封片剂封片,激光共聚焦扫描显微镜下观察并采集图片。

2 结果
2.1各组大鼠一般体征变化对照组大鼠饮食正常,体质量略有增加,皮毛光滑,活动力强。模型组2只大鼠在给药后第2天出现腹泻现象,第4天出现中毒现象,表现为饮食量减少、体质量下降、毛发凌乱、腹部脱毛、眼睑分泌物增多、呼吸频率加快、活动量减少、喜聚团,第7天所有大鼠出现中毒现象,体质量严重下降,第9天死亡1只,第10天死亡3只,共死亡4只。刺梨黄酮组大鼠中毒现象及体质量下降情况较模型组轻,整体饮食量略有减少、体质量稍下降,其中3只大鼠在给药后第8天出现毛发凌乱、聚团现象,在给药第10天死亡,1只大鼠在给药结束后做心功能检测时死亡,共死亡4只。
2.2各组大鼠心功能比较结果见表1。模型组大鼠LVEF低于对照组,LVESD和LVEDD高于对照组,差异均有统计学意义(P<0.05);刺梨黄酮组大鼠LVEF高于模型组,LVESD和LVEDD低于模型组,差异均有统计学意义(P<0.05)。
表13组大鼠心功能比较


组别nLVEF/%LVESD/mmLVEDD/mm对照组675.81±1.583.78±0.376.04±0.26模型组541.14±1.77a4.83±0.13a7.21±0.25a刺梨黄酮组559.48±2.61b4.27±0.22b6.57±0.12b
注:与对照组比较aP<0.05;与模型组比较bP<0.05。
2.3各组大鼠心室肌超微结构结果见图1。对照组大鼠心室肌线粒体结构清晰,肌纤维排列整齐,细胞核规则。模型组大鼠心室肌纤维出现退行性改变,表现为肌丝排列紊乱,出现明显的收缩带,Z线增粗,排列不规则;线粒体及细胞质基质出现局灶性溶解,并发生“鞘样”改变;细胞核发生棘突样改变,肌细胞表面出现大小不一的“指状突起”。刺梨黄酮组心室肌状态明显改善,肌纤维排列较整齐,收缩带不明显,细胞核规则。对照组大鼠心室肌间质、毛细血管均正常,内皮细胞可见少量吞饮胞;模型组大鼠与对照组相比心室肌间质出现水肿,毛细血管扩张明显,内皮细胞呈波浪状,内皮细胞吞饮泡明显增多;刺梨黄酮组大鼠心室肌间质情况较模型组有所改善。
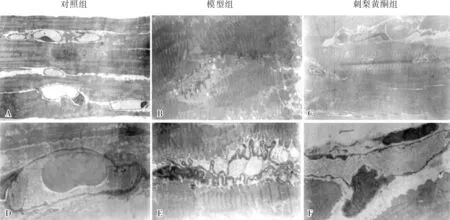
A~C:心室肌;D~F:心肌间质。
图1各组大鼠心室肌组织结构(透射电镜,×10000)
Fig.1Structuresofcardiacventricleofratsineachgroup(transmissionelectronmicroscope,×10000)
2.4各组大鼠心室肌组织病理学改变对照组大鼠心肌纤维排列整齐,无断裂,心肌细胞完整,排列整齐,细胞间隙均匀,未见异常改变。模型组大鼠心肌紊乱呈波浪状,肌束内细胞密集,心肌间隙明显增宽,某些区域存在心肌细胞水肿、肌原纤维溶解和炎性细胞浸润,部分毛细血管扩张。刺梨黄酮组大鼠心肌纤维排列稍紊乱,肌原纤维溶解不明显(图2)。
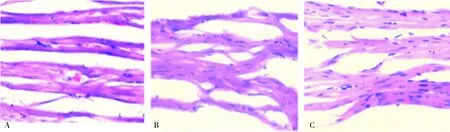
A:对照组;B:模型组;C:刺梨黄酮组。
图2各组大鼠心室肌组织结构(HE染色,×400)
Fig.2Structuresofcardiacventricleofratsineachgroup(HEstaining,×400)
2.5各组大鼠心室肌组织中STAT1蛋白表达量STAT1蛋白在心室肌中呈阳性表达,主要在心室肌细胞周边部呈棕黄色沉淀,阳性结果呈线样或点样(图3)。对照组、模型组和刺梨黄酮组大鼠心室肌中STAT1蛋白的表达量分别为0.27±0.02、0.56±0.07和0.32±0.03。模型组大鼠心室肌中STAT1蛋白表达量高于对照组,差异有统计学意义(P<0.05);刺梨黄酮组大鼠心室肌中STAT1蛋白表达量低于模型组,差异有统计学意义(P<0.05)。
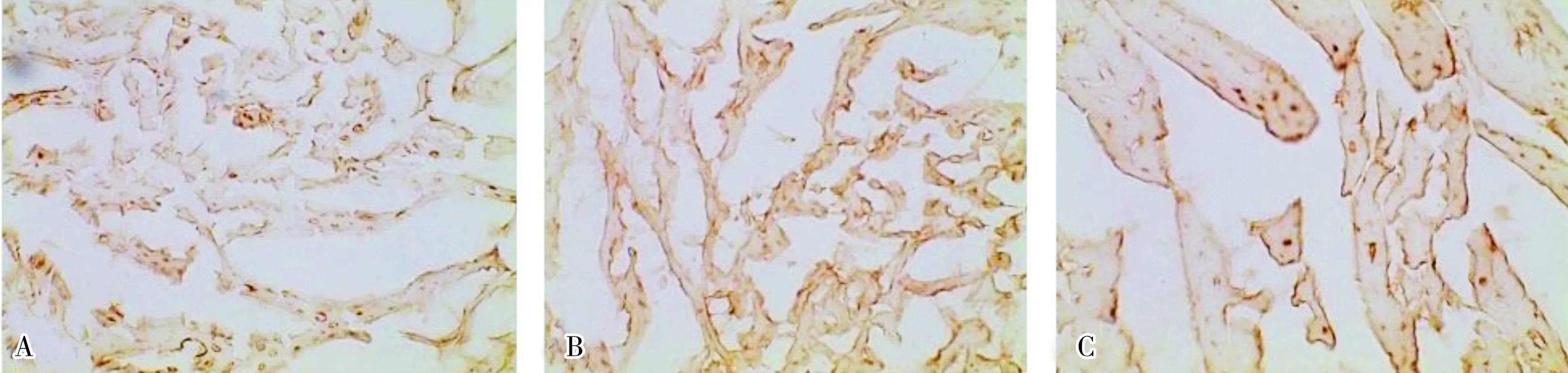
A:对照组;B:模型组;C:刺梨黄酮组。
图3各组大鼠心室肌组织中STAT1蛋白表达(免疫组织化学染色,×400)
Fig.3ExpressionofSTAT1inventricularmyocytesofratsineachgroup(immunohistochemistrystaining,×400)
2.6各组大鼠心室肌中STAT1蛋白与factorⅧ蛋白表达部位结果显示,STAT1与 factor Ⅷ存在共表达(图4)。

A:DAPI示细胞核; B:绿色荧光示Factor Ⅷ阳性;C:红色荧光示STAT1阳性;D:ABC叠加。
图4模型组大鼠心室肌中STAT1与factorⅧ蛋白共表达结果(免疫荧光染色,×400)
Fig.4CoexpressionresultofSTAT1andfactorⅧproteininventricularmyocytesofratsinmodelgroup(immunofluorescencestaining,×400)
3 讨论
阿霉素是临床广泛应用的抗肿瘤药物[6],有严重的心脏毒性,本实验采用腹腔注射0.5 g·L-1盐酸阿霉素溶液(2 mL·kg-1)制备心力衰竭大鼠模型,动物超声评估显示心力衰竭大鼠模型制备成功。
刺梨是分布于我国西北地区的野生植物,有消食健脾、滋补健身的功效,具有很高的营养价值和药用价值[7]。研究发现,刺梨黄酮可以通过Bcl-2/Caspase-3信号途径发挥保护作用,提高脾脏的造血功能[8-9]。本研究结果显示,刺梨黄酮组大鼠各项心功能指标较模型组显著改善,心室肌STAT1蛋白表达量较模型组明显降低,提示刺梨黄酮可有效改善心力衰竭大鼠的心功能,并对阿霉素引起的心肌损伤有明显的保护作用。刺梨黄酮组大鼠生存质量较模型组有显著提高,但死亡数量相同,表明本实验过程中刺梨黄酮虽不能降低大鼠死亡率,但可提高动物生存质量。
研究发现,细胞因子水平升高程度与心力衰竭大鼠的临床症状严重程度有关,而心力衰竭的基本机制是心肌重塑与细胞凋亡,其发生、发展与机体生物活性分子过度表达有关[10]。有学者研究了STAT1和STAT3在缺血性心脏病中的作用,结果发现,STAT3对心脏主要起保护作用,而STAT1的作用主要表现在促进心肌细胞凋亡及减少心肌自噬性保护[11-12]。本实验通过免疫荧光双标检测大鼠心室肌中STAT1蛋白与factor Ⅷ表达,发现STAT1蛋白与factor Ⅷ存在共表达,factor Ⅷ是血管内皮细胞的标志性蛋白[13],因此推测,STAT1主要参与心室肌内皮细胞的变化,黄酮可能通过影响血管内皮细胞来发挥其保护作用,刺梨黄酮对心肌的保护作用只能减轻心肌细胞的损伤程度,但尚不能完全逆转阿霉素所致的损伤。本实验揭示了刺梨黄酮在体内对抗阿霉素所致心肌细胞损伤的途径,为进一步研究STAT1在阿霉素所致心肌损伤中的表达情况及深入探讨刺梨黄酮对阿霉素所致心肌损伤的保护作用的具体机制提供了新的科研思路,为今后的靶基因治疗提供理论依据。

