黄体酮受体对新生大鼠离体延髓脑片呼吸性基本节律放电的调节作用
赵华怡,千智斌
(1.新乡医学院机能学实验室,河南 新乡 453003;2.新乡医学院研究生2015级,河南 新乡 453003)
稳定的呼吸是机体存活的必要条件,哺乳动物呼吸性基本节律放电(rhythmic respiration discharge activity,RRDA)起源于延髓面神经后核内侧区(the medial area of nucleus retrofacialis,mNRF),它是呼吸运动得以产生的基础[1-2]。黄体酮能够在神经系统分泌和合成,对神经系统功能有着重要影响[3]。在中枢神经系统内存在内源性黄体酮和黄体酮受体,但相关研究主要集中在其对缺血再灌注损伤的保护作用[4-5],黄体酮和黄体酮受体是否在生理条件下调节延髓呼吸中枢呼吸神经元电活动尚未见报道,因此,作者设计本实验,以新生大鼠离体延髓脑片为研究对象,使用神经电生理方法从功能上研究在延髓呼吸中枢是否存在黄体酮受体和内源性黄体酮调节RRDA和延髓呼吸中枢,为哺乳动物延髓呼吸中枢的发育和中枢性呼吸疾病的预防和治疗提供实验依据。
1 材料与方法
1.1实验动物清洁级Sprague-Dawley大鼠购自河南省实验动物中心(许可证号:SCXK 豫-2013-0002),常规饲养,自由饮食,自然光照,实验选取其生产的2日龄的新生大鼠24只,雌雄不拘。
1.2试剂与仪器黄体酮受体激动剂、黄体酮、黄体酮受体拮抗剂、米非司酮、人工脑脊液(artificial cerebrospinal fluid,ACSF)(配制成分为NaCl 124 mmol·L-1、KCl 5 mmol·L-1、CaCl22.4 mmol·L-1、NaHCO326 mmol·L-1、MgSO41.3 mmol·L-1、KH2PO41.2 mmol·L-1)均购于美国Sigma公司,30 mmol·L-1葡萄糖为国产分析纯;BL-420生物信号采集与处理系统购自成都泰盟科技有限公司,体视显微镜购自济南八一光学仪器厂,直流前置放大器(FZG-81)购自上海嘉龙教学仪器厂,数字测氧仪(CY-12C)购自上海隆拓仪器有限公司。
1.3方法
1.3.1离体延髓脑片标本的制备取2日龄新生大鼠,吸入乙醚进行深度麻醉后,在第4~5颈椎断头处死,将鼠头立即置于0 ℃的ACSF中清洗和降温5~10 s,再转移至含有200 mL 0 ℃ ACSF的解剖盒中,并持续通入含体积分数95%O2和体积分数5%CO2的混合气。鼠头固定在解剖槽中,使用眼科剪剥离颅骨的皮肤和肌肉组织,顺延颅骨背侧正中线缓慢剪开顶颅骨和椎管,并向尾端延伸直至完整剪开椎管,去除背侧颅骨和椎骨,完全暴露大脑、小脑、脑干和脊髓。在游离出来的中枢神经系统标本上去除小脑,完整暴露出延髓后在上下丘处切去高位脑组织,即完成延髓标本的制备。在延髓标本上第1~2颈椎间剪去脊髓尾端,刀刃垂直于脊髓在闩前后切出900~1 200 μm厚度的脑片,即完成脑片制备,脑片上保留有mNRF、橄榄核、舌下神经根和背侧呼吸组等结构。为减少脑组织缺氧损伤,脑片制备时间控制在3 min以内[6]。
1.3.2记录脑片RRDA切好的脑片迅速转移至灌流槽内,保持腹侧面朝上,灌流含有体积分数95%O2和体积分数5%CO2混合气体的ACSF,流速4~6 mL·min-1,温度为25~27 ℃。使用体视显微镜辨认脑片腹侧面的舌下神经根,使用含有银-氯化银保护电极的吸附电极加以负压吸附舌下神经根,记录到的RRDA经放大后通过BL-420F生物信号采集系统输出,并对其处理和分析。
1.3.3实验分组实验分4组,每组6只脑片,分别进行灌注实验。(1)对照组:使用空白ACSF灌流脑片,在灌流10 、20、30、40、50 min时测量RRDA,对各时间点的数据进行统计处理以检测实验模型的稳定性,并以灌流10 min时的数据作为其他各组的对照;(2)黄体酮组:灌流含有不同浓度(5、10、20、40 μmol·L-1)黄体酮的ACSF,在灌流10 min时测量并分析RRDA的变化;(3)米非司酮组:灌流含有不同浓度(5、10、20、40 μmol·L-1)米非司酮的ACSF,灌流10 min时测量RRDA并分析其变化;(4)混合组:先灌流黄体酮(20 μmol·L-1)10 min,然后用空白ACSF冲洗脑片,再灌流黄体酮+米非司酮(20 μmol·L-1)10 min,对比单独使用黄体酮10 min和混合使用黄体酮+米非司酮10 min时RRDA的变化情况。
1.4测量指标机体呼吸过程中,吸气时程(inspiratory time,TI)、吸气幅度(inspiratory strength,IA)和呼吸频率(respiratory frequency,RF)是反映呼吸运动的参数,本研究同样以上述3个参数作为判断RRDA的指标。每次RRDA从放电开始至结束所持续的时间即为TI;每次呈簇状的呼吸放电积分即为IA;每分钟内发生呼吸放电的次数即为RF。为使实验结果更直观,以对照组大鼠脑片灌流 10 min 时所测得的结果作为100%,对本组各时间点和其他各组不同浓度的数据进行标准化处理。

2 结果
2.1模型稳定性结果见表1。对照组大鼠脑片在灌流10、20、30、40、50 min时各时间点TI、IA、RF比较差异均无统计学意义(P>0.05),说明50 min内灌流的脑片标本RRDA无衰弱现象,本模型具有可靠的稳定性。
表1对照组不同时间点RRDA比较


时间TI/sIA/mVRF/(次·min-1)10 min100.00±0.00100.00±0.00100.00±0.0020 min98.83±2.48103.17±5.05101.67±8.4330 min101.78±4.33102.40±6.2999.67±7.0740 min98.67±5.1698.67±5.6398.55±8.4450 min96.54±4.2198.33±4.2697.02±8.67F0.7510.8120.887P0.6800.6440.720
2.2不同浓度黄体酮对延髓脑片RRDA的影响结果见表2。对照组、黄体酮组灌注前和5 μmol·L-1黄体酮组TI、IA和RF比较,差异均无统计学意义(P>0.05);与对照组、黄体酮组灌注前和5 μmol·L-1黄体酮组比较,10、20、40 μmol·L-1黄体酮组TI延长,IA增强,RF增加,差异均有统计学意义(P<0.05);与10 μmol·L-1黄体酮组比较,20、40 μmol·L-1黄体酮组TI延长,IA增强,RF增加,差异均有统计学意义(P<0.05);40 μmol·L-1黄体酮组与20 μmol·L-1黄体酮组TI、IA和RF比较差异均无统计学意义(P>0.05)。
表2不同浓度黄体酮对延髓脑片RRDA的影响

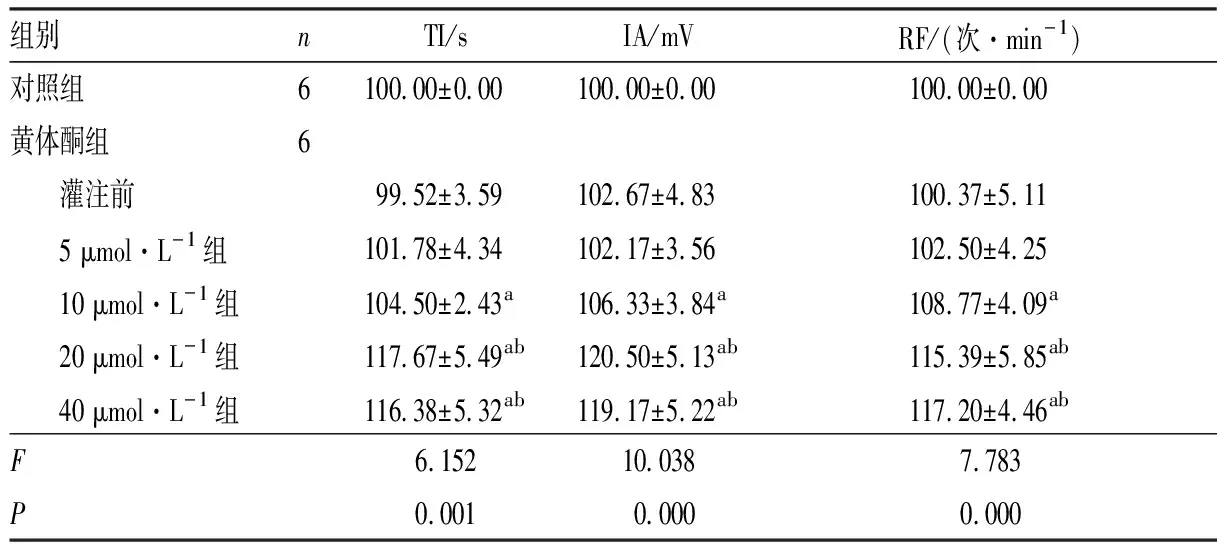
组别nTI/sIA/mVRF/(次·min-1)对照组6100.00±0.00 100.00±0.00 100.00±0.00 黄体酮组6 灌注前99.52±3.59102.67±4.83100.37±5.11 5 μmol·L-1组101.78±4.34102.17±3.56102.50±4.25 10 μmol·L-1组104.50±2.43a106.33±3.84a108.77±4.09a 20 μmol·L-1组117.67±5.49ab120.50±5.13ab115.39±5.85ab 40 μmol·L-1组116.38±5.32ab119.17±5.22ab117.20±4.46abF6.15210.0387.783P0.0010.0000.000
注:与对照组、黄体酮组灌注前和5 μmol·L-1黄体酮组比较aP<0.05;与10 μmol·L-1黄体酮组比较bP<0.05。
2.3不同浓度米非司酮对延髓脑片RRDA的影响结果见表3。对照组、米非司酮组灌注前和5 μmol·L-1米非司酮组TI、IA和RF比较差异均无统计学意义(P>0.05);与对照组、米非司酮组灌注前和5 μmol·L-1米非司酮组比较,10、20、40 μmol·L-1米非司酮组 TI缩短,IA降低,RF减少,差异均有统计学意义(P<0.05);与10 μmol·L-1米非司酮组比较,20、40 μmol·L-1米非司酮组TI缩短,IA减弱,RF减少,差异均有统计学意义(P<0.05);40 μmol·L-1米非司酮组与20 μmol·L-1米非司酮组TI、IA和RF比较差异均无统计学意义(P>0.05)。
表3不同浓度米非司酮对延髓脑片RRDA的影响


组别nTI/sIA/mVRF/(次·min-1)对照组6100.00±0.00 100.00±0.00 100.00±0.00 米非司酮组6 灌注前99.41±4.26101.29±4.40101.68±4.79 5 μmol·L-1组96.83±3.4095.33±3.02100.32±3.42 10 μmol·L-1组92.33±3.22a90.17±3.66a97.06±3.67a 20 μmol·L-1组84.00±3.20ab83.17±3.77ab90.81±4.21ab 40 μmol·L-1组83.16±5.63ab82.50±4.51ab90.95±5.06abF8.36710.5195.406P0.0000.0000.001
注:与对照组、黄体酮组灌注前和5 μmol·L-1黄体酮组比较aP<0.05;与10 μmol·L-1黄体酮组比较bP<0.05。
2.4黄体酮和黄体酮+米非司酮对延髓脑片RRDA的作用结果见表4。与对照组和混合组灌注前比较,混合组灌注黄体酮后TI延长,IA增强,RF增加,差异有统计学意义(P<0.05);与灌注黄体酮相比,灌注黄体酮+米非司酮后TI缩短,IA减弱,RF减少,差异有统计学意义(P<0.05);对照组、混合组灌注前和灌注黄体酮+米非司酮后TI、IA和RF比较差异均无统计学意义(P>0.05)。
表4黄体酮和黄体酮+米非司酮对RRDA的影响


组别nTI/sIA/mVRF/(次/min-1)对照组6100.00±0.00 100.00±0.00 100.00±0.00 混合组6 灌注前98.57±5.32100.33±3.96100.67±5.24 灌注黄体酮后115.89±4.61a121.33±4.44a116.21±5.67a 灌注黄体酮+米非司酮后103.91±4.26b102.84±4.65b98.67±5.08bF11.90116.72620.243P0.0000.0000.000
注:与对照组和混合组灌注前比较aP<0.05;与灌注黄体酮后比较bP<0.05。
3 讨论
哺乳动物完整的节律性呼吸起源于延髓呼吸中枢,是呼吸运动产生的基础[7]。本实验记录的RRDA是由脑片mNRF区呼吸起步神经元膜电位的周期性自动去极化产生,通过mNRF区呼吸神经元换元过程将动作电位传导至舌下运动神经元,从而促进吸气神经元放电,这就是在舌下神经根记录到的电活动。因此,实验过程中所记录的RRDA反映了新生大鼠延髓呼吸中枢的呼吸功能,也间接反映中枢神经系统发育和成熟情况[8]。
黄体酮又称黄体酮或黄体激素,是外周神经系统中由卵巢分泌的具有生物活性的主要孕激素。有关黄体酮在外周神经系统的研究绝大多数集中在它作为孕激素方面,在中枢神经系统的研究大多数集中在它对缺血再灌注损伤组织的保护作用[9-10]。近年来,黄体酮被作为一种内源性信号分子得到研究,有研究发现,位于延髓背内侧即孤束核腹外侧的去甲肾上腺素能神经元上有黄体酮受体的表达;而在延髓腹外侧区、小细胞性网状结构和孤束核中同时存在黄体酮受体免疫反应阳性细胞和黄体酮受体mRNA表达[11]。
本研究发现,在5~20 μmol·L-1浓度范围内,黄体酮能够增加TI和IA,增加RF,对RRDA呈浓度依赖性兴奋作用,且20 μmol·L-1黄体酮为兴奋RRDA的最适浓度,继续增加黄体酮浓度对脑片RRDA无明显改变;而黄体酮受体拮抗剂米非司酮能够缩短TI和IA,减少RF,对RRDA呈浓度依赖性抑制作用,且20 μmol·L-1的米非司酮为抑制RRDA的最适浓度,继续增加米非司酮浓度对脑片RRDA无明显改变;单独使用黄体酮对RRDA具有兴奋作用,联合使用黄体酮+米非司酮可完全阻断黄体酮对RRDA的兴奋作用。本研究结果提示,在新生大鼠离体延髓脑片内有黄体酮受体激动剂黄体酮的存在,它可能由局部神经元或胶质细胞分泌。黄体酮与黄体酮受体结合后能够增加神经元的兴奋性,表现为RRDA增强[12]。使用黄体酮受体拮抗剂阻断受体后导致黄体酮通过受体对神经元所产生的兴奋作用消失,从而使RRDA减弱。联合使用黄体酮和米非司酮后对RRDA无明显作用。以上实验结果证实,黄体酮和米非司酮对RRDA的作用是通过受体途径实现的。
黄体酮膜受体是经典的Gq蛋白受体,被激活后可通过经典途径激活磷脂酶C,将细胞膜长链脂蛋白水解为磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol biphosphate,PIP2),PIP2被水解后产生三磷酸肌醇和二酰基甘油,前者通过与内质网上的三磷酸肌醇受体结合,使钙离子依赖性氯离子通道因细胞内的钙离子通道开放而得以激活;后者不仅能够激活背根神经节神经元上的蛋白激酶C通路,还可通过激活细胞内钙离子蛋白激酶C并使其发生磷酸化而增强活性,同时,对细胞内大量蛋白质的活性进行调节[13-15]。黄体酮受体被激活后除沿经典的信号跨膜转导途径调节神经元兴奋性外,也可通过黄体酮受体介导的电流调节神经元兴奋性,黄体酮借助GABA受体的激活引起氯离子内流,使细胞内达到超极化状态,降低神经元的过度兴奋性,还能抑制兴奋性氨基酸的毒性作用,以维持神经元正常的兴奋性[16-17]。

