国产氟多功能模块自动化合成18F-6-氟-L-DOPA及其临床初步应用
付华平,张晓军,麻广宇,刘 健,徐晓丹,徐白萱,张锦明
(中国人民解放军总医院 核医学科,北京 100853)
对分化良好、糖代谢水平低的神经内分泌肿瘤(NETs),18F-6-氟-L-DOPA(18F-DOPA)比18F-FDG具有更高的诊断价值[1],欧洲将18F-DOPA写入神经内分泌肿瘤诊断指南[2]。但由于亲电合成需要气体靶,且放化产率低和含载体,而亲核合成工艺复杂[3],18F-DOPA在临床推广应用有一定的难度。近年来,亲核取代法合成18F-DOPA取得了较大的进展,除间接亲核取代后采用手性催化剂合成18F-DOPA外,直接亲核取代水解合成18F-DOPA方法简单、重复性好,且不含载体、产品手性纯度高,受到临床的欢迎。文献报道了多种直接亲核取代合成18F-DOPA的方法,其中以碘盐或硼酸酯为前体的合成方法,可以在常规的氟多功能模块上实现大剂量、自动化的合成,使18F-DOPA在临床的广泛应用成为可能[4]。本研究在Tredwell等[5]的研究基础上,以6-硼酯-二甲氧基-DOPA为前体,铜盐Cu(OTf)2(py)4为催化剂,在国产氟多功能模块上实现了简单、快速合成18F-DOPA,经质控和伦理审批后,进行了初步的临床评价。
1 实验材料
1.1 主要试剂
6-硼酯-二甲氧基-L-DOPA和铜盐Cu(OTf)2-(py)4:德国ABX产品;19F-6-氟-L-DOPA标准品:加拿大TRC公司;Sep-Pak Light QMA柱、SEP-PAK C18柱:美国Waters公司;氧-18水(H18O丰度大于97%)、氨基聚醚(kryptofix,K2.2.2):江苏华益科技有限公司;碳酸钾(K2CO3):纯度>99.997%,美国STREM公司;氢氧化钠(NaOH)、二甲基甲酰胺(DMF)、乙酸(CH3COOH)、抗坏血酸、丙酮:分析纯,北京化学试剂公司产品; 无水乙腈(CH3CN):纯度>99.9%,美国Aldrich公司产品;57%氢碘酸(HI):AR,百灵威化学试剂。
1.2 主要设备
Sumitomo HM-20S回旋加速器:日本住友公司;PET-MF-2V-IT-Ⅰ型氟多功能合成模块:派特(北京)科技有限公司;高效HPLC分析仪:美国Waters公司,配515泵,2487紫外检测器,Phenomenex Gemini 100 A C18 (4.6 mm×150 mm)分析柱,BioScan流动放射性检测器;Discovery ST64 PET/CT扫描仪:美国GE公司;便携式内毒素快速检测仪:美国Charles River公司;电感耦合等离子体原子发射光谱仪(ICP-AES):德国斯派克分析仪器公司;Bante321-Cu便携式铜离子浓度计:上海般特。
1.3 动物实验
正常雄性NIH小鼠5只,6~8周龄,(20±5) g,购于北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2015.0001。
1.4 临床患者
经本院伦理委员会同意(批准号:S2017-128-01),正常受试者:男性一例,52岁;胰岛细胞瘤复发患者:女性一例,22岁;签署知情同意书。
2 实验方法
2.1 18F-DOPA的自动化合成
使用PET-MF-2V-IT-Ⅰ型氟多功能合成模块合成18F-DOPA,合成线路示于图1。具体步骤:加速器经18O(p,n)18F反应得到18F-由N2载带至QMA捕获,用1.0 mL K2.2.2/K2CO3淋洗液(由5.50 g/L K2CO3水溶液0.2 mL和18.75 g/L K2.2.2乙腈溶液0.8 mL混合而成)将18F-从QMA柱洗入1号反应管,通入N2并加热115 ℃除水至干,再将2 mL乙腈加入反应管继续通气加热除水至干燥。10 mg 6-硼酯-二甲氧基-DOPA/10 mg Cu(OTf)2(py)4)溶于0.7 mLDMF溶液中,加入1号反应管,110 ℃密闭亲核取代反应10 min后,加10 mL水稀释反应液,并将中间体转移至SEP-PAK C18柱,用5 mL丙酮分两次把中间体洗脱至2号反应管,加热除丙酮至残余0.1 mL,加入0.5 mL 57%的HI,160 ℃加热水解10 min,冷却后加入4 mL 0.5 mol/L氢氧化钠溶液中和,混合液转至中转瓶,利用HPLC分离纯化,分离柱为Grace Alltima C18(10 mm×250 mm),流动相为0.1%乙酸水溶液(含1 g/L抗坏血酸),流速为4 mL/min,产品放射性峰收集后直接通过除菌滤膜得到最终产品。
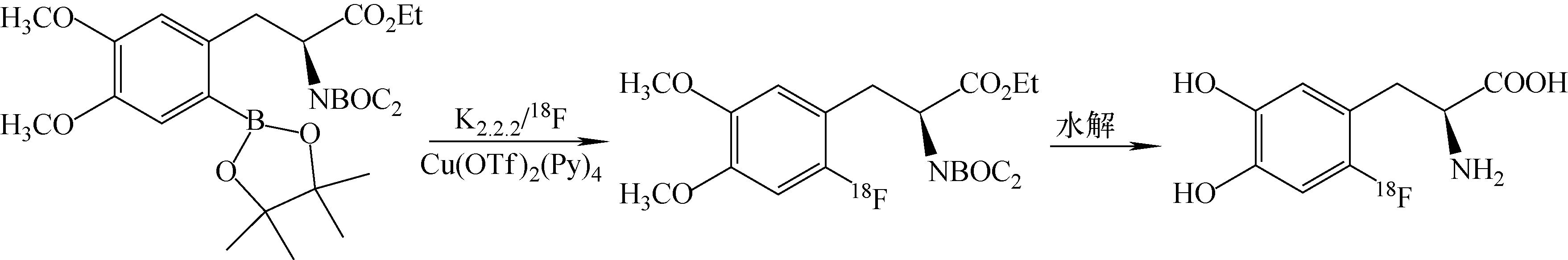
图1 亲核法合成18F-DOPA示意图Fig.1 Nucleophilic synthesis of 18F-DOPA
2.2 18F-DOPA的质量控制
观察产品颜色及澄清度;利用精密pH试纸测量酸碱度;利用分析型HPLC测量放化纯度(分析柱为phenomenex luna C18 5 u(4.6 mm×150 mm),紫外波长为254 nm,流动相为0.1%乙酸水溶液,流速为1 mL/min),再与标准品共进样鉴定产品;碘铂酸薄层检测产品中K2.2.2含量;气相色谱分析产品有机溶剂残留;便携式内毒素检测仪测量内毒素含量;电感耦合等离子体原子发射光谱仪测量产品中铜离子含量。
2.3 18F-DOPA体外稳定性
取三份18F-DOPA溶液并分别稀释至370 GBq/L,第一份不添加任何试剂,即原液①,第二份中加入乙醇,配成乙醇体积分数为1%的溶液②,第三份中加入VC,配成VC10 mg/mL的溶液③。用分析型HPLC(2487紫外检测器, BioScan流动放射性检测器)分别测定①、②、③于1、3、5 h的放化纯度,比较加入乙醇、VC和原液稳定性的不同。
2.4 药物异常毒性实验
取NIH小鼠5只,每只小鼠尾静脉注射0.2 mL 10 mCi/mL的18F-DOPA注射液,正常饲养,48 h观察是否正常。
2.5 临床PET/CT显像
正常对照人仅用18F-DOPA显像一次,而胰岛细胞瘤复发患者采用18F-FDG和18F-DOPA分别显像,中间间隔48 h。 显像方法如下:显像人员按体质量静脉注射4.07 MBq/kg18F-DOPA,安静环境下休息60 min后行全身PET/CT扫描,扫描范围从头部至股骨,PET图像采用三维采集模式采集。利用CT数据对PET图像进行衰减校正,PET图像重建采用OSEM法,CT重建采用标准重建法。对于胰岛细胞瘤复发患者,以ROI技术勾画肿瘤区域并计算SUVmax。
3 结果与讨论
3.1 18F-DOPA的自动化合成
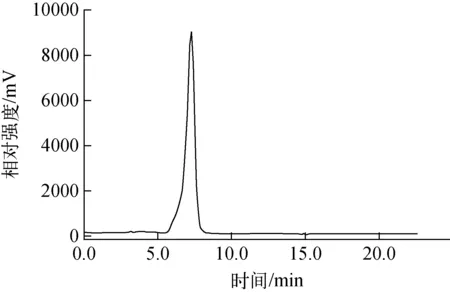
图2 HPLC分离产品的放射性色谱图Fig.2 Radioactivity chromatograms of HPLC separation products
利用新型标记前体6-硼酯-二甲氧基-L-DOPA,在国产双管氟多功能模块自动化合成18F-DOPA,在制备HPLC上收集约7 min 时唯一放射性峰(图2),由于流动相中加入了抗坏血酸,干扰了紫外吸收,无法检测紫外吸收峰。从氟-18离子到最终产品,合成耗时约为60 min,不校正合成效率为(10.0±2.3)%(n=6),单次产量大于7.4 GBq,合成稳定性和可靠性高。连续成功合成14次。
间接亲核合成18F-DOPA的效率较高,大于30%,除合成步骤多、准备时间长外,还需采用手性催化剂,合成后需要鉴别D-DOPA的含量[6]。而直接亲核反应合成18F-DOPA步骤少,方法简单,产品为无载体,且前体为手性化合物,亲核和水解不会对产品的手性有影响,是目前研究的热点。Lee等[7]使用镍络合物类标记前体在室温下亲核生成18F-6-氟-L-DOPA,制备时间短,条件温和,但镍络合物前体合成较复杂,同时存在高价碘氧化剂;Hoepping[8]使用含有硝基的标记前体,通过亲核取代、Baeyer-Villiger、酸水解三步反应一锅法制得18F-DOPA,水解只需6 mol/L的盐酸,条件温和,放化产率较高;芳基碘翁盐类标记前体可进行配体交换形成氟化碘鎓,热分解后生成氟化物,Kuik等[9]利用二芳基碘鎓盐为前体制备18F-DOPA,得到比活度高的产品,但合成时间需要2 h;Tredwell等[5]以芳基硼酸酯为前体,以Cu(OTf)2(py)4为催化剂亲核取代制得18F-DOPA,该前体稳定易得,催化剂Cu(OTf)2(py)4已商品化,产品放化纯度和光学纯度都比较高,但需使用铜盐作催化剂,应使用适当的方法除去铜盐,保证产品中铜离子浓度在合格范围。本研究采用双BOC保护氨基的前体,在铜盐催化下,18F取代硼酯,在国产多功能模块上经亲核、水解和HPLC纯化,自动化得到可供注射的18F-DOPA。该方法的优点是合成前准备时间较短,操作简单,合成效率较合适。
3.2 18F-DOPA的质量控制
产品为无色透明溶液,pH为6~7;放化纯度大于99%,样品放射性峰保留时间与标准品紫外吸收峰保留时间一致(图3);三批注射液样品中K2.2.2含量低于50 μg/mL(碘铂酸薄层未显色);乙腈、丙酮含量均低于0.04%w/w,内毒素低于5 Eu/mL;连续三批产品中铜离子含量分别为:1.05×10-6、0.50×10-6和1.07×10-6,低于药典规定的注射剂中铜离子浓度25×10-6 [10]。本方法的质控关键点为铜离子含量,为了除去铜盐,在产品亲核取代后将半成品通过SEP-PAK C18柱纯化,用大量水冲洗C18柱,最后用丙酮将酯溶性的产品从C18柱上淋洗到第二反应管再水解;最终产品经半制备HPLC纯化。对比文献合成该类二步法显像剂时,由于采用一个反应管的多功能模块,一般将半成品转移到C18柱后,再从合适的淋洗液将产品淋洗回到原反应管;这种方法不但操作麻烦,而且不利于除铜离子。本研究的结果表明,双反应管可有效除去铜盐。为了方便实时测量,对比了Bante321-Cu便携式铜离子浓度计与ICP-AES的结果,基本一致,便携式铜离子浓度计适于产品的自检。
图3 分析型HPLC谱图Fig.3 HPLC spectrum of 6-18F-L-DOPA
3.3 18F-DOPA体外稳定性
18F-DOPA原液放化纯度为99.4%,室温放置5 h后放化纯度降为92.04%,临床使用会造成骨显像;加入VC或乙醇,5 h后放化纯度为98.4%,提高了产品的稳定性(表1)。
18F-DOPA本身不稳定,在含盐溶液中会自行氧化成活性醌类继而聚合成多巴色素,导致其放化纯度降低,加之放射性射线产生的自由基,可加速左旋多巴制剂的分解[11-12]。文献发现在大剂量、 高浓度下18F-FDG也不稳定,加入适量的稳定剂乙醇可以提高其稳定性[13]。本研究参考乙醇的作用,在产品中加入微量稳定剂乙醇或还原剂VC,均可以提高18F-6-氟-L-DOPA的稳定性。在实际操作中,因注射液中乙醇含量的限制,以加入VC更合适。
3.4 异常毒性实验
小鼠注射后48 h全部存活,未见异常毒性反应。
3.5 临床初步应用
L-DOPA是神经递质DP的原料,18F-L-DOPA浓集于纹状体,根据放射性的分布18F-DOPA在上世纪八十年代用于诊断帕金森病,但由于是代谢型显像剂,灵敏度不及受体类显像剂,近年来逐步被受体类显像剂如:123I-FP-CIT或18F-FP-CIT等取代。但由于其特有的靶向性,本研究首先在正常人上证实显像剂临床效果。结果表明,示踪剂特异性浓集于纹状体,证明了其靶向性。全身显像表明,放射性可浓集于胆囊,胰腺有一定的摄取,主要从泌尿系统排泄(图4)。
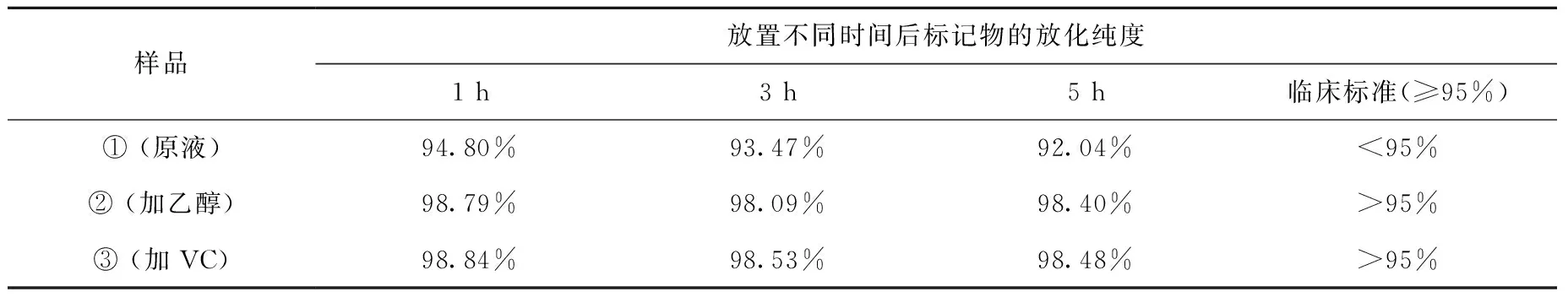
表1 18F-DOPA体外稳定性Table 1 Stability in vitro of 18F-DOPA
在胰岛细胞瘤复发患者18F-DOPA显像表明,MR所示占位区(C),有放射性浓集(图5E,F);而18F-FDG显像则为阴性(图5A,B),最后再次手术证实,该占位为胰岛细胞瘤复发。
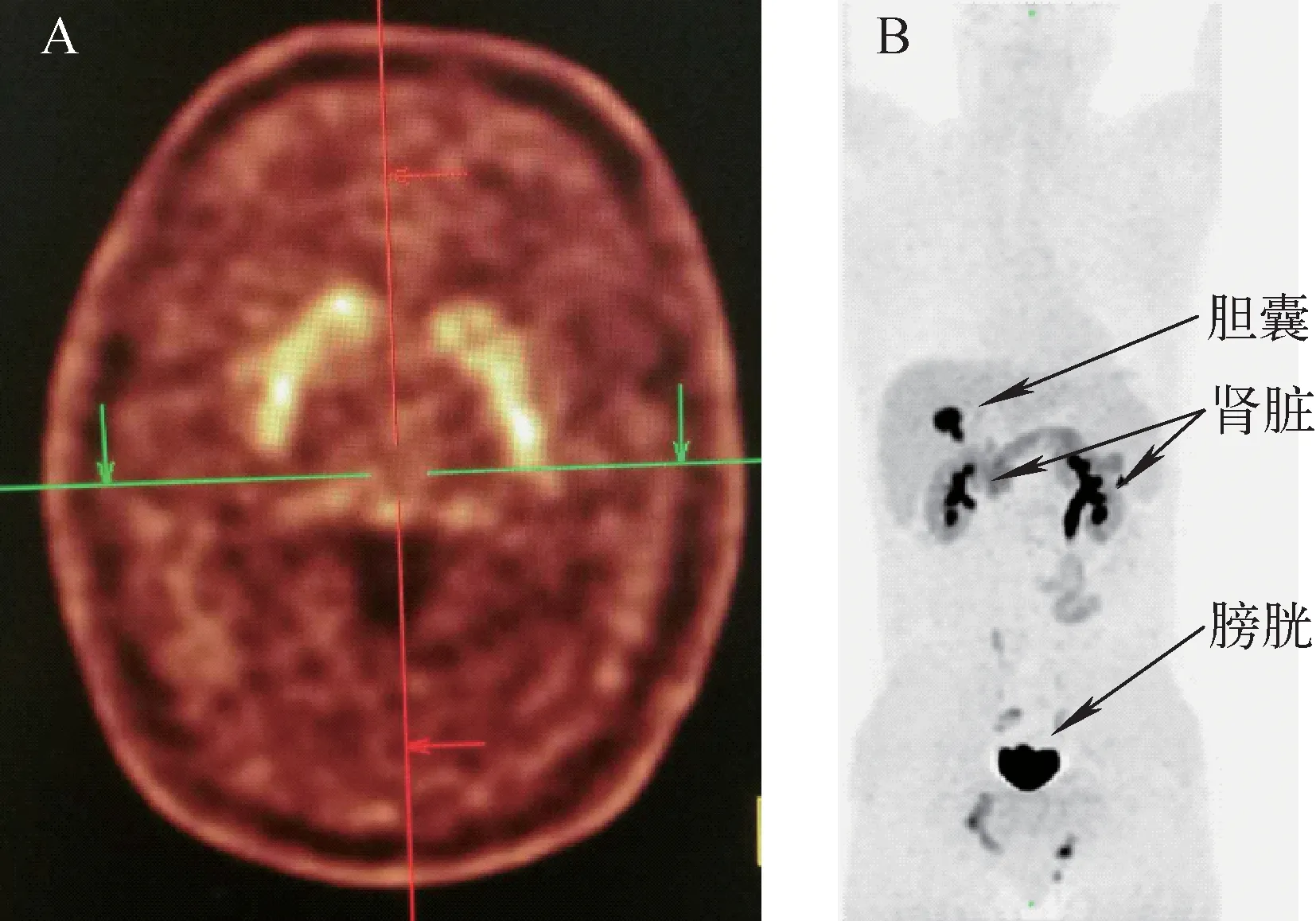
图4 正常男志愿者注射示踪剂60 min后显像Fig.4 Set of images of a 52 years old normal male volunteers
4 小结
本研究采用国产氟多功能模块,经改进双管法合成工艺,可简单、快速合成18F-DOPA,对推动国内18F -DOPA在临床上的应用具有较大的意义。

