18F标记多巴胺D2受体显像剂在老龄及正常SD大鼠脑分布研究
王立振,徐宇平,潘栋辉,王辛宇,杨润琳,严骏杰,盛 洁,黄钱焕,杨 敏
(1.江苏省原子医学研究所,卫生部核医学重点实验室,江苏省分子核医学重点实验室,江苏 无锡 214063;2.南京医科大学,江苏 南京 211166)
我国已进入“老龄化社会”,并且老年人口以每年800~1 000万人的速度递增,人口老龄化呼啸而至,预计2020年将达到2.43亿,2025年将突破3亿,2033年突破4亿,占总人口的1/3[1]。研究表明许多神经退行性疾病的发病率与人口老龄化密切相关,如阿尔兹海默氏病、帕金森病等,故其患病人数也将随之不断上升,这些疾病起病隐匿,目前只能根据临床症状诊断[2]。现有的药物、手术和综合性治疗可以一定程度的缓解症状,但无法逆转或者停止病情的发展。因此,研究这些疾病的发病机理,做出早期诊断,早期人为干预,是延缓这类疾病的唯一有效方法,也是近年来神经科学研究领域关心的一个重要课题。
多巴胺作为中枢神经系统的重要神经递质,主要参与运动、情感和神经内分泌的调节[3]。多巴胺系统是近30年来神经科学研究的焦点问题之一,一些疾病如帕金森病(PD)、精神分裂症、Tourette 综合征(TS)、注意缺陷多动障碍(ADHD)等均与多巴胺能神经递质传递障碍有关[4]。在哺乳动物体内,多巴胺受体有5种亚型,分别为多巴胺受体D1至D5[5]。其中,多巴胺D2受体(DRD2)的变化与中枢神经系统疾病具有相关性,故对其研究和应用最多[6]。早在上世纪,就有诸多研究者[7-9]从分子和基因水平探索了年龄和多巴胺D2受体的关系,然而器官的功能或者疾病的产生和发展过程远不止一个或几个基因调控。疾病的进程受后天环境的影响远比受先天基因的影响明显,并且这种体外研究无法实时动态观察体内过程,本文运用核医学的手段,探索多巴胺D2受体与年龄的关系。与之前的研究手段相比,多巴胺D2受体的PET显像能无创、动态、早期、定量地提供活体脑功能信息,为多巴胺D2受体的分布、数量和密度等变化提供灵敏、有效的手段,为相关神经系统疾病的临床和基础研究提供更直观的方法[10]。目前广泛应用的多巴胺D2受体显像剂主要有11C-raclopride、18F-Fallypride、123I-IBZM、123I-epidepride等[11]。其中,18F-Fallypride与D2受体的特异性结合更高(Kd=3×10-11mol/L),且18F的半衰期适中,便于临床应用与运输[12]。
本研究制备了多巴胺D2受体显像剂18F-Fallypride,纯化后通过尾静脉给药,经micro PET显像,考察18F-Fallypride在正常及老龄SD大鼠纹状体表达的差异及各脑分区的分布,探索衰老与脑多巴胺D2受体的关联性,为利用18F-Fallypride进行疾病和药效研究的方法学提供依据。
1 实验材料
1.1 主要仪器与装置
Sumitomo HM-7型回旋加速器:日本住友;Mini-Scan TLC薄层放射性扫描仪:美国Bio SCAN公司;18F-FDG专用合成模块:北京派特;1525系列分析型高效液相色谱仪、2545系列半制备型高效液相色谱仪:美国Waters公司;CURIEMENTOR 3型活度计:德国PTW公司;AC 210S型电子天平:德国Sartorius公司;Agilent5TC-C18(2)色谱柱:美国Agilent公司;C18柱、CM柱、QMA柱:美国Waters公司;microPET:德国Simens公司;小动物麻醉机:SAR-830/P型,美国CWE公司。
1.2 主要材料与试剂
标记前体Fallypride:江苏省原子医学研究所分子影像中心提供;碳酸钾乙腈、甲酸、甲醇:国药集团化学试剂有限公司;氧18水:上海化工研究院;Kryptofix222(K2.2.2):美国Sigma公司;18F-溶液:江原安迪科分子核医学研究发展有限公司提供;异氟烷:上海雅培制药有限公司。
1.3 实验动物
4只正常SD大鼠:0.18~0.2 kg,购自常州卡文斯实验动物有限公司;4只老龄SD大鼠:0.23~0.25 kg,由江苏省原子医学研究所实验动物中心清洁级环境正常饲养22个月以上,实验动物使用许可证号:SCXK(苏)2014-0023。
2 实验方法
2.1 18F-Fallypride制备及分析
根据文献方法[4]按以下步骤制备显像剂18F-Fallypride,加速器生产的18F离子传出后吸附于QMA柱上,用K2.2.2/K2CO3洗脱于反应管,干燥;加入乙腈,干燥后加入4 mg Fallypride前体,在98 ℃油浴锅中反应20 min;加入8×10-3L 水,通气搅拌1 min。反应液经C18柱初步纯化除去氟离子后用10 mL水洗C18柱,再用1 mL乙醇淋洗即得浓缩的18F-Fallypride,初产品再经半制备型HPLC进一步制备纯化。HPLC分析检测方法如下:色谱柱为Agilent5TC-C18(2)250 mm×4.6 mm分析柱,Waters2545泵,紫外检测器(λ=254 nm),流动相A为含0.1%甲酸的水溶液;流动相B为甲醇。梯度洗脱,从1 min的70%A和30%B减少到10 min的40%A和60%B,再从15 min的40%A和60%B增加到18 min的70%A和30%B,流速为1×10-3L/min,柱温(30±0.5) ℃。
2.2 microPET显像
2.2.118F-Fallypride显像 正常SD大鼠和老龄SD大鼠各4只,尾静脉注射18F-Fallypride 3.7 MBg/mL,15 min后进行microPET显像,利用异氟烷-氧气混合气体(2.5%体积分数)麻醉,固定于microPET床板上。层厚0.78 mm,矩阵128×128,采集时间10 min,采集能窗350~650 keV。
2.2.2数据分析处理 microPET显像图采用OSEM 3D迭代法重建,ASIProVM软件勾画纹状体为感兴趣区,根据如下公式计算SD大鼠每克组织的百分注射剂量率(%ID/g)。%ID/g=感兴趣区域放射性物质摄取(μCi/g)/总注射剂量(μCi )×100。PMOD软件融合图像,定量分析脑分区摄取值,统计学分析用SPSS 19.0软件。
2.3 病理实验
显像结束后,腹腔注射10%戊巴比妥钠1 mL,开胸,心室穿刺灌注预冷的生理盐水0.2 L,福尔马林0.2 L,取全脑,冰冻切片,层厚20 μm,行苏木素-伊红(HE)染色,普通光学显微镜观察两组大鼠脑实质及纹状体形态结构变化情况。
3 结果与讨论
3.1 18F-Fallypride制备及质控
18F-Fallypride放射性峰保留时间为9.57 min,标记率>95%,放化纯度>98%。PBS和血浆中放置2 h,HPLC检测放化纯度仍>95%,与文献报道相似[12]。
3.2 microPET显像
注射15 min后PET显像显示老龄SD大鼠双侧纹状体,放射性物质浓聚高,轮廓清晰,形状饱满(图1),注射后15 min摄取值达(0.58±0.11)%ID/g,高于正常SD大鼠(0.39±0.14)%ID/g。PMOD软件分析图像(图2)显示18F-Fallypride广泛分布于各脑区内,纹状体SUV值最高(图3),海马,皮层,丘脑等次之(数据列于表1,PMOD分析主要脑区变化示于图4)。其中老龄鼠扣带皮层、岛叶、下丘脑、嗅球、中脑等摄取值分别为(0.154±0.013)%ID/g、(0.344±0.014)%ID/g、(0.244±0.019)%ID/g、(0.263±0.020)%ID/g、(0.216±0.012)%ID/g,高于正常大鼠(0.120±0.012)%ID/g、(0.182±0.002)%ID/g、(0.111±0.002)%ID/g、(0.127±0.007)%ID/g、(0.083±0.012)%ID/g。
3.3 病理实验
HE染色结果示于图5,显示两组SD鼠脑实质未见明显受损,纹状体染色清晰,正常组神经元胞浆丰富、核清晰可见,老龄SD大鼠可见部分神经元嗜酸性变或核破碎,偶伴有海绵状变形、层状或局灶性神经元坏死,其余无明显形态学改变。
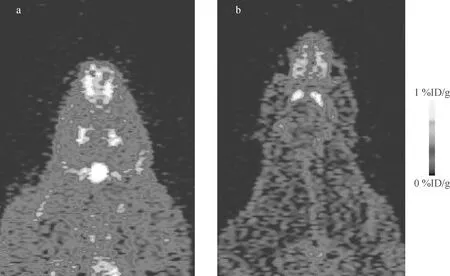
a——老龄大鼠;b——正常SD大鼠图1 大鼠注射18F-Fallypride 15 min后 microPET 显像图a——Aged rats;b——Normal ratsFig.1 MicroPET imaging of rats 15 minutes after injection
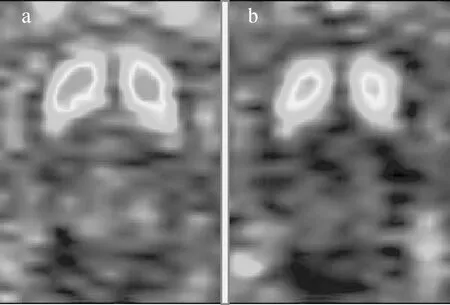
a——老龄大鼠;b——正常SD大鼠图2 大鼠PMOD软件融合图像a——Aged rats;b——Normal ratsFig.2 Fusion imaging of rats by PMOD
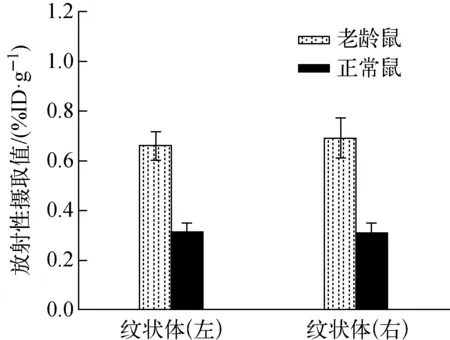
图3 纹状体双侧摄取变化Fig.3 Uptakes of bilateral striatum changes
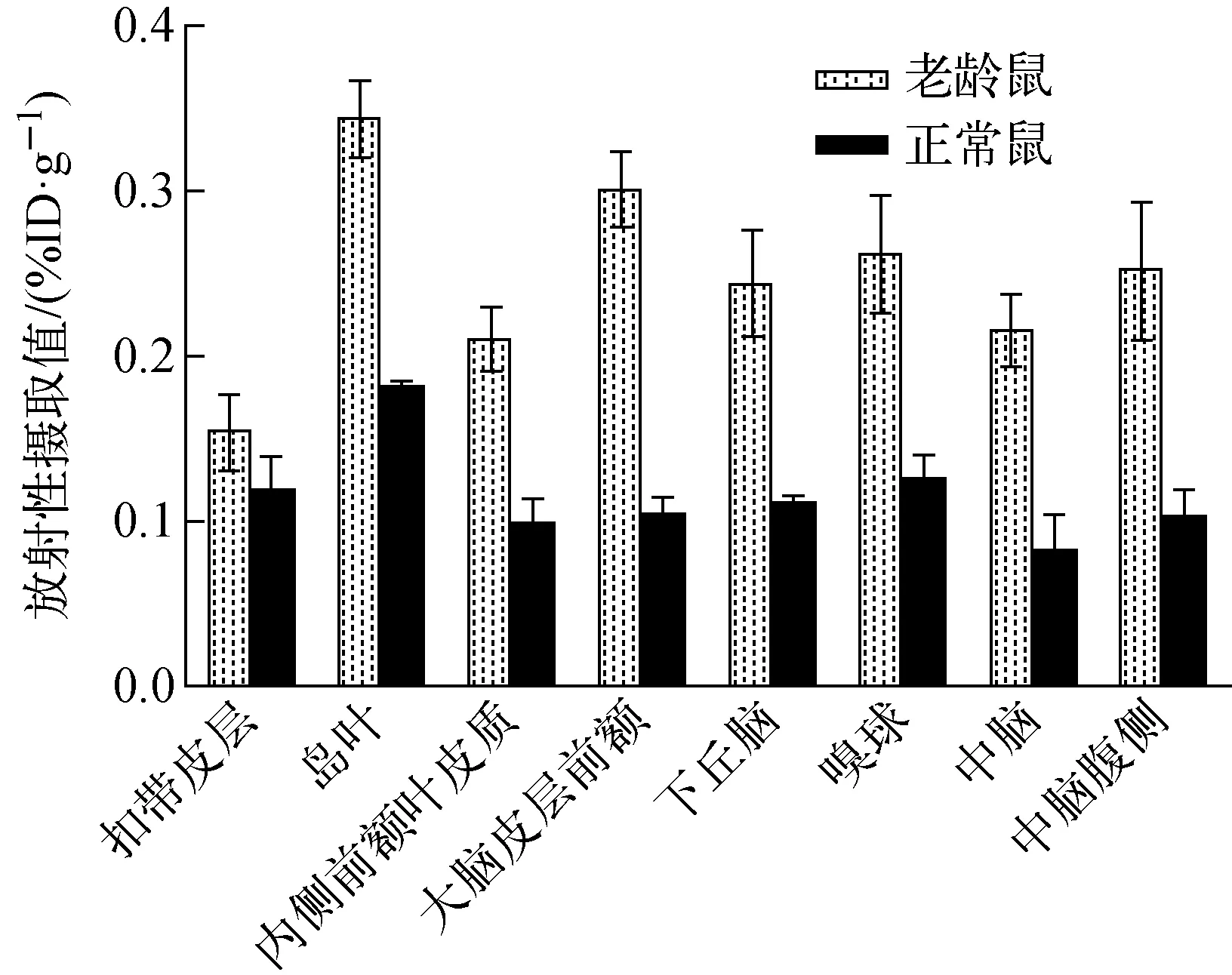
图4 PMOD分析主要脑区变化Fig.4 Main brain region changes analyzed by PMOD
4 小结
(1) 本研究制备了多巴胺D2受体显像剂18F-Fallypride,标记率高,与文献报道相似,稳定性好,为动物体内实验研究打下基础。
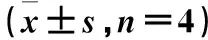
表1 PMOD分析老龄及正常SD大鼠各脑分区摄取值Table 1 Quantitative analysis of standard uptake values of each brain area in aged and
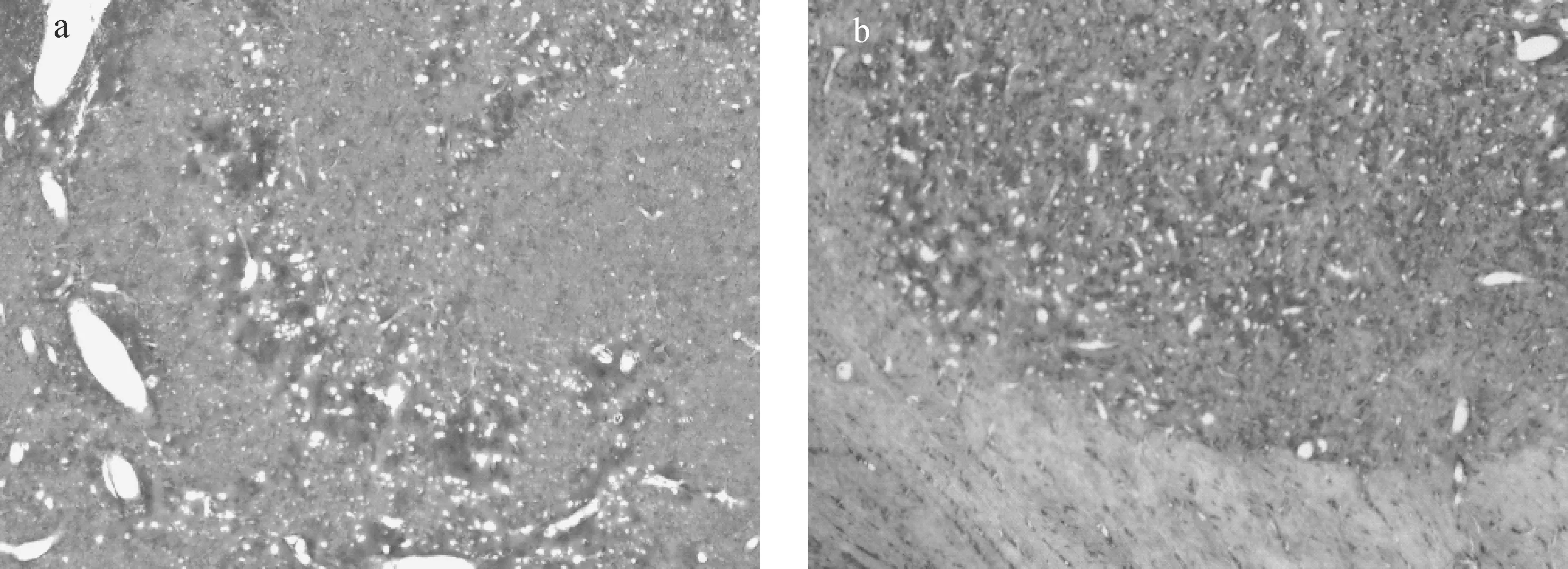
a——老龄大鼠;b——正常SD大鼠图5 大鼠HE染色(×400)a——Aged rats;b——Normal ratsFig.5 HE staining of rats (×400)
(2) microPET显像显示,18F-Fallypride广泛分布于脑内,其中纹状体摄取最高,老龄SD大鼠脑分区摄取普遍高于正常SD大鼠组。
(3) 病理实验显示,两组大鼠脑实质未见明显受损,其中老龄SD大鼠可见部分神经元嗜酸性变或核破碎,偶伴有海绵状变形、层状或局灶性神经元坏死,可能由于这些病理改变,机体发生代偿反应,导致多巴胺D2受体表达增高[13],其余无明显形态学改变。曾有文献报道,早期轻型帕金森病会出现多巴胺D2受体上调[14], 猜测这组老龄SD大鼠可能正处于PD早期阶段,这一发现值得进一步探索。本研究通过核医学显像方式考察了正常及老龄SD大鼠脑多巴胺D2受体表达差异情况,并通过PMOD软件勾画详细分析了正常及老龄SD大鼠脑各分区的数据,可为临床早期诊断年龄相关性神经系统退行性疾病提供新的方法。同时随着中国人口老龄化加剧,以及工业化、城镇化、生态环境及生活方式变化等,阿尔茨海默病、抑郁症的诊治面临更大的挑战,需要进一步探索发病机理,实现早诊断、早治疗。

