纳米核药的研究进展
张华明,罗顺忠,魏洪源
(中国工程物理研究院 核物理与化学研究所,四川 绵阳 621999)
放射性药物是核医学临床诊治的关键因素之一,创新研发可获得特异、高效的放射性诊治药物,为肿瘤治疗提供基础。近年来,纳米技术飞速发展,为放射性药物的设计提供了新的思路。目前,纳米药物、纳米医学领域受到空前关注,所谓“纳米诊疗剂”、“多模态成像剂”多数是用放射性核素标记的纳米材料,属于放射性药物的范畴。核药研发是将放射性核素的特点与纳米粒子的优异性质结合,研发特异性强、疗效佳的纳米核药物(nuclear nanomedicines)。许多纳米粒子具有良好的生物相容性、体内可生物降解性、高选择性和快速在靶组织浓集等特性,对正常组织伤害较小,并可结合诊断和治疗目的等优点成为目前药物研究的热点之一[1]。肿瘤诊治的难点在于通过传统的静脉注射方法不能让肿瘤靶获得杀灭病灶所需要的药物剂量,一是肿瘤组织与其他组织间的高间隙压力(high interstitial pressures),阻止药物从血液循环系统穿透靶组织进入肿瘤内部,使血液循环系统中的药物很快被肝肾清除,导致肿瘤治疗的疗效差;其次是微观上,药物在组织内部均匀分布,为了让肿瘤靶组织获得足够的治疗剂量,必须加大治疗药物的剂量,会对正常组织造成极大伤害[2]。由于纳米粒子具有增强穿透肿瘤靶组织并延长其在靶中保留时间的效应(enhanced permeability and retention effect, EPR),比常规肿瘤治疗药物更容易进入肿瘤内部。纳米核药被肿瘤组织的巨吞噬细胞吸附后[20],由于肿瘤内部缺乏淋巴管, 降低了纳米核药排出靶组织的量,导致纳米核药在靶组织内部的浓集量越来越多,并长时间保留,经过一定时间后,可实现药物的非均相(靶/非靶比值高)分布,从而具有良好的靶向性,使纳米核药成为肿瘤诊治药物研发的重点方向。本文对近
十年纳米核药的研究现状进行了综述,并展望了纳米核药发展的主要方向。
1 纳米核药制备
1.1 载体材料
纳米核药制备的关键是选择合适的纳米平台(platform),纳米平台包括纳米笼子、纳米囊、纳米粒子、纳米纤维、纳米管等,根据纳米平台选择合适的纳米载体材料。纳米核药的载体材料包括无机材料,如碳纳米管(carbon nanotubes)、玻璃、金属的金银等;氧化物,如TiO2、SiO2和无机盐类,如磷酸钙、羟基磷灰石等。生物材料,如壳聚糖(chitosan)、纤维素(cellulose)、树状大分子(dendrimers)、脂质体(liposomes)等,以及高分子聚合物,如聚乙二醇 (polyethylene glycol, PEG)等[3],其结构示意图示于图1。纳米核药载体材料的选择必须考虑药物的制备方法、射线造成的辐射降解、与放射性核素的结合力、防止放射性核素被体液洗提等因素。纳米核药可口服通过胃肠道进入血液系统输运入靶组织,或者通过静脉给药进入靶组织,也可在影像引导(image-guidance)下的靶组织直接注射等给药方式,既要确保纳米粒子的完整性,又要保证放射性核素不泄漏,并降低其对正常组织的辐射损伤。
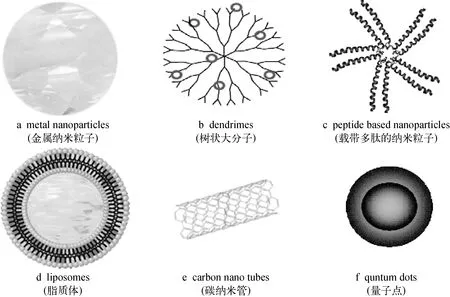
图1 用于纳米药物制备的材料[3]Fig.1 The schematic representation of nanocarriers materials
1.2 制备方法
首先制备纳米粒子,通过辐照获得纳米核药。Marmorato等[4]用质子(23 MeV的氘束)辐照Fe3O4纳米粒子,核反应为56Fe(p,n)56Co,磁纳米粒子中56Fe的丰度为91.72%,质子能量在13 MeV时反应截面为500 mb,活化后的产物衰变为56Co ,γ衰变分支比为99.9%,能量为846.7 keV,半衰期77.26 d,56Co核纯度达99.9%,纳米磁粒子中56Co含量为40.2 μg/g,活度达3×106Bq,可通过高分辨率γ谱仪在体外监测磁纳米粒子的体内生物行为。用富集的165Ho聚乳酸树脂纳米球热中子辐照可得166Ho纳米核药[3],166Ho的放射性核纯度为99.3%。辐射法制备的166Ho玻璃微球示于图2[5],用于肝癌治疗;但后辐照活化法制备纳米微球涉及复杂的辐照过程以及放射性核纯度问题,极少采用此方法制备纳米核药。

(×1 000,平均粒径40 μm)[5] 图2 辐射法制备166Ho-玻璃微球的扫描电镜图(×1 000, average microsphere sizes is 40 μm)[5]Fig.2 The SEM of 166Ho-glass-microsphere by irradiation
将放射性核素包覆在纳米粒子内制备纳米核药。脂质体材料是理想的纳米核药载体包覆材料,易与多数同位素配体结合,产物稳定,脂质体包覆材料制备的纳米核药列于表1。脂质体材料已被多国批准用于超声、荧光、磁共振、SPECT/PET等医学检查。Ehlerding等[6]用脂质体制备64Cu/177Lu纳米核药;一些高分子纳米粒子是在共聚合成过程中,聚合物直接包裹放射性核素制成纳米粒子,这种纳米粒子在体内输运到肿瘤靶组织的过程中,放射性核素被体液洗提的量极少,如乳液共聚制备131I-HEMA-APH纳米共聚物粒子[7]以及131I-聚乳酸纳米粒子,制备示意图示于图3[8],131I-聚乳酸纳米粒子的核心结构为64个肌氨酸(Sar)分子和30个聚乳酸(PLLA)分子嵌段共聚而成,形成纳米粒子的外层,将131I包裹入内部,制备的纳米粒子粒径为46 nm,131I放射性比活度为5×107Bq/L。也可用放射性同位素标记金属和金属氧化物的方法制备纳米粒子[9]。

表1 临床实验中的肿瘤靶向放射性药物纳米载体材料[12]Table 1 The nanotargeted cancer radiopharmaceuticals in clinical trials
化学合成与纳米粒子吸附放射性核素制备纳米核药。对于卤素如131I可采用非水溶性碘化试剂法(Iodogen method)将碘标记上纳米粒子。223,224,225Ra具有优良的核性质,是理想的α放射性治疗核素,由于其化学性质和强α辐射,尚未找到合适的双功能团偶联剂和受体等,以获得靶向药物;采用纳米技术,用含聚乙二醇(PEG)的硅烷作为双功能团处理NaA沸石纳米粒子(粒径30~70 nm),利用沸石丰富的孔洞吸附223,224,225Ra和受体、抗体等生物分子,可制备成纳米核药[10],在生理盐水、氨基酸、人血清液、乙二胺四乙酸(EDTA)等溶液中具有高稳定性,可用于肿瘤的α靶向治疗。
1.3 放射性核素
根据诊断和治疗目的选择合适的核素,如131I、125I、166Ho、177Lu、90Y、225Ac、223,224,225Ra、64Cu、111In[2,4-6,8]等核素是用于纳米核药的重要核素,既可选取131I、111In作为SPECT诊断药物的核素,又可选用64Cu作为PET诊断核素。在治疗核素的选取方面,根据不同肿瘤、不同器官与组织,甚至不同分期的肿瘤选择适合治疗的α、β发射核素。理论上,俄歇电子、α粒子、β粒子在人体组织内的穿透距离分别为0.001~1 μm、40~80 μm、0.3~10 mm。单个肿瘤细胞的直径为15~30 μm,肿瘤结节直径为2 mm~cm级(40~80个肿瘤细胞);对于早期15~30 μm的肿瘤,可选用发射α粒子的核素;对于2~20 mm的肿瘤,可选用发射β粒子核素,从而获得更有效的治疗纳米核药。
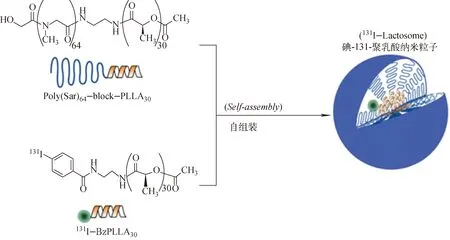
图3 131I-聚乳酸纳米粒子制备示意图[8]Fig.3 The preparation of 131I-polylactosome nanoparticles[8]
核素与纳米粒子结合方法主要有三种。一是包裹法,用物化性质和生物性质适合药物制备的材料,将放射性核素包裹住,防止药物在体内运转过程中放射性核素被体液洗提,进入血液循环系统;另一种包裹法是将有机分子标记放射性核素,再用高分子单体聚合包裹标记物。二是吸附法,先制备多孔纳米材料,用偶联剂处理多孔纳米粒子,然后吸附放射性核素,制成纳米核药,如金纳米粒子吸附125I[18];在溶液中用含Ag粒径为15~32 nm的二氧化钛纳米粒子吸附211At,制备TiO2-Ag-211At纳米粒子[19]。三是生物法,用多糖,如聚乳糖、脂质体等与单抗(mAbs)、适体(aptamers)、多肽( peptides)或各种受体特征受体分子(various receptor-specific substrates)形成稳定结构,用双功能团分子处理放射性核素后,用载带生物分子的纳米粒子与双功能团处理的放射性核素反应,制备成纳米核药,具有放射免疫治疗的效果。
2 纳米核药的生物行为
纳米核药生物行为研究包括体内生物分布、药代动力学、体内行为、毒性研究等。预临床模型实验表明,纳米核药的药代动力学、体外排泄和全身长期毒性等需要进一步研究,取得理想疗效后,才能用于临床应用。
2.1 体内行为
肿瘤生长到1~2 mm时,需要氧气和营养支持其生长和扩散,只有肿瘤内部生成血管输运氧气与营养才能支撑肿瘤组织的生长,但肿瘤组织的生长速度远高于血管的生长速度,导致肿瘤组织内部的血管生长极不规则,血管壁产生巨大孔腔(lumen),正常血管壁孔径为2~6 nm,而肿瘤血管壁的孔径为10~300 nm。通过动脉将直径超过10 nm的纳米核药注入后,药物大量进入肿瘤组织[6-7,12]。体积较大的肿瘤,内部的血管较少,对常规标记的生物分子或化合物浓集差,而纳米核药利用肿瘤血管的孔腔更易于进入肿瘤,实现靶组织的高浓集率和长滞留时间。
纳米粒子粒径约200 nm时,可激活人体辅助系统(human complement system)并促进枯否细胞(kupffer cell)将纳米粒子从血液中清除。脾细胞可过滤捕捉200~250 nm或大于此粒径的粒子,肝细胞可过滤捕捉大于150 nm的粒子;而肿瘤的毛细血管直径很少超过300 nm,因此,目前研发的纳米核药的粒径一般低于200 nm,而磁性粒子因需要大量浓集在网状内皮系统则要求其粒径低于100 nm[24]。
2.2 毒性研究及临床应用
纳米核药研发和应用已成为核医学的研究热点之一,国际原子能机构(IAEA)资助进入临床应用的纳米药物品种列于表2。纳米核药的生理毒性取决于纳米粒子的性质,如大小、形状和组成、比表面积、团簇稳定性、表面化学与电荷等,示意示于图4[13],同时,与载带的药物、核素等都有关系。因此,纳米核药的毒理学研究相对其他核药更严谨细致,否则会严重危及患者的生命。
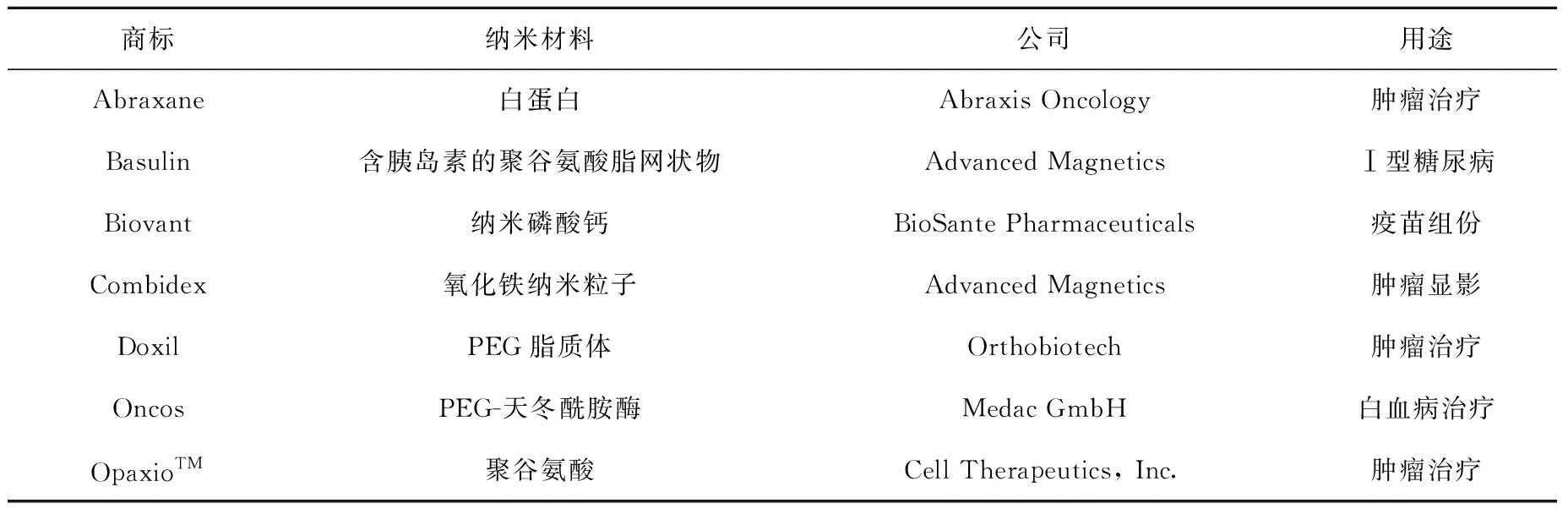
表2 临床应用的纳米药物Table 2 Some of clinically available nanoparticle containing drugs
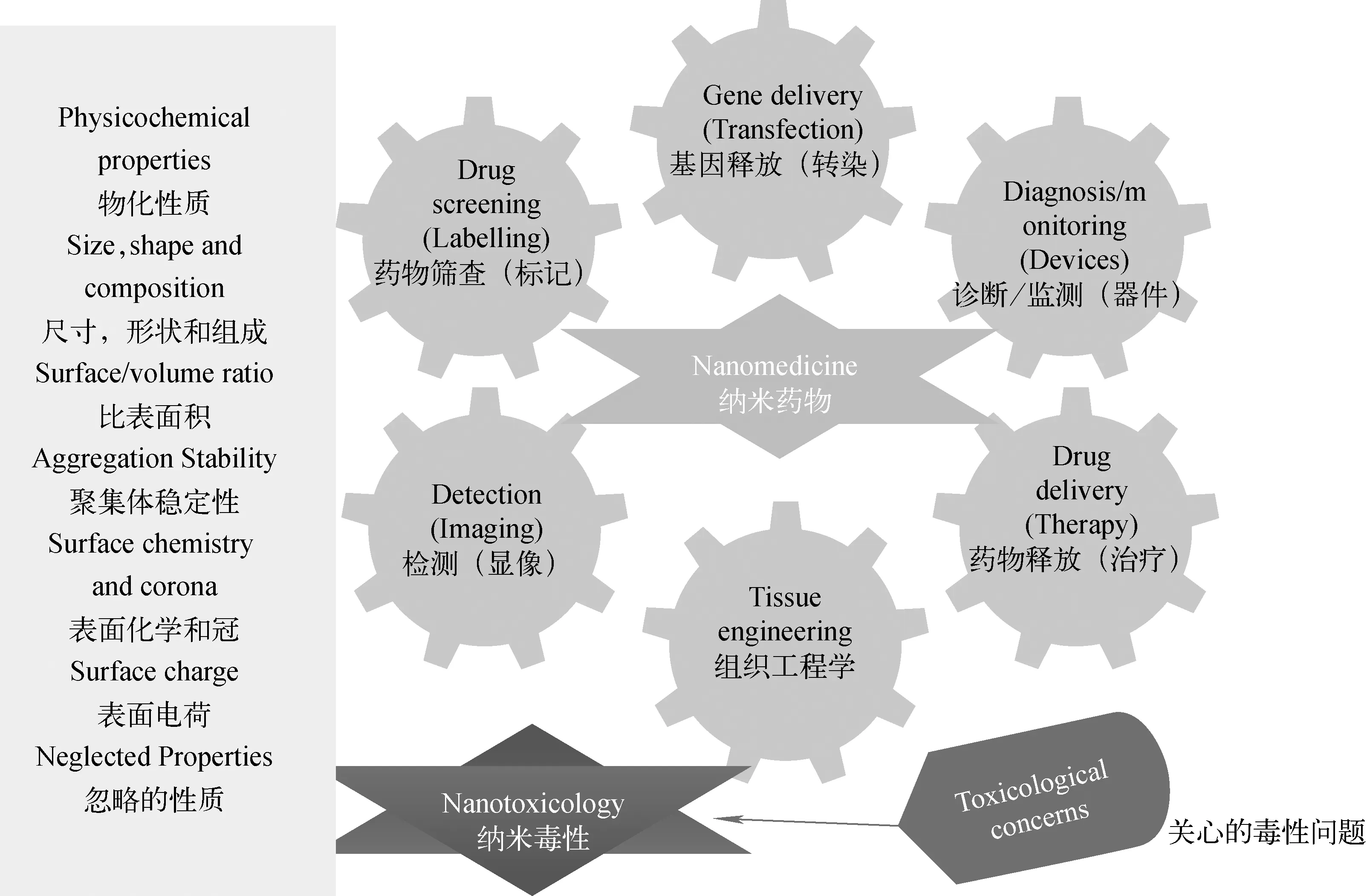
图4 纳米粒子物化性质对纳米药物生物毒性的影响[13]Fig.4 Influence of nanomedicines biological toxicity by nanoparticles physicochemical properties[13]
到2011年为止,美国已经批准了35个纳米药物用于临床[4],表2中的纳米药物已被美国食品药品监督管理局(FDA)批准在临床使用,对人体的毒性满足临床的要求,这些药物尽管不是纳米核药,但其载体材料是纳米核药常用的载体材料与纳米平台。利用已被核准临床应用的载体材料可减少纳米核药毒性研究的过程,加快纳米核药的研发。
研究表明,金属、金属氧化物、富勒烯等为纳米载体材料时对人体的毒性较大;生物相容材料、生物分子材料等对人体的毒性较低或几乎没有毒性,因此,需要对不同纳米药物的毒性经过严格、科学和长期的研究,才能用于临床医学。
纳米药物的主要应用领域示于图5,由图5可见,其中42%的纳米药物用于肿瘤诊治。而纳米核药主要应用于肿瘤的临床诊治,加快纳米核药的研制对治疗肿瘤具有重要意义。
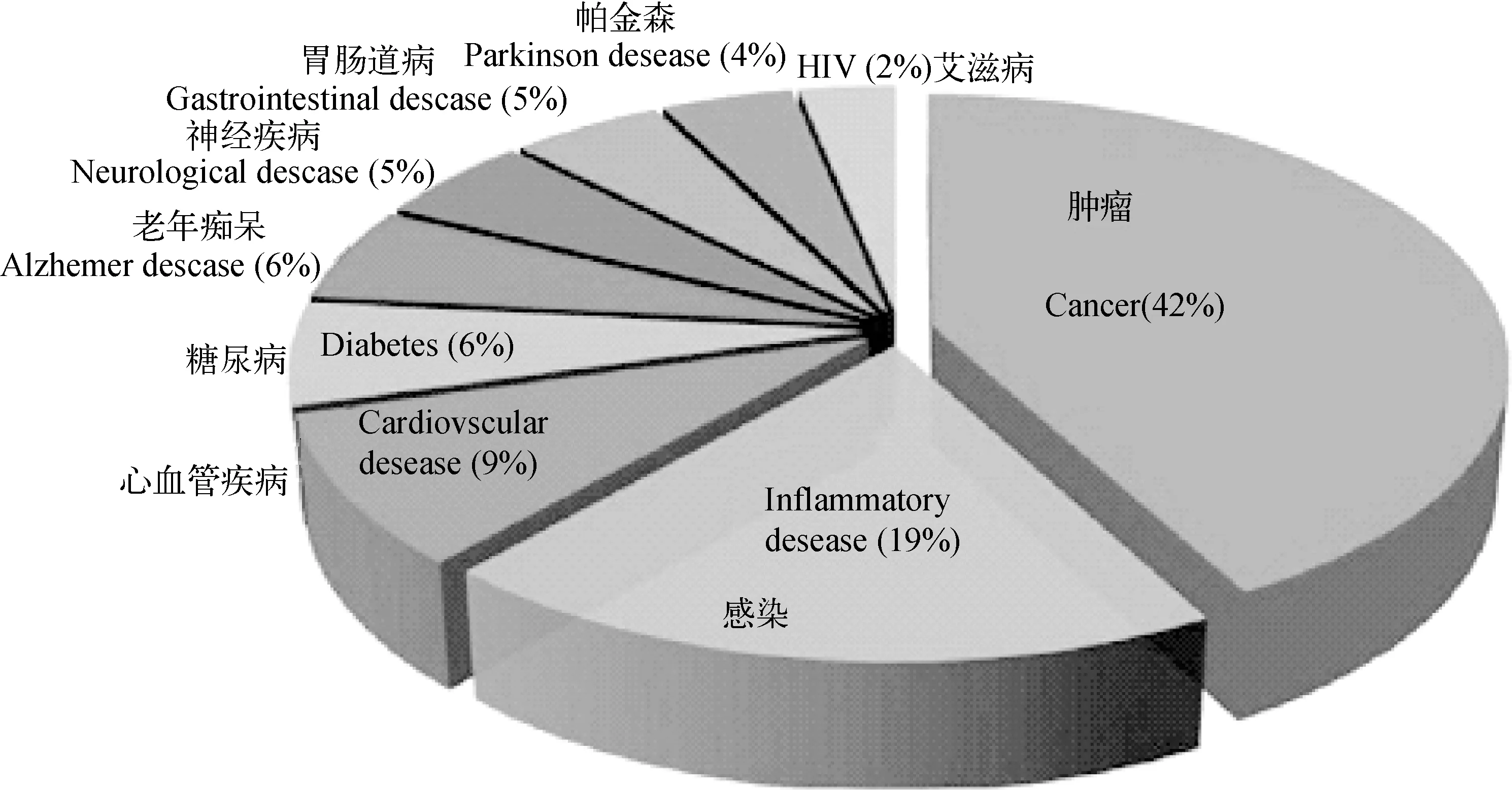
图5 纳米药物的主要应用领域[16]Fig.5 Application scope of nannmedicines[16]
2.3 生物分布和药代动力学
纳米核药的生物分布与药代动力学研究,以及体内稳定性研究已有详细报道[1,3-8,10-11],纳米核药对放射性核素固定牢固度研究建立在体外研究的基础上,将制备的纳米核药置入人血清溶液、磷酸缓冲盐(PBS)溶液、生理盐水溶液、EDTA溶液、乙醇溶液等模拟人体体液的溶液中,在37 ℃下恒温保持(incubation)24 h以上,取溶液测量放射性计数,计算被洗提的放射性活度,评估其体内稳定性。
诊断和治疗两用的纳米核药,如用111In标记的-DOTA-聚乳糖(Lactosome)纳米粒子作为乳腺肿瘤的SPECT诊断药物[11],将111In换成90Y-DOTA-聚乳糖可治疗乳腺肿瘤。静脉注射111In-DOTA-聚乳糖24 h后,SPECT清晰显影靶组织;111In-DOTA-聚乳糖在体内的生物半衰期为11 h,纳米粒子增强了药物在靶组织的渗透和滞留。皮下注射90Y-DOTA-聚乳糖的乙醇溶液,可以获得较佳的靶组织渗透与滞留效果,90Y-DOTA-聚乳糖与DOXIL@共用,15 d后肿瘤靶组织停止生长。
在估算纳米核药的肿瘤治疗剂量时,体积较大的肿瘤,内部的血管较少,对药物浓集差,如64Cu-liposomes 用于估计177Lu-liposomes的治疗剂量[6],测得小体积的肿瘤(2 g)吸收剂量为22.8 kGy,而大体积的肿瘤吸收剂量仅为2.3 kGy,这对确定治疗剂量带来困扰,经过计算与评估,才确定人的注射剂量为 200 MBq。177Lu-DOTA-TOC或177Lu-DOTA-TATE即将在临床上用于神经内分泌瘤(neuroendocrine)的靶向治疗。但10% PEG-177Lu-liposomes溶液在脾、肝和胃壁有较高的吸收剂量,分别为2.54×10-2mSv/MBq、2.14×10-2mSv/MBq、3.25×10-2mSv/MBq,临床上需要考虑这些不利因素。
纳米核药注入体内后,与体内生物大分子发生系列反应,进入血液的纳米药物,会在其表面吸附血清白蛋白等形成蛋白冠(protein corona),蛋白冠控制纳米核药与细胞膜相互作用及靶组织对纳米药物的吸收,且蛋白冠会影响纳米颗粒在体内的代谢行为。为了克服纳米粒子进入体内形成的蛋白冠对药物的不利影响,可在体外对纳米粒子表面进行修饰,如用载脂蛋白A-Ⅳ(ApoA4)或载脂蛋白C-Ⅲ(ApoC3)对纳米粒子修饰后,降低了肿瘤细胞对纳米药物的吸收;用载脂蛋白H(ApoH)修饰后,显著增加了肿瘤细胞对纳米药物的吸收[14]。
纳米粒子与血液中蛋白质形成的蛋白冠有两层。与纳米粒子直接接触的第一层称为硬冠(hard corona),结合力高,不易脱落;第二层蛋白冠通过弱键与硬冠链接,称为软冠(soft corona),软冠的蛋白质可以与血液中的物质发生交换。形成蛋白冠后,增加了纳米药物在血液中的循环半衰期(blood circulation half-life),降低了纳米核药的肝肾代谢率和靶组织浓集效率,纳米核药长时间保留在血液中,增加了对健康组织的伤害。为了降低纳米粒子表面蛋白冠的形成,可用亲水性物质如PEG对纳米粒子表面进行处理,赋予其空间稳定性,抑制蛋白冠的形成,降低纳米核药的毒性[21-22]。
小于100 nm的纳米银药物口服进入肠道,先通过肠粘膜上皮细胞,然后进入血液和淋巴,不会直接被淋巴系统摄取[15]。TiO2纳米粒子进入怀孕小鼠体内后,造成生下的小鼠中枢神经和生殖系统受损[13]。静脉注射银纳米粒子对脑血管生长造成毒害,实验证明,纳米银粒子破坏血脑屏障,引起脑神经功能退化[16]。体内外实验研究表明,纳米颗粒直接影响机体的免疫功能,通过抑制或增强机体免疫功能调节机体免疫响应。对生理过程的关键是能量代谢,涉及许多细胞反应,如氧气消耗,解偶联代谢,腺苷三磷酸(ATP)水解,控制和调节代谢率,产生热量和自由能消耗(dissipation),这些细胞层面的生化反应生产涉及酶和辅酶[17]。
3 纳米核药展望
3.1 双功能偶联剂
放射性核素与有机配体、生物活性物质如多肽、抗体、氨基酸等标记时,有的需要双功能团偶联剂为中间体进行标记,才能获得稳定的标记物。α放射性核素衰变发出高能电离辐射,难以获得理想的双功能团分子,如常用的DOTA、碳巢烷、穴状化合物(cryptand)、杯芳烃等用于α放射性核素标记的双功能团分子时,其产物的体内外稳定性较差,导致靶向肿瘤诊治药物的研究难度较大。β放射性金属核素可根据需要标记的生物分子种类选择合适的DOTA衍生物,如NHS-DOTA、1B4M-DOTA、MeO-DOTA、CHX-A″-DTPA等,来获得性能优良的制剂。而卤素放射性核素与生物分子的标记很少需要双官能团偶联剂。因此,针对无合适双官能团偶联剂的α治疗核素,优先选择纳米粒子,可制备选择特异性、高靶组织浓集率和体内稳定性良好的纳米核药。
3.2 纳米粒子载体材料
在纳米粒子载体材料方面,应从生物友好性、耐辐射性和人体内耐生物化学降解等方面考虑,羟基磷灰石、磷酸钙、脂质体、聚乳酸等是较好的纳米包裹材料[23]。还可选用亲酯亲水聚合物,如聚苯乙烯与聚乳酸的嵌段共聚物,亲脂性的刚性聚苯乙烯作为纳米粒子芯,用于保持其力学性能和刚性,固定治疗剂;亲水性的聚乳酸置于纳米粒子表面,提升药物的血清除率和在组织内的转运效率[8]。纳米粒子的制备方法根据不同载体材料确定,点击化学合成(click),较适宜于短半衰期放射性核素纳米核药的制备。
3.3 标记用核素
目前,关注的重点为诊治两用纳米核药的研发,利用同一种元素的不同核素制备诊治纳米核药,如124I-标记纳米核药用于诊断,将124I换成131I,即可成为治疗药物;还可利用化学性质相近的核素制备诊治纳米核药,如99mTc与188Re、111In与90Y、123,124I与211At,前一个核素用于诊断,后一个核素用于治疗。目前,较理想的诊治一体核素为186Re、188Re,188Re由188W/188Re发生器提供,发生器可用6个月,每2 d淋洗1次,188Re发射的β射线可穿透4 mm深的组织,由低分支比的155 keV γ射线发射,用于监测药物在体内的分布和代谢过程[2];177Lu核性质优异、价廉易得和诊治两用等优点,已成为纳米药物研究重点关注的核素。
有的纳米核药经口服、静脉注射等用药方式不能获得肿瘤治疗需要的药物浓集量与保留时间(EPR),新的给药方式采用影像引导(image-guidance)将药物直接注射到肿瘤组织,改进注射针头设计,降低了注射药液的回流,肿瘤组织中的巨吞噬细胞可将纳米核药固定,显著提高了纳米核药在靶组织的浓集与保留[2]。
由于大体积肿瘤内部血管的缺乏,导致目前的放射免疫药物和标记化合物的靶组织浓集率较低,不利于肿瘤的诊治,而纳米核药可克服这些缺点。纳米核药多模功能示意图示于图6,即一个纳米粒子内可含有放射性诊治的核素、发热、化学发光、磁、蛋白质、多肽、基因等功能团,还有治疗增强剂等[23],这对纳米材料与纳米平台提出了严峻的挑战,尤其是对其工程化提出了严苛的要求,需要核物理、放射化学、生物化学、材料学、计算机理论研究和辅助设计等多学科的融合,才能成功。
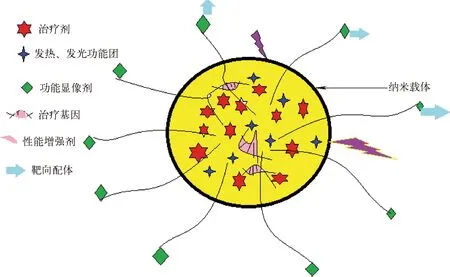
图6 纳米药物未来的多模功能示意图Fig.6 The scheme of multifunctional nanoparticles in future

