肿瘤PET分子探针3-O-(2-18F-氟乙基)-L-多巴的合成及初步生物学评价
马晶鑫,伍 洲,姜申德,王红亮,3,武志芳,3
(1.山西医科大学第一医院 核医学科,山西 太原 030001;2.天津大学 药物科学与技术学院,天津 300072;3.山西省分子影像精准诊疗协同创新中心,山西 太原 030001)
18F-氟代脱氧葡萄糖(18F-Fluorodeoxyglucose,18F-FDG)是目前正电子发射断层显像(positron emission tomography, PET)常用的一种糖代谢型显像剂,但存在特异性差、脑肿瘤检出率低、肿瘤与炎症的鉴别诊断假阳性或假阴性等问题[1-2]。氨基酸代谢类肿瘤PET显像剂是18F-FDG在临床肿瘤PET显像应用中的重要补充[3]。O-(2-18F-氟代乙基)-L-酪氨酸(18F-FET)是目前临床上常用的脑肿瘤PET显像剂[4-5]。6-18F-氟-L-多巴(18F-FDOPA)是脑肿瘤及神经系统等疾病的较理想显像剂,经过方法改进、新型标记前体的研发及手性相转移催化法的应用,18F-FDOPA的合成越来越简单,但仍存在合成时间长、前体制备复杂、副产物多、对设备条件要求较高等诸多问题[6]。因此,本研究以多巴为原料,向其芳香环上直接引入带有易离去基团的碳链,采用同18F-FET类似的亲核取代反应实现18F标记,合成一种新型18F标记的多巴衍生物3-O-(2-18F-氟乙基)-L-多巴(3-O-(2-18F-fluoroethyl)-L-DOPA,18F-FEDOPA)。并通过体内生物分布及肿瘤PET显像评价其作为一种新型的氨基酸代谢类肿瘤PET显像剂的可行性。
1 实验材料
1.1 主要仪器与装置
回旋加速器(HM-10型):日本住友公司产品;Micro-PET/CT扫描仪(IRIS, Inviscan):法国Inviscan公司产品;核磁共振波谱仪(AV300 MHz):德国Bruker公司产品;高效液相色谱系统(HPLC)(Series Ⅲ型,Lab Alliance):美国Lab Alliance公司产品,配有B-FC-3600型高能放射性检测器(美国Bioscan公司产品)和201型紫外检测仪(美国Lab Alliance公司产品);C18分析型色谱柱(5 μm, 250 mm×4.6 mm):英国GRACE/Hichrom公司产品;C18半制备型色谱柱(5 μm, 250 mm×10 mm):日本YMC公司产品;全自动双探头放射免疫γ计数器(SN-697型):上海核所日环光电仪器有限公司产品;Sep Pak QMA小柱:美国Waters公司产品。
1.2 主要材料与试剂
4,7,13,16,21,24-六氧-二氮双环[8.8.8]二十六烷(Kryptofix 2.2.2,K2.2.2):法国ABX公司产品;无水乙腈(CH3CN)、无水碳酸钾(K2CO3):美国Sigma-Aldrich公司产品;其余试剂均为国产分析纯或化学纯;实验用水为去离子纯化水;瘤株:纤维肉瘤(S180)和肝癌(H22)细胞株:购于上海细胞库。
1.3 实验动物
健康美国癌症研究所(institute of cancer research, ICR)小白鼠25只,雌雄不限,20~25 g,清洁级,山西医科大学实验动物中心提供。许可证号:SCXK(晋)2015-0001。
1.4 实验条件
1.4.1HPLC色谱条件 分析:C18分析型色谱柱,流动相为乙腈(A)和水(B)的混合液(体积比为1∶9),流速为1 mL/min,紫外(UV)波长为254 nm。分离纯化:C18半制备型色谱柱,流动相为乙腈(A)+水(B)混合液,流速为3 mL/min,流动相中乙腈(A)的梯度条件为0~1 min:10%;1~20 min:10%~80%;20~25 min:80%~10%。
1.4.21H NMR条件 以氘代氯仿(CDCl3)为溶剂,四甲基硅烷(TMS)为内标。
2 实验方法
2.1 前体化合物合成
前体化合物的合成路线示于图1。以L-多巴(L-DOPA)为原料,在甲醇及氯化亚砜参与下发生甲酯化反应,得到化合物2(L-DOPA甲酯);在四氢呋喃(THF)中,使用2.1倍当量的二碳酸二叔丁酯(Boc2O)对化合物2的α-氨基和4-羟基进行保护,得到化合物3;将化合物3加入丙酮溶剂中,由K2CO3和18-冠-6共同催化,与乙二醇二对甲苯磺酸酯反应,得到前体化合物4(N-叔丁氧羰基-(3-O-甲苯磺酸酯乙基-4-O-叔丁氧羰基)-L-多巴甲酯)。另外,为了获取参比化合物3-O-(2-[19F]氟乙基)-L-多巴([19F]FEDOPA),在K2CO3和18-冠-6共同催化下,化合物3在丙酮溶剂中与2-氟代乙醇对甲苯磺酸酯反应,得到未脱BOC保护的参比化合物5。
2.2 18F-FEDOPA的放化合成
18F-FEDOPA的合成路线示于图2。1) 加速器产出的18F-经Sep Pak QMA柱捕获,用1.5 mL K2.2.2/K2CO3水溶液将18F-洗脱至反应瓶中。2) 110 ℃下通入氮气,吹干,加入2 mL CH3CN再次共沸蒸干。3) 向反应瓶内加入8~9 mg前体化合物4(1 mL CH3CN溶解),110 ℃油浴中密封反应15 min。4) 反应结束后使用半制备型HPLC分离纯化,收集放射性保留时间tR=12.5 min的产品至蒸馏瓶。5) 将收集的溶液于40 ℃下旋蒸除去溶剂后,加入4 mol/L HCl水溶液(0.3 mL),110 ℃下密封加热20 min后,使用0.6 mL 2 mol/L NaOH水溶液中和,加入注射用水稀释后过滤膜待用。
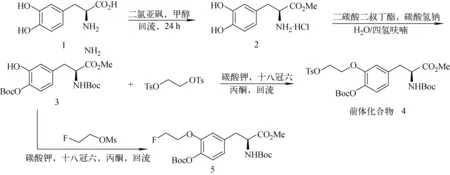
图1 18F-FEDOPA前体化合物的合成路线Fig.1 Synthesis of the precursors of 18F-FEDOPA
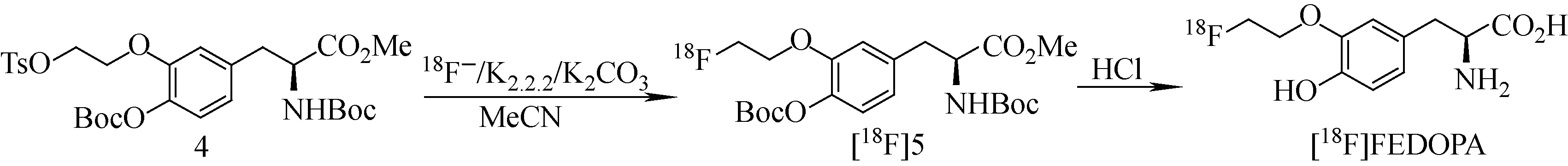
图2 18F-FEDOPA的放化合成Fig.2 Synthesis of 18F-FEDOPA
2.3 质量控制及体外稳定性检测
2.3.1质量控制 用精密pH试纸测定18F-FEDOPA注射液的pH。用带有放射性检测器的分析型HPLC测定化合物5、18F--洗脱液、18F-5以及18F-FEDOPA的保留时间和放化纯度。
2.3.2体外稳定性检测 将18F-FEDOPA溶液室温静置,于标记后0、60、120、240 min按上述HPLC分析条件测定放化纯度。
2.4 体内生物分布
健康ICR小鼠4组,每组3只,腹腔注射0.2 mL的3.6%的水合氯醛溶液进行麻醉。尾静脉注射18F-FEDOPA(0.2 mL,1.85 MBq)。注射后于10、30、60、90 min时,眼静脉取血后断颈处死,解剖取心、脑、肝、肾、肺、肠、肌肉及骨等组织脏器,分别测定各组织的质量与放射性计数,计算每克组织衰减校正后的百分注射剂量率(%ID/g)。
2.5 肿瘤模型制备
将H22肝癌细胞和S180肉瘤细胞株用灭菌生理盐水配制成1×107mL的浓度, 接种于正常ICR小鼠腹腔,每只小鼠腹腔注射0.2 mL,1周后待其腹腔充盈后抽取腹水待用。取ICR小鼠若干只,在其肢体左、右侧皮下同时分别植入H22和S180小鼠肉瘤腹水(0.2 mL,肿瘤细胞数约6(105mL),1周后待肿瘤生长至直径约0.8~1.0 cm时使用。
2.6 PET/CT显像
荷H22、S180肿瘤ICR小鼠3组,每组3只,腹腔注射0.2 mL的3.6%的水合氯醛溶液进行麻醉。第一组经尾静脉注射18F-FEDOPA(0.2 mL,3.7 MBq)后立即行PET动态扫描,总采集时间90 min。图像预处理:将每10 min采集的数据分割为一帧,共9帧。图像重建采用基于蒙特卡罗系统模型的3D OSEM(ordered subsets expectation maximization)算法。先行PET采集后再行CT扫描。CT图像重建采用Feldkamp滤波反投影算法,并执行射束硬化校正及环形伪影校正。图像分析采用PMOD软件(PMOD Technologies LLC, Zurich, Switzerland)进行,勾画出肿瘤、心脏、脑、肌肉等感兴趣区域 (volume of interest, VOI),并导出时间活度曲线(time-activity curve, TAC)。第二、三组小鼠分别注射18F-FDG(0.2 mL,3.7 MBq)和18F-FEDOPA(0.2 mL,3.7 MBq),于注射60 min后均行10 min的PET静态扫描和CT扫描,并进行图像重建以及对各感兴趣组织的定量分析,确定每克组织的百分注射剂量率(%ID/g),并计算肿瘤与非肿瘤组织的放射性摄取比(T/NT)。
3 结果与讨论
3.1 化学合成
参照18F-FET合成方法,设计合成了18F-FEDOPA新的前体化合物4。在L-多巴分子苯环的3-羟基处引入一个带有易离去基团的碳链,既便于通过亲核反应实现18F标记,又能有效保留多巴分子的α氨基和羧基的完整结构。
18F-FEDOPA前体化合物4以L-多巴为原料,制备过程均为常见化学反应:化合物2制备为常规酸催化甲酯化反应;化合物3的制备根据其分子结构中的α-氨基,以及苯环上3和4-羟基的反应活性的不同,使用适量的二碳酸二叔丁酯为保护试剂,得到了叔丁氧羰基对α-氨基和苯环上4-羟基选择性保护的化合物3;前体化合物4的合成在碱性条件下使用乙二醇二对甲苯磺酸酯对3-OH烷基醚化的反应。另外,为便于对18F-FEDOPA的放化合成过程进行有效监控及产品确认,使用了制备化合物4相同的条件,由化合物3与化合物2-氟代乙醇对甲苯磺酸酯经醚化反应,得到18F-FEDOPA未经脱出BOC保护的参比化合物5。化合物3、4、5经核磁鉴定后,确定了结构的正确性。
化合物3:淡黄色油状物(8.02 g,76.2%),1H NMR(CDCl3):1.424(s,9H,N-Boc-CH3),1.556(s,9H,O-Boc-CH3),3.013-3.026(m,2H,DOPA-CH2),3.707(s,3H,OCH3),4.542-4.557(m,1H,DOPA-CH),5.021(d,J=7.9 Hz,1H, DOPA-NH),6.654(d,J=8.2 Hz,1H,6-ArH),6.776(d(br),1H,2-ArH),7.083(d,J=8.2 Hz,1H,5-ArH)。

化合物5:黄色油状液体(0.43 g,76.7%),产率76.7 %;1H NMR(CDCl3):1.423(s,9H,N-Boc-CH3),1.548(s,9H,O-Boc-CH3),3.060(dq,J=6.1 Hz,J=14 Hz,2H,DOPA-CH2),3.711(s,3H,OCH3),4.235-4.276(m,2H,CH2-O-Ar),4.580(dd,J=6.3 Hz,J=13.7 Hz,1H,DOPA-CH),4.714(d,AA′BB′,J=48 Hz,2H,CH2-F),4.982(d,J=8.0 Hz,1H,DOPA-NH),6.725-6.756(m,2H,ArH),7.050(d,J=8.1 Hz,1H,5-ArH)。
3.2 18F-FEDOPA的制备
3.3 质量控制
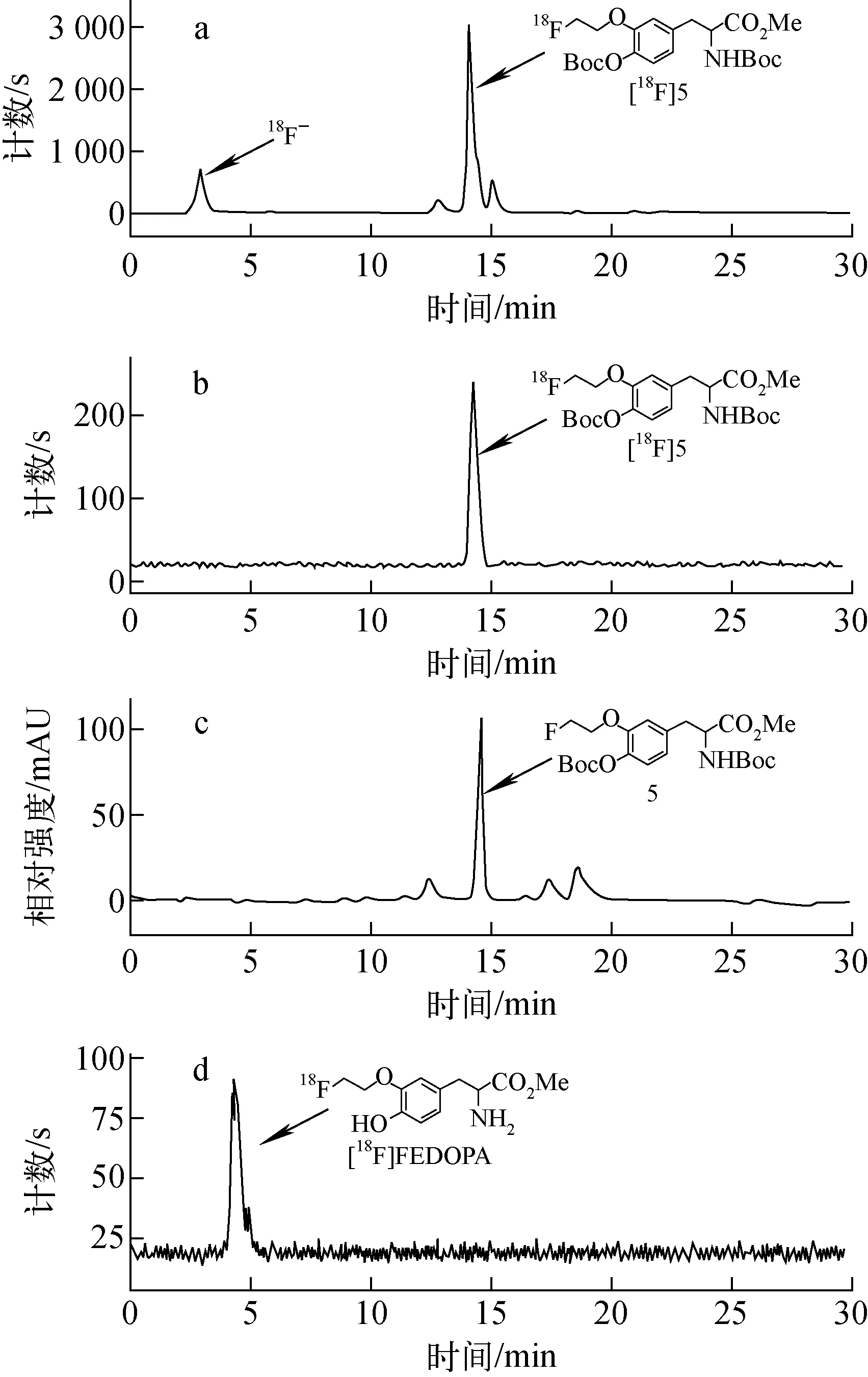
图3 放射性(a、b、d)和紫外(c)HPLC图谱Fig.3 Radioactivity (a, b, d) and UV (c) HPLC chromatograms
前体化合物4经18F-氟化反应后进行Radio-HPLC分析(图3a):18F-的保留时间为2.8 min,18F-5的保留时间为14.3 min;经半制备柱HPLC分离纯化后,将18F-5与化合物5同时经Radio(图3b)-UV(图3c)HPLC分析显示,两者保留时间均为14.3 min,证明18F-5结构的正确性。然后经4 mol/L HCl加热后得到目标产品18F-FEDOPA,Radio-HPLC保留时间为4.5 min(图3d),放化纯度为99%。分析过程中发现,在酸性条件下,产品在HPLC中的保留时间较长,中和至中性到弱碱性,产品保留时间则稍有前移(保留时间提前约0.5 min)。可能在碱性条件下,18F-FEDOPA的羧基会以羧酸盐的形式存在,分子结构带有负电荷,分子的极性增大,18F-FEDOPA在反相的C18柱上滞留性稍降低。在中性或酸性条件下,则是羧酸的形式,呈电中性,在C18柱上的滞留性较在碱性条件下滞留性增加。18F-FEDOPA注射液为无色澄清溶液,pH约6~7。室温下0、60、120、240 min的放化纯度分别为:98.65%、98.58%、97.98%、97.49%,4 h内放化纯度没有明显降低,均大于95%,表明其稳定性良好。
3.4 体内生物分布
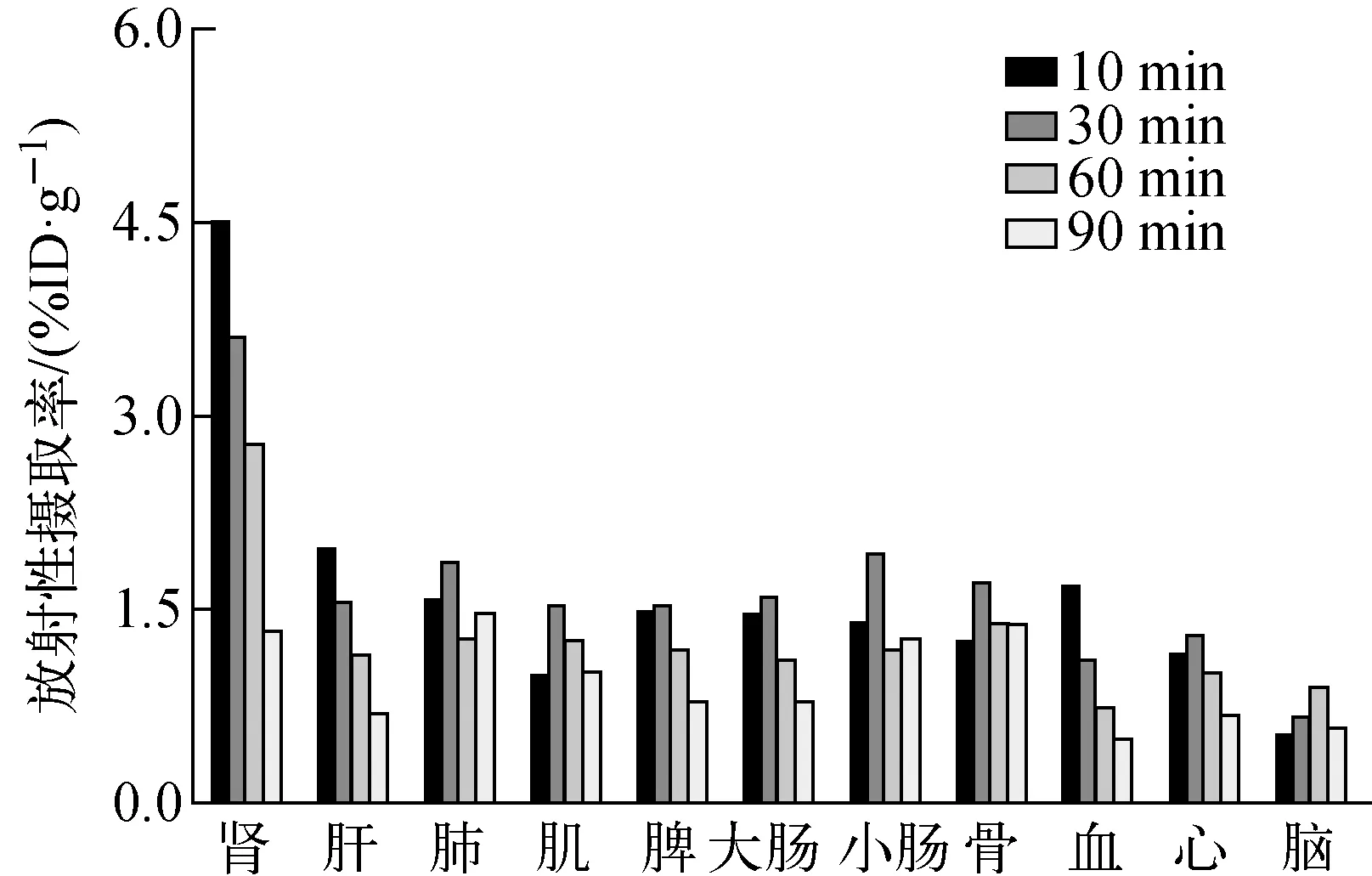
图4 18F-FEDOPA的健康小鼠体内生物分布Fig.4 The biodistribution in healthy mice of 18F-FEDOPA
18F-FEDOPA在健康小鼠体内的生物分布结果示于图4。由图4结果可见,18F-FEDOPA主要通过肾脏代谢,注射后10、30、60、90 min时的肾脏放射性摄取率分别为(4.50±0.54)、(3.62±0.53)、(2.76±0.36)、(1.33±0.25)%ID/g。血液放射性随时间增加逐渐降低,90 min时即降至(0.50±0.09)%ID/g。骨骼的摄取值无明显增加,说明其在体内未发生脱氟,体内稳定性良好。心脏和脑组织的放射性摄取明显低于其他组织,且随时间增加未见明显增大,60 min时的摄取值分别为(1.01±0.18)、(0.90±0.24)%ID/g,与大部分氨基酸显像剂的分布特性相似,具备良好的药代动力学特性[7-9]。
3.5 PET/CT显像
本研究成功制备了S180纤维肉瘤-H22肝癌一体模型,并完成了18F-FEDOPA 90 min动态PET/CT显像。注射18F-FEDOPA 10 min后即出现肿瘤显影,随时间增加,体内放射性迅速清除,肿瘤显示更加明显。TAC曲线示于图5,H22和S180肿瘤均有较明显的显像剂摄取,且10 min后H22相对较高。肿瘤摄取值随时间逐渐增加,60 min时达到峰值:H22为(6.375±1.025) %ID/g,S180为(5.152±0.853) %ID/g,90 min时仍有明显蓄积。心脏、肾脏内放射性清除较快,其余脏器摄取值均不高,脑组织最低,且随时间推移无明显变化,与生物分布结果一致。
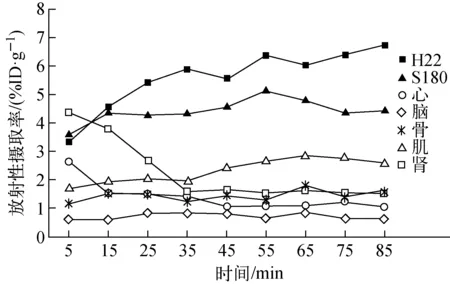
图5 18F-FEDOPA在肿瘤及脏器中的时间-放射性摄取率曲线Fig.5 Time activity curves of 18F-FEDOPA in tumors and organs
荷瘤小鼠分别注射18F-FEDOPA和18F-FDG 60 min时的PET/CT融合图像示于图6。由图6结果可见,肿瘤组织清晰显影,与18F-FDG相比,18F-FEDOPA的本底整体明显较低(以脑和心脏部位为著),肿瘤显影更加清晰。18F-FEDOPA和18F-FDG在注射60 min时动物肿瘤与非肿瘤组织的放射性摄取比(T/NT)结果示于图7,18F-FEDOPA的肿瘤与心、脑的比值较18F-FDG高(H22/脑:7.73±2.10>2.14±0.71,S180/脑:4.62±1.52>2.14±0.71;H22/心:4.33±1.22>1.89±0.25,S180/心:2.59±0.30>1.56±0.30,P<0.05),肿瘤与肌肉比值无明显差异。18F-FEDOPA作为一种多巴衍生物仍属小分子氨基酸化合物,能够通过血脑屏障。然而正常脑组织获取能量最主要的物质是葡萄糖[10],与18F-FDG相比,多种氨基酸类显像剂在脑组织中的摄取较低,在脑肿瘤显像方面更具优势[11-12]。鉴于本研究中18F-FEDOPA较低的脑摄取和较高的肿瘤与脑的比值,18F-FEDOPA在脑肿瘤显像方面可能有潜在的应用价值。
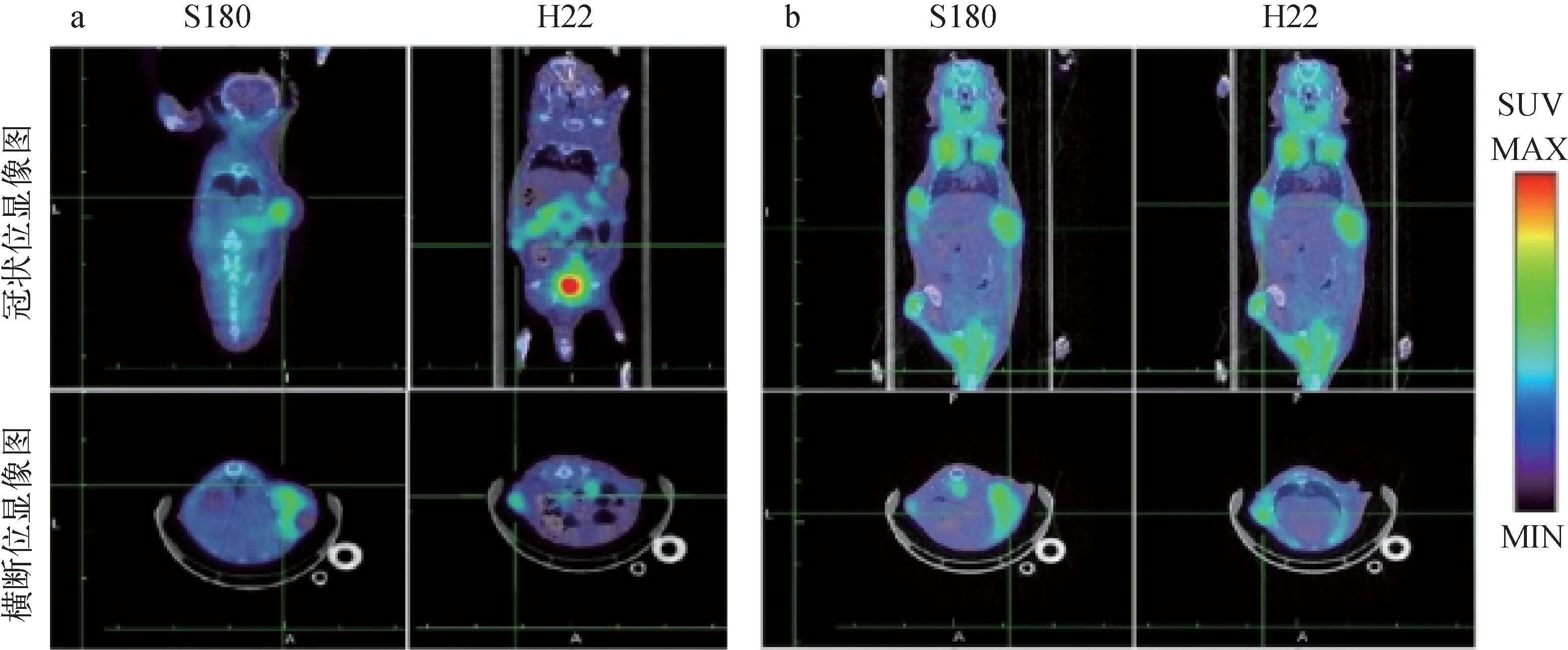
a——注射18F-FEDOPA 60 min时S180(左)和H22(右)的PET/CT融合图像b——注射18F-FDG 60 min时S180(左)和H22(右)的PET/CT融合图像图6 荷瘤小鼠microPET/CT显像a——PET/CT imaging of S180 (left) and H22 (right) at 60 min post-injection of 18F-FEDOPA b——PET/CT imaging of S180 (left) and H22 (right) at 60 min post-injection of 18F-FDGFig.6 microPET/CT imaging of S180-H22 tumor-bearing mice
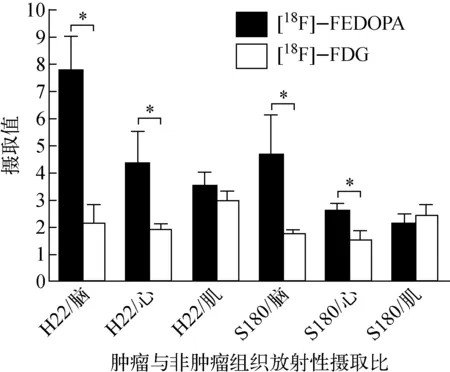
图7 注射18F-FEDOPA和18F-FDG 60 min时的肿瘤与非肿瘤组织放射性摄取比(T/NT)Fig.7 The tumor to normal tissue ratio (T/NT) at 60min post-injection of 18F-FEDOPA and 18F-FDG
与18F-FDOPA在黑色素瘤小鼠模型体内的分布结果相比[13],模型小鼠注射18F-FEDOPA 60 min后的正常组织整体摄取值高于18F-FDOPA,但肿瘤与心、脑的T/NT都较高,提示18F-FEDOPA具备18F-FDOPA类似的诊断效能。相比于18F-FET在结肠癌小鼠的分布结果[14]:模型小鼠注射18F-FEDOPA 60 min后的生物分布特点与18F-FET相似,大部分脏器的摄取值均偏低,以心脏和脑为著,提示18F-FEDOPA整体本底更低,更有助于肿瘤显示。综合分析,与18F-FDOPA和18F-FET相似,作为氨基酸的一种衍生物,18F-FEDOPA有良好药代动力学特征,且在肿瘤PET显像方面具有很大潜能。
4 结论
本研究使用新型前体化合物N-叔丁氧羰基-(3-O-甲苯磺酸酯乙基-4-O-叔丁氧羰基)-L-多巴甲酯,经两步法成功标记合成了3-O-(2-18F-氟乙基)-L-多巴(18F-FEDOPA),其结构与18F-FDOPA和18F-FET类似,合成过程简单,放化产率高,稳定性良好。通过健康小鼠体内生物分布实验及S180纤维肉瘤和H22肝癌模型小鼠的PET/CT显像发现,18F-FEDOPA主要通过肾脏排泄,在两种类型肿瘤组织中均有较高的摄取,而在心脏和脑组织的摄取较低。18F-FEDOPA有望成为一种新型的氨基酸代谢类肿瘤PET显像剂,但其细胞摄取机制及代谢特征需要进一步研究。

