HNF1B基因多态性与冠心病、2型糖尿病及其共病的相关性研究
李艳蓉 章登峰 杨帆 孙亮 杨泽 刘德平
100730 中国医学科学院 北京协和医学院研究生院(李艳蓉、章登峰、刘德平);100730 北京医院心内科 国家老年医学中心(李艳蓉、章登峰、刘德平);100730 卫生部老年医学研究所遗传室 国家老年医学中心(杨帆、孙亮、杨泽)
《中国心血管病报告2017》指出,中国心血管病患病率及死亡率仍处于持续上升阶段,死亡率居各病因之首[1]。心血管病尤其是冠心病随着年龄的增长患病率逐渐增加,且常常合并2型糖尿病,近期中国心脏调查发现,52.9%的冠心病住院患者合并2型糖尿病[2]。另一方面,2型糖尿病并发的冠心病发病早、进展快、病情重[3]。越来越多的研究证实,冠心病与2型糖尿病之间可能存在共同的发病基础——“共同土壤”,即基因和代谢水平的共同发病基础[4]。
目前,很多研究发现HNF1B基因多态性与2型糖尿病显著相关[5-7]。但有关冠心病合并2型糖尿病共病患者的HNF1B基因多态性,以及该基因多态性是否通过影响代谢水平导致疾病风险增加仍然不清。因此,本研究采用病例对照设计和单病例设计,对HNF1B基因rs4430796在冠心病、2型糖尿病、冠心病合并2型糖尿病患者的分布及与代谢指标进行比较,以为冠心病合并2型糖尿病患者提供早期筛查遗传标记物。
1 对象和方法
1.1 研究对象
选择2016年2~12月于北京医院心内科和内分泌科就诊的冠心病患者160例、2型糖尿病患者126例,冠心病合并2型糖尿病患者175例。冠心病的诊断均经冠状动脉造影检查证实,至少一只冠状动脉狭窄≥50%。2型糖尿病的诊断符合1999年世界卫生组织2型糖尿病诊断标准。另选择同期在北京医院的健康体检者238名作为对照组,均无冠心病、2型糖尿病、高血压、严重肝肾病变和恶性肿瘤等病史。本研究经过北京医院伦理委员会批准。
1.2 研究方法
按检测标准测取所有研究对象的身高、体重,计算体质指数(body mass index,BMI),并测量收缩压和舒张压。所有研究对象均隔夜空腹12 h以上,次日清晨空腹抽取静脉血和抗凝血各5 ml,分离血清,于北京医院检验科用全自动生化仪检测空腹血尿酸、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)和空腹血糖(fasting plasma glucose,FPG)。
常规酚一氯仿法提取基因组DNA,-20℃保存备用。应用高分辨率熔解曲线分析(high resolution melting,HRM)方法进行HNF1B基因rs4430796突变鉴定并用Sanger测序方法进行验证(北京天一辉远基因科技有限公司)。
1.3 统计学方法
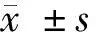
2 结果
2.1 一般临床资料比较
入选冠心病患者160例,其中男性113例,女性47例,平均年龄(65.0±7.4)岁;2型糖尿病患者126例,其中男性76例,女性50例,平均年龄(66.0±12.6)岁;冠心病合并2型糖尿病175例,其中男性98例,女性77例,平均年龄(66.7±9.6)岁;健康对照者238名,其中男性160名,女性78名,平均年龄(65.4±6.3)岁。4组受检者一般临床指标比较见表1,其中性别比例、收缩压、TC、LDL-C差异有统计学意义(均为P<0.05),其他指标在4组间差异无统计学意义。
2.2 HNF1B基因rs4430796在4组人群的分布和相关性分析
HNF1B基因rs4430796主要等位基因为 A,次要等位基因为G。各基因型在健康对照组分布符合Hardy-Weinberg平衡。与健康对照组比较,冠心病组和2型糖尿病组rs4430796位点的基因型、等位基因、显性模型、隐性模型、超显性模型和加性模型频率差异均无统计学意义(均为P>0.05,表2)。与健康对照组比较,冠心病合并2型糖尿病组rs4430796位点的基因型、等位基因、显性模型、隐性模型和加性模型频率差异有统计学意义(均为P<0.05,表2),分别为等位基因(OR=1.50,95%CI:1.05~2.13,P=0.026)、显性模型(OR=1.83,95%CI:1.23~2.72,P=0.003)、隐性模型(OR=2.07,95%CI:1.07~3.98,P=0.027)和加性模型(OR=2.53,95%CI:1.29~4.98,P=0.006)。

表1 4组受检者的一般临床资料比较
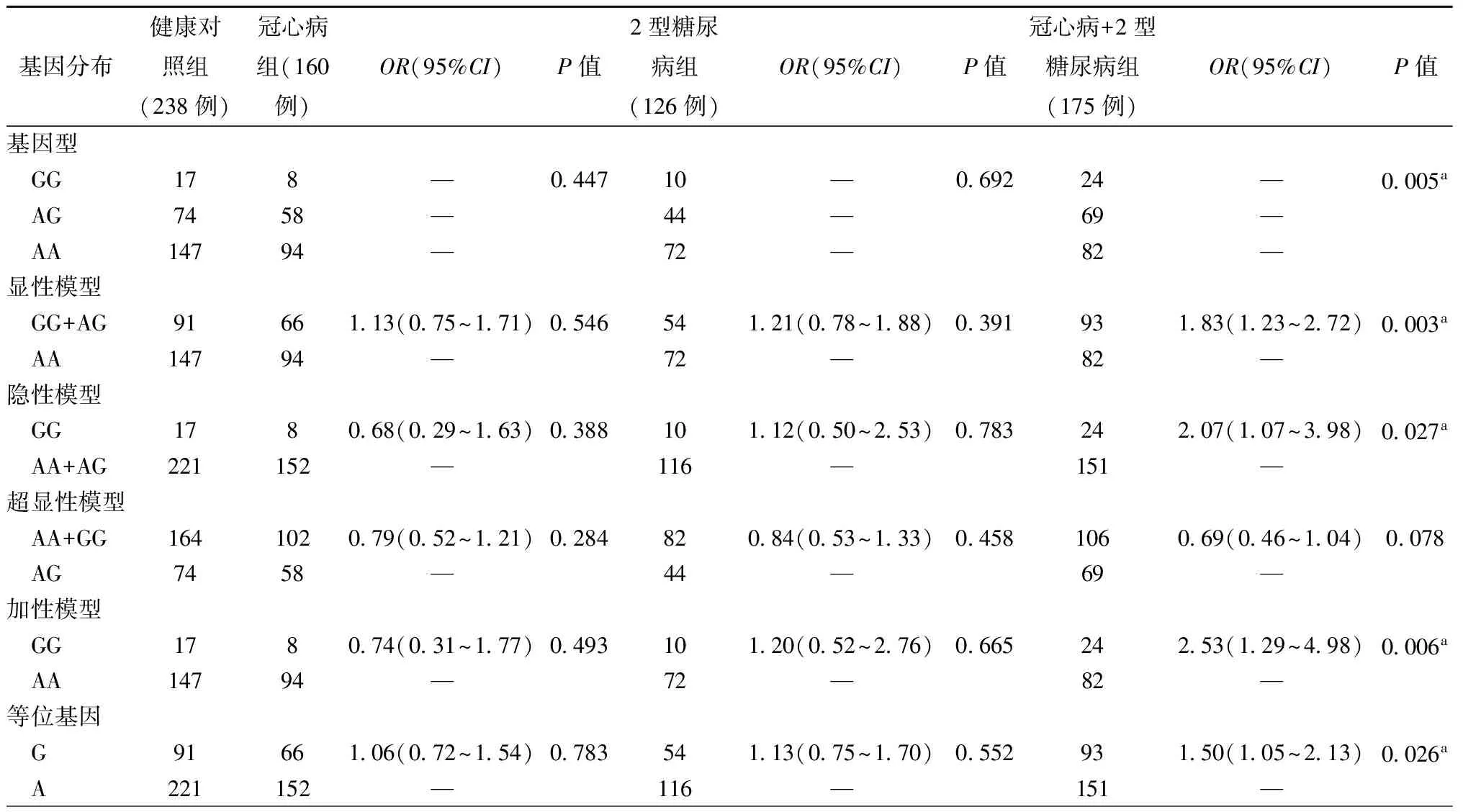
表2 HNF1B基因rs4430796在4组人群的分布和相关性分析
注:与健康对照组比较,aP<0.05
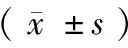
表3 4组内HNF1B基因rs4430796多态性与生物标志物的相关性分析
注:与野生型(AA)比较,aP<0.05
2.3 HNF1B基因rs4430796多态性与生物标志物的相关性分析
进一步分析HNF1B基因rs4430796多态性与BMI、收缩压、舒张压、尿酸 、TC、TG、LDL-C和HDL-C和FPG之间的关系,发现冠心病组患者携带G突变位点(GG+AG)人群的BMI水平较野生型(AA)人群减低,2型糖尿病组患者携带G突变位点(GG+AG)人群的尿酸水平较野生型(AA)人群增高,而冠心病+2型糖尿病组患者携带G突变位点(GG+AG)人群的HDL-C水平较野生型(AA)人群减低,其他代谢指标差异无统计学意义(均为P>0.05,表3)。
3 讨论
本研究显示,HNF1B基因位点rs4430796多态性与冠心病合并2型糖尿病相关,携带等位基因G的人群更易发生冠心病合并2型糖尿病;且与野生型(AA)相比,冠心病组携带G突变位点(GG+AG)的患者BMI减低,2型糖尿病组携带G突变位点(GG+AG)的患者尿酸增高,冠心病合并2型糖尿组携带G突变位点(GG+AG)的患者HDL-C减低(均为P<0.05)。揭示HNF1B基因位点rs4430796多态性与冠心病合并2型糖尿病相关。
冠心病、2型糖尿病均是由遗传和环境因素相互作用导致的复杂疾病,其共同的病理生理机制包括血脂异常、胰岛素抵抗、炎症、氧化应激、高凝状态、高血压、肥胖等[4]。推测可能存在共同的遗传变异导致上述机制和代谢表型的异常从而促进冠心病合并2型糖尿病的发生。
肝细胞核因子1β(hepatocyte nuclear factor 1β,HNF-1β),又称转录因子2 (transcription factor 2,TCF2),是一种核蛋白。人HNF1B基因定位于染色体17q21.3,由9个外显子组成,全长约23.8kb。其主要表达于胰腺、肝脏、肾脏[8]。该基因突变最早报道于年轻的成年发病型糖尿病(maturity-onset diabetes of the young,MODY5)单基因疾病的发生[9]。后被发现与T2DM显著相关[5-7],同时也与一些如肾发育缺陷、肝功能异常、胰腺萎缩、生殖道畸形和前列腺癌等癌症相关[10-12]。通过sh-RNA方法抑制肝脏hnf1b功能导致葡萄糖耐量异常、胰岛素信号转导受损和肝糖原异生[13],而db/db小鼠肝脏过表达hnf1b会增强胰岛素敏感性[14],证实了HNF1B基因异常导致的hnf1b功能改变与T2DM相关。
Gudmundsson等[15]对1 380例2型糖尿病患者和9 940名对照人群研究发现,HNF1B基因rs4430796多态性与2型糖尿病相关,并在来自欧洲、非洲和亚洲的7个病例对照研究中进一步证实HNF1B基因rs4430796多态性与2型糖尿病的相关性。Wang等[16]通过病例对照研究发现,HNF1B基因rs4430796位点与中国人群2型糖尿病相关。本研究发现,HNF1B基因位点rs4430796多态性与冠心病合并2型糖尿病相关,但与2型糖尿病无关,考虑可能与本研究中2型糖尿病样本量较小有关。本研究发现冠心病组携带HNF1B基因rs4430796G突变位点(GG+AG)的患者BMI较低。这与既往研究不一致,GWAS相关研究也未发现HNF1B基因rs4430796与BMI相关[17]。未来可扩大样本量并行相关机制研究明确HNF1B基因rs4430796与BMI的相关性。目前尚无关于HNF1B基因位点rs4430796与尿酸、HDL-C代谢的研究。本研究首次发现,2型糖尿病患者尿酸较高、冠心病合并2型糖尿病患者HDL-C较低,提示该基因突变位点可能通过影响代谢因素参与2型糖尿病、冠心病合并2型糖尿病的发生。
HNF1B基因rs4430796位于HNF1B内含子区域,并不是基因编码区及基因调控区。目前的关联研究结果仅提示该位点是与冠心病合并2型糖尿病患病风险相关的位点。是否存在其他与rs4430796呈高度连锁不平衡的位点直接导致该共病的发生,即真正的致病位点有待于进一步的研究发现。检测HNF1B基因区域更多的SNP位点及功能,将更有助于阐明HNF1B基因变异在冠心病合并2型糖尿病中的作用。
总之,本研究发现,HNF1B基因位点rs4430796多态性与冠心病合并2型糖尿病相关,携带等位基因G的人群更易发生冠心病合并2型糖尿病,同时携带等位基因G的人群可能通过代谢因素影响冠心病及共病的发生。本研究样本量偏小,需要进一步增加样本量及检测HNF1B基因区域更多的SNP位点。对于冠心病合并2型糖尿病的患者,早期发现遗传标记物进行高危人群筛查具有重要的临床意义。
利益冲突:无