风湿性心脏病合并重度肺动脉高压的外科治疗
向水 黄进启 黄宏灵 蔡彦力 郑勇 李旭 姚元波
445000 恩施土家族苗族自治州中心医院心胸外科
风湿性心脏病(rheumatic heart disease, RHD)是发展中国家的主要心脏瓣膜疾病。在偏远落后的山区,RHD是心内直视手术的主要病种。由于经济原因,部分RHD患者选择手术时已合并重度肺动脉高压(pulmonary artery hypertension,PAH)。虽然合并重度PAH不是瓣膜置换手术的禁忌证,但明显增加围术期死亡率。既往报道此类患者的围术期死亡率高达15%~31%[1]。近年来随着外科技术的提高和围术期治疗方法的改进,合并重度PAH的RHD患者的预后明显改善,大部分患者预后良好[2-3]。本研究回顾性分析2010年1月至2016年12月在恩施土家族苗族自治州中心医院心胸外科RHD合并重度PAH行手术治疗患者的临床资料和短期预后,探讨围术期死亡的危险因素。
1 对象和方法
1.1 研究对象
本研究为回顾性研究。2010年1月至2016年12月875例RHD患者在恩施土家族苗族自治州中心医院心胸外科行手术治疗,其中74例(8.5%)合并重度PAH的患者入选本研究。74例患者中,男性32例(43.2%),女性42例(56.8%)。年龄26~72岁,平均(48.6±16.4)岁,老年患者22例(≥60岁,29.7%),病程22.3±9.6年(16~35年),病变类型见表1。心电图提示心房颤动54例(73.0%),不完全性右束支传导阻滞5例(6.8%),室性期前收缩2例(2.7%)。术前纽约心脏病协会(NYHA)心功能分级见表2。入选标准:(1)存在二尖瓣狭窄;(2)超声心动图估测平均肺动脉压(mean pulmonary artery pressure, MPAP)≥50 mmHg;(3)无重要脏器严重功能障碍。本研究符合医学伦理学要求,获得本单位伦理委员会批准。
1.2 研究方法
术前常规行右心导管检查,给予抗心力衰竭治疗改善心功能、静脉泵入前列腺素E1(5 μg/h)及口服枸橼酸西地那非(25 mg,3次/d)降低肺动脉压力。手术在全麻低温体外循环下完成。桡动脉穿刺监测动脉压力。麻醉诱导气管插管后经右颈内静脉置入Swan-Ganz漂浮导管,测定并计算出MPAP、肺毛细血管楔压(pulmonary capillary wedge pressure, PCWP)、肺血管阻力(pulmonary vessel resistance, PVR)及心脏指数(cardiac index, CI)。
胸骨正中开胸,常规建立体外循环,浅低温(28~30℃)下阻断主动脉,右上肺静脉插管左心引流。1例(1.4%)在并行循环下缝闭动脉导管。经主动脉根部或左右冠状动脉开口灌注4∶1冷血心脏停搏液,心表冰敷。连续或间断缝合植入相应型号Sorin人工机械瓣,切除二尖瓣时尽量保留后瓣叶及瓣下结构,如左房横径>60 mm则连续缝合行瓣环旁和左房顶折叠左房。清除左房血栓,心房颤动患者结扎左心耳。同时修补房间隔缺损和大隐静脉冠状动脉旁路移植术。开放主动脉后在并行循环下植入Sorin三尖瓣成形环缩三尖瓣环。体外循环平均时间62.5±25.8 min,主动脉阻断时间43.7±17.2 min。持续静脉泵入多巴胺、多巴酚丁胺、硝普钠、前列地尔及米力农(0.5 μg/kg-1·min-1)等血管活性药物,根据血流动力学状态调整用量。快速心房颤动者(心室率>100次/min)用胺碘酮30 mg/h持续24 h以上。停机时刻及术后24 h再次记录上述血流动力学指标,术后两次取平均值与术前比较。术后应用右美托咪定和芬太尼充分镇静,病情严重时加用肌松剂,持续机械通气,适当过度通气(二氧化碳分压维持在28~35 mmHg)。术后第一天开始口服或鼻饲西地那非,持续半年。术后血流动力学稳定、完全清醒及动脉血气结果正常后拔出气管插管。术后1周不能撤离呼吸机者行气管切开,出现低心排综合征的患者经股动脉植入主动脉球囊反搏(IABP),出现肾功能衰竭行连续性肾脏替代治疗(CRRT)。

表1 RHD合并重度PAH患者的病变类型和手术方式[例(%)]

表2 患者手术前、术后血流动力学情况
注:MPAP:平均肺动脉压;PCWP:肺毛细血管楔压;PVR:肺血管阻力;CI:心脏指数;LAD:左房内径;LVEDD:左室舒张末内径;LVEF:左室射血分数
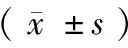
表3 高肺动脉压患者手术前、后血流动力学情况
1.3 随访
术后常规给予抗心力衰竭治疗6个月以上,终身华法林抗凝,INR维持在2.0~3.0。患者均在门诊随访,采用6 min步行试验评价患者的心功能,术后3个月和6个月复查超声心动图检测患者肺动脉压力、左房内径、左室舒张末内径及左室射血分数。
1.4 统计学方法
2 结果
2.1 术前和术中的血流动力学情况
患者术前右心导管检查结果为MPAP 78.3±10.2 mmHg,PCWP 38.4±7.2 mmHg,PVR 903.7±118.4 dyne·s·cm-5,CI 1.7±0.2 L·mim·cm2。经降肺动脉压治疗后,结果与术中Swan-Ganz漂浮导管监测的结果比较,MPAP、PCWP、PVR有降低,CI有升高,但差异无统计学意义(均P>0.05)。
2.2 手术和术后情况
本组患者手术方式见表1。围术期死亡6例(8.1%),其中高肺动脉压力(>体循环压)患者4例。死亡原因4例(5.4%)为严重低心排综合征,1例(1.4%)为PAH危象,1例(1.4%)为多器官功能衰竭。术后发生低心排综合征13例(17.6%),经用IABP治愈8例(10.8%)。发生呼吸功能不全12例(16.2%),延长机械通气时间和(或)气管切开,死亡1例(1.4%)。发生急性肾功能衰竭6例(8.1%),经CRRT治愈5例(6.7%)。Swan-Ganz漂浮导管监测术后MPAP、PVR和PCWP较术前明显下降,CI明显上升。复查超声心动图左房内径明显缩小,左室舒张末内径有缩小,但差异均无统计学意义(均为P>0.05),左室射血分数增加(P<0.05),随访期间心功能明显改善,见表2。
2.3 亚组分析
亚组分析发现,18例(24.3%)患者的肺动脉压超过体循环平均动脉压(mean artery pressure, MAP),其术后早期MPAP、PVR和PCWP无明显下降,CI无明显增加,手术死亡率明显增加(22.2%比3.6%,P<0.001)。但术后半年肺动脉压力逐渐下降,见表3,心功能有明显改善。
2.3 随访情况
存活68例患者(91.8%)均在门诊随访,随访中位时间67.5个月(8~82个月),随访中三尖瓣轻度关闭不全4例(5.4%),中度关闭不全2例(2.7%),重度关闭不全1例(1.4%)。1例(1.4%)死于脑出血,1例(1.4%)死于恶性肿瘤,1例(1.4%)死于严重右心功能衰竭。
3 讨论
在新的PAH分类中[4],RHD合并PAH划归为第二类,为左心瓣膜疾病引起的被动性、毛细血管后PAH。主要发病机制是左房压升高,导致肺静脉压升高、肺淤血和缺氧,压力逆向传导引起肺小动脉压力升高和反射性痉挛,最终导致肺小动脉中层和内膜增厚,阻力增加[5]。PAH是RHD的常见并发症,MPAP≥50 mmHg即为重度PAH。
外科手术置换了病变的二尖瓣和主动脉瓣,解除左房血流的前向梗阻,降低左心的容量负荷和压力负荷,使扩大的左房和左室缩小,增加左室射血分数,改善心功能。本研究表明,Swan-Ganz漂浮导管监测术后MPAP、PVR和PCWP较术前明显下降,CI明显上升。复查超声心动图左房内径明显缩小,左室射血分数增加,术后心功能明显改善。左室舒张末内径有缩小,但差异无统计学意义(P>0.05),可能与本研究中二尖瓣重度狭窄病例较多,部分病例术前左室由于得不到充分血液充盈,无明显增大甚至缩小有关。
重度PAH增加RHD的围术期死亡率。早年报道手术死亡率高达15%~31%[1]。Merwe等[6]研究表明,PAH的程度与手术死亡率呈正相关。但近年来随着心肌保护、外科技术及术后监护水平的提高,手术死亡率明显下降(2.3%~10%)[2-3],本研究总死亡率为8.1%,且有较好的近中期效果,术后大部分患者心功能恢复至Ⅰ级和Ⅱ级(75%)。因此,(1)加强术前抗心力衰竭和降肺动脉压力治疗,增加心脏储备功能;(2)尽量缩短阻断时间;(3)尽可能保留二尖瓣后瓣叶及瓣下结构;(4)左房折叠;(5)积极的三尖瓣成形[7];(6)控制房颤心室率;(7)充分镇静,适当过度通气;(8)术后常规用药降低肺动脉压力;(9)延长机械通气时间,必要时切管切开。
亚组分析发现,18例MPAP>MAP者术后早期MPAP、PVR和PCWP无明显下降,CI无明显增加,手术死亡率明显增加(22.2%比3.6%,P<0.001)。这组病例中老年患者(≥60岁)较多,可能与病史时间长,肺血管病变重且阻力性成分较多,即使手术解除了肺静脉的前向梗阻,但肺动脉压力和阻力在术后早期不会明显下降。术后肺动脉压力和阻力过高易发生PAH危象,可使左心容量负荷不足,导致低心排综合征发生,且应用IABP效果不佳,最终可发展成多器官功能衰竭而增加手术死亡率。但度过围术期,手术半年后肺动脉压力逐渐下降,心功能有明显改善,可获得满意的近中期效果。Mubeen[8]等研究发现,重度PAH患者其肺血管病变超过Heath-Edwards分类Ⅲ级就不会再进展,提示在左心瓣膜疾病合并重度PAH中,肺血管病变仍有一部分动力性成分存在,术后有可能逆转,肺动脉压力下降。
由于医疗资源的限制,本研究病例未用一氧化氮吸入降低PAH。本组病例数较少,随访时间较短,还需在今后研究中进一步总结证实。总之,合并重度PAH的RHD患者,手术仍是主要治疗方法。充分的术前准备、正确的手术方法及术后的精心监护治疗可降低手术死亡率,改善心功能,获得满意的近中期效果。
利益冲突:无