射血分数保留的心力衰竭合并2型糖尿病患者的临床特征分析
刘长清 樊光辉
430065 武汉,湖北中医药大学第一临床学院(刘长清);430070 中国人民解放军武汉总医院心血管内科(樊光辉)
心力衰竭是心脏结构和(或)功能障碍导致心室充盈和(或)射血功能减退,以肺循环、体循环淤血,组织、器官血液灌注不足为临床表现的综合征。2016年欧洲心脏病协会心力衰竭指南根据左心室射血分数(left ventricular ejection fraction,LVEF)将心力衰竭分为射血分数降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF,LVEF<40%)、射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF,LVEF≥50%)和射血分数中间范围的心力衰竭(heart failure with midrange ejection fraction,HFmrEF,LVEF 40%~49%)[1]。有研究指出,HFpEF占所有心力衰竭的50%,其中45%的患者合并糖尿病[2]。目前,国外针对HFpEF合并和未合并糖尿病患者的临床特征做了大规模的调查,其中一项研究发现,与未合并糖尿病相比,HFpEF合并糖尿病的患者在多变量调整后因心力衰竭恶化住院率及死亡率同比增加了2倍,全因死亡率增加了80%[3]。然而我国尚无相关报道,因此,本研究收集整理HFpEF患者的临床信息,对比分析HFpEF合并和未合并2型糖尿病患者的临床特征。
1 对象和方法
1.1 研究对象
本研究为回顾性研究。入选2016年1~12月在中国人民解放军武汉总医院心血管内科住院的HFpEF患者69例。纳入标准:(1)有典型的心力衰竭症状,包括不同程度的呼吸困难、乏力、疲倦、运动耐量减低等;(2)有典型的心力衰竭体征,包括肺部湿啰音、下肢水肿、颈静脉怒张、心脏体征等;(3)LVEF≥50%;(4)①利钠肽水平升高[N末端B型利钠肽原(NT-proBNP)≥125 pg/ml、B型利钠肽(BNP)≥35 pg/ml];②至少符合下列1条标准:a.相关结构性心脏病:左心室肥厚和(或)左心房扩大;b.舒张功能不全(E/e’≥13或平均e’<9 cm/s)[1]。排除标准:(1)LVEF<50%;(2)左心室扩大;(3)合并瓣膜性心脏病、先天性心脏病、心包疾病、急性冠状动脉综合征。
1.2 研究方法
根据是否合并糖尿病将患者分为HFpEF合并糖尿病组和HFpEF未合并糖尿病组。糖尿病诊断标准为:空腹血糖≥7.0 mmol/L或糖耐量试验2 h血糖≥11.1 mmol/L或糖尿病症状(多尿、烦渴多饮和难以解释的体重减轻)加随机血糖≥11.1 mmol/L。记录所有患者的年龄、性别、体质指数(body mass index,BMI)、纽约心脏病协会(New York Heart Association,NYHA)心功能分级等一般情况;双下肢水肿、颈静脉怒张、肺部湿啰音等体征;24 h平均心率、平均收缩压和舒张压、左心房大小、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end-systolic volume,LVESV)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)、LVEF、每搏输出量(stroke volume,SV)等相关指标;NT-proBNP、血红蛋白(hemoglobin,Hb)、血清肌酐、谷丙转氨酶、血糖、血脂、糖化血红蛋白等实验室检查;高血压、心房颤动、陈旧性心肌梗死等合并症情况;临床用药情况;1年内因心力衰竭恶化住院次数及死亡例数。
1.3 统计学方法
2 结果
2.1 一般情况
本研究入选的69例HFpEF患者中,29例(42.0%)有2型糖尿病病史,其中15例为女性,14例为男性,平均年龄(75.8±10.7)岁,NYHA心功能分级3.8±0.4;40例(58.0%)无2型糖尿病,其中19例为女性,21例为男性,平均年龄(75.3±10.3)岁,NYHA心功能分级3.6±0.5,两组在性别、年龄和NYHA心功能分级方面差异无统计学意义(均为P>0.05)。HFpEF合并糖尿病的患者BMI(t=2.6,P=0.01)和收缩压(t=2.3,P=0.045)更高,合并高血压(χ2=6.43,P=0.01)及陈旧性心肌梗死(χ2=7.5,P=0.006)的比例更高,但在外周水肿、肺部啰音、颈静脉怒张等体征方面无显著差异。此外,两组24 h平均心率、舒张压、合并心房颤动比例亦无显著差异,见表1。
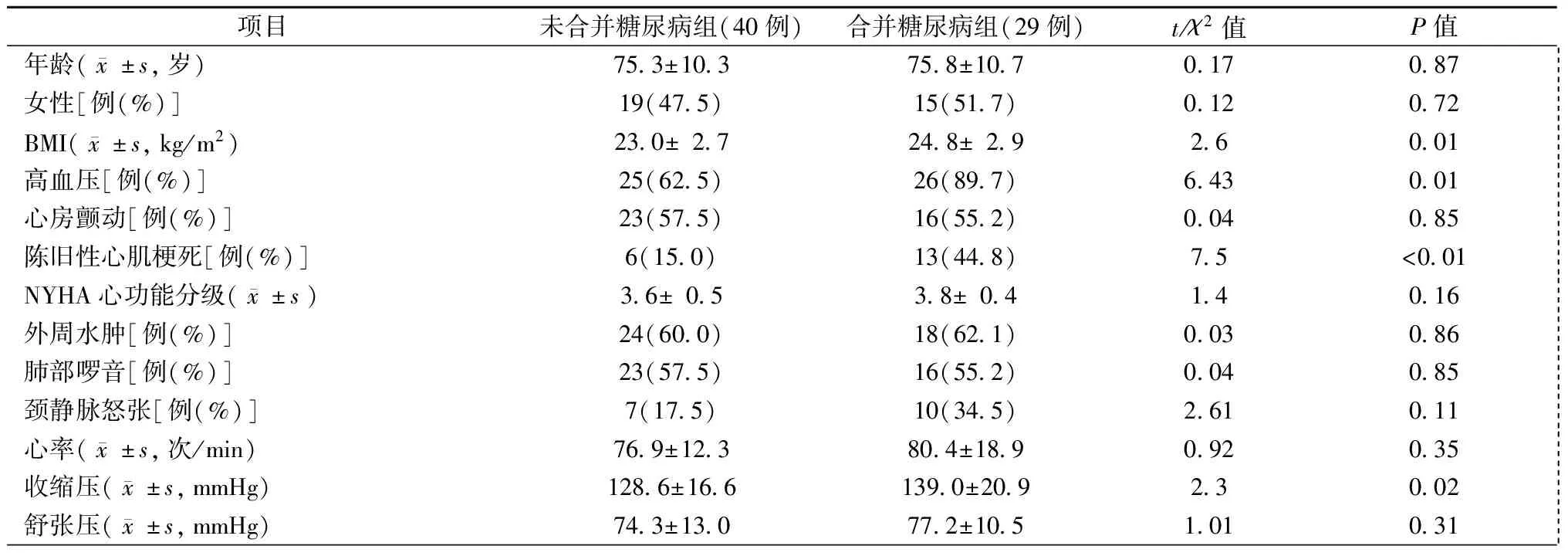
表1 HFpEF合并和未合并糖尿病患者的一般情况比较
注:BMI:体质指数;NYHA:纽约心脏病学会
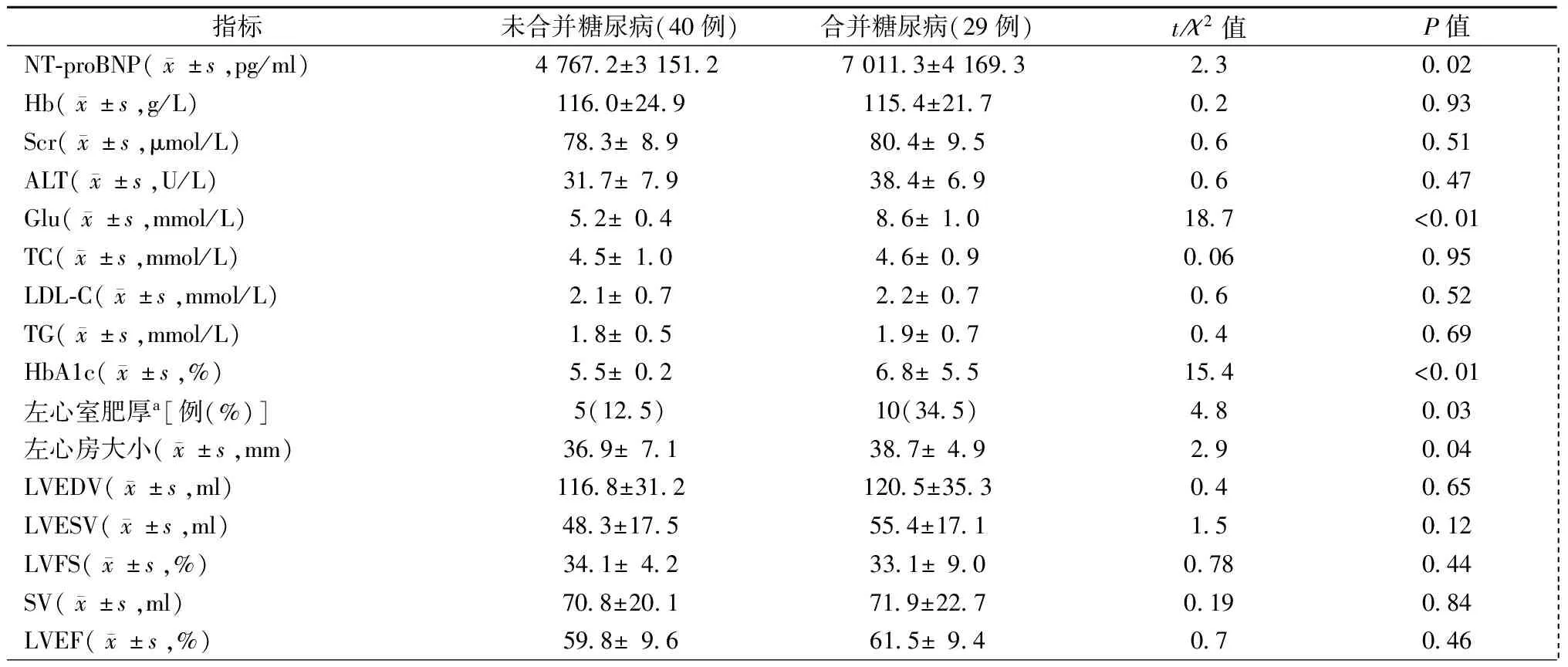
表2 HFpEF合并和未合并糖尿病患者的实验室检查和超声心动图指标比较
注:NT-proBNP:N末端B型利钠肽原;Hb:血红蛋白;Scr:血清肌酐;ALT:谷丙转氨酶;Glu:血糖(空腹);TC:总胆固醇;LDL-C:低密度胆固醇胆固醇;TG:三酰甘油;HbA1c:糖化血红蛋白;LVEDV:左心室舒张末期容积;LVESV:左心室收缩末期容积;LVFS:左心室短轴缩短率;SV:每搏输出量;LVEF:左心室射血分数;a我国超声心动图推荐诊断左心室肥厚的标准为:左心室重量指数(LVMI)男性>125 g/m2;女性>120 g/m2
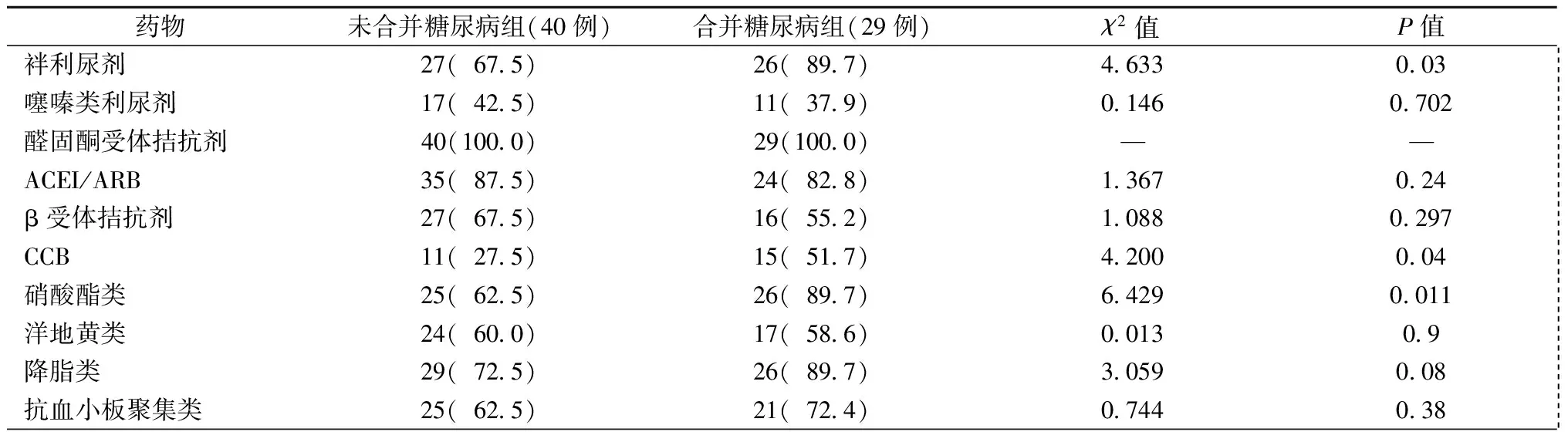
表3 HFpEF合并和未合并糖尿病患者的临床用药情况[例(%)]
注:ACEI:血管紧张素转换酶抑制剂;ARB:血管紧张素Ⅱ受体拮抗剂;CCB:钙离子通道拮抗剂
2.2 实验室检查和超声心动图指标
与HFpEF未合并糖尿病患者相比,合并糖尿病的患者左心室肥厚比例更高(χ2=4.8,P=0.03),NT-proBNP水平更高(t=2.3,P=0.02),左心房更大(t=2.9,P=0.04),但两组患者的LVEDV、LVESV、LVFS、LVEF、SV和Hb、Scr、ACT、TC、LDL-C、TG差异均无统计学意义(均为P>0.05),见表2。
2.3 临床用药情况
与HFpEF未合并糖尿病患者相比,合并糖尿病的患者袢利尿剂(χ2=4.633,P=0.03)、钙离子通道拮抗剂(CCB)(χ2=4.200,P=0.04)、硝酸酯类药物(χ2=6.429,P=0.011)使用比例更高;而血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂(ACEI/ARB)、β受体阻滞剂、洋地黄类、降脂类及抗血小板类药物的临床应用无显著差异,见表3。
2.4 1年内心力衰竭恶化住院和死亡情况
与HFpEF未合并糖尿病患者相比,合并糖尿病的患者1年内因心力衰竭恶化住院次数(1.3±0.89 比 0.45±0.9,t=3.9,P<0.01)和死亡比例(10.3% 比 0,χ2=4.33,P=0.04)均更高。
3 讨论
本研究中,合并2型糖尿病的患者占所有HFpEF患者的42.0%,与之前提及的45%相接近。研究显示,HFpEF合并和未合并糖尿病的患者在性别、年龄和LVEF上无显著差异,这与CHARM(the Candesartan in Heart failure:Assessment of Reduction in Mortality and morbidity)研究结果相反,CHARM研究显示HFpEF合并糖尿病患者更易发生在年轻女性中,且LVEF更低;不过,我们的结果与Kristensen等[4]近期发表在《Circulation》杂志上的结果一致,其中BMI、合并高血压和陈旧性心肌梗死比例均有明显差异。Brian等[5]研究显示,合并糖尿病的HFpEF患者更易发生在年轻肥胖男性患者中,更容易伴随高血压、肾功能不全、肺部疾病及脑血管疾病;此外,血清尿酸水平、C反应蛋白、半乳凝素3、Ⅰ型胶原羧基末端肽和内皮素1水平均高于未合并糖尿病的患者,然而在本次研究中,两组患者血脂、血肌酐、谷丙转氨酶无明显差异,考虑与降脂药物的运用、高血压及血糖等危险因素控制尚可相关;而心室肥大比例、心力衰竭住院率更高,运动耐量(6 min步行距离)更低。因此,他们推测当合并糖尿病时心脏变时性功能减退、心脏储备功能下降、左心室肥大、炎症因子激活、氧化应激、血管收缩和促纤维化等途径可能是导致HFpEF合并糖尿病患者临床结局差的原因。
LVFS和LVEF反映心脏收缩功能,在本研究中两组比较差异无统计学意义,因此我们认为合并和未合并糖尿病的HFpEF患者心脏收缩功能相似,但不排除本次样本量较小导致上述情况出现;研究还显示,两组左心房大小和左心室肥厚比例差异有统计学意义,而这两者反映心脏结构是否存在异常,因此,合并糖尿病的HFpEF患者更易发生心脏结构改变。HFrEF患者一般存在左心室扩大、偏心性重构和收缩功能障碍,与HFrEF不同的是,Michael等[6]研究显示大多数HFpEF患者表现为左心室向心性重构、心室肥厚、左心房扩大和舒张功能障碍,其中,舒张功能障碍比例高达70%,考虑这些结构和功能的变化与心力衰竭发病率和死亡率相关,并认为逆转左心室结构异常和改善心室舒张功能可作为降低HFpEF患者发病率和死亡率的治疗靶点。
基于HFpEF合并糖尿病的患者较未合并者心室舒张功能差,且易合并高血压等特点,本研究中CCB类降压药在合并糖尿病组使用更多;硝酸酯类药物通过释放一氧化氮激活鸟苷酸环化酶,继而平滑肌细胞内环鸟苷酸增多,使血管平滑肌松弛、外周动脉及静脉扩张,且对静脉扩张作用更强,故可以减轻左心室负荷[7],在合并糖尿病组中运用更多。
已有研究表明,糖尿病为HFrEF患者发生不良事件的独立危险因素,而是否为HFpEF患者的独立危险因素尚不得知。虽然在本研究中,合并糖尿病的患者外周水肿、颈静脉怒张、肺部淤血表现与未合并糖尿病患者无异,但糖尿病的存在使HFpEF患者因心力衰竭恶化住院次数及死亡率明显增加。Samson等[8]研究数据显示,糖尿病加速了从临床前舒张功能障碍到HFpEF的进展,并且死亡率和发病率增加近2倍。Aguilar等[9]指出,糖尿病伴有HFpEF患者的死亡率和住院率增加了70%~80%,二次分析表明LVEF>45%的糖尿病患者因心力衰竭死亡或住院治疗的风险比为1.68。针对其机制,有研究指出糖尿病使HFpEF患者的心室-动脉耦联障碍和血管硬度增加,尽管良好的心室-动脉耦联一方面可保持血液流通,使血压波动小,从而保护周围器官;另一方面,最佳的心室-动脉耦联使其在增加代谢需求的情况下允许动员心血管储备,但是显著增加的动脉负荷及心室硬度可能导致心脏变时性功能减退,心脏储备功能下降,内皮功能障碍,并可激活神经-内分泌系统,加重心力衰竭[10]。Mentz等[11]指出,即使在没有冠状动脉疾病或高血压的情况下,糖尿病与心肌功能障碍的发展也相关,胰岛素抵抗和高血糖状态导致心肌细胞变性,其机制主要包括游离脂肪酸浓度增加、线粒体功能异常、肾素-血管紧张素-醛固酮系统激活、氧化应激、晚期糖基化终产物生成等,糖尿病和心力衰竭之间的关系是双向的,不仅是糖尿病增加心力衰竭的患病率、住院率及死亡率,心力衰竭亦增加后续糖尿病的风险,但目前心力衰竭对糖尿病发展的影响机制尚不完全清楚,可能涉及交感神经和肾素-血管紧张素-醛固酮系统的激活。
本次研究仅搜集整理了我院2016年度HFpEF患者临床资料,与国外CHARM[11]、DIG(Digitalis Investigation Group)[9]、I-Preserve(Irbesartan in Heart Failure with Preserved Ejection Fraction trial)[4]等大型试验相比,研究样本量较小,搜集的临床资料较少(其他实验室检查项目、合并症等),且仅用1年时间观察临床不良事件的发生情况,但本次研究得出的结果大致与I-Preserve相似。
综上所述,HFpEF合并2型糖尿病更易发生在BMI较高的人群中,且NT-proBNP浓度更高,临床上多伴有高血压、陈旧性心肌梗死,更易出现心脏结构和功能的异常,袢利尿剂、CCB及硝酸酯类药物使用更多,临床心血管结局差。因此,我们需要进一步行相关临床研究来明确糖尿病对HFpEF的不利影响,探明其影响机制,早期干预以提高HFpEF合并糖尿病患者的生活质量及远期生存率。
利益冲突:无