奈达铂分别联合紫杉醇和培美曲塞一线治疗肺腺癌的临床效果比较
李友涛 万仁平 黄淼龙 陈 翀 廖洪亮 陈慧勇 刘文粤 甘 稳
据《2015年中国癌症统计》报道,中国新增癌症患者达430万例,其中肺癌引起的死亡率居第1位[1-2]。由于中国肺癌的致病机制、基层诊疗措施及经济水平等因素的影响,肺癌的早期筛查及诊断模式在中国仍处于发展阶段,绝大多数肺癌患者在确诊时已到达中晚期[3]。因此,肺癌的一线化疗方案的制定尤为重要,特别是针对肺腺癌。本研究针对肺腺癌确诊的晚期患者,采用奈达铂分别联合紫杉醇和培美曲塞的一线化疗方案治疗,比较了2种方案在临床疗效、肿瘤标志物表达变化、不良反应等方面的差异。
1 资料与方法
1.1 纳入及排除标准
本研究为临床试验,纳入标准:a.年龄18~70岁且符合肺腺癌诊断结果的初治患者;b.经影像学检查且存在至少1个可测量的肿瘤病灶;c.患者TNM分期Ⅲb~Ⅳ期,预计生存期超过3个月;d.KPS评分高于80分;e.患者血常规、心、肝、肾功能指标正常,且不存在化疗禁忌证。排除标准:a.年龄低于18岁或者超过70岁;b.已接受过任意药物的化疗方案;c.存在严重的心、肝、肾功能病变者;d.血常规异常患者;e.预计无法耐受化疗药物者;f.预计生存期低于3个月。
1.2 一般资料
自2014年6月至2017年6月,依据纳入及排除标准,符合本研究的入组患者共计60例,其中男性患者41例,女性患者19例。入组患者年龄范围为27~70(51.33±11.34)岁,中位年龄51岁,Ⅲb期患者44例、Ⅳ期患者16例。采用随机分组法原则,由计算机生成数字编码后,随机对入组患者进行分组及方案治疗。本研究共分为A组和B组,每组30例患者。2组患者在各项指标间均不存在统计学差异(P>0.05)(表1)。

表1 2组患者基本指标比较(例,%)
1.3 治疗方案
A组患者采用紫杉醇联合奈达铂化疗方案。患者在化疗前,进行药物预处理。待紫杉醇静脉滴注前1天,静脉滴注地塞米松10 mg+100 ml生理盐水,1次/天(共3次);在化疗方案实施前30 min,给予0.4 g西咪替丁和20 mg苯海拉明肌注注射。化疗方案:第1天静脉滴注175 mg/m2紫杉醇(紫杉醇注射液,深圳万乐药业有限公司,60 mg/支)+500 ml 5%葡萄糖溶液;第1天给予75 mg/m2奈达铂(鲁贝,齐鲁制药股份有限公司,10 mg/支)+500 ml生理盐水。每21天为1个化疗周期。
B组患者采用培美曲塞联合奈达铂化疗方案。同样,患者在化疗前进行药物预处理。患者在化疗前1天给予地塞米松10 mg+100 ml生理盐水静脉滴注,1次/天(共3次);同时,进行维生素B12针(1 mg/支)肌注和叶酸片口服;化疗方案:患者于第1天静脉滴注500 mg/m2培美曲塞二钠(培德,扬子江药业集团,0.1 g/支)+100 ml生理盐水;第1天,给予75 mg/m2奈达铂+500 ml生理盐水静脉滴注。每个入组患者在化疗前均进行常规镇吐、护胃等处理。2种方案的化疗均以21天为1个周期,所有患者化疗时间不少于2个周期。
1.4 随访及疗效评价方式
本研究对入组患者进行了短期随访和长期随访。短期随访主要为在每个化疗周期开始前进行血常规、肿瘤标志物检测,肝、肾功能及心电图的检测;在每个化疗周期结束后到下个化疗周期开始前,依据NCI-NTC V3.0的评价标准,对不良反应进行记录评价。此外,每2个化疗周期进行胸部CT扫描,依据实体瘤疗效评价标准(RECIST),对肿瘤病灶进行评估。长期随访主要为患者化疗结束后随访,包括每月的电话随访及每半年的门诊随访,主要对血清学及胸部CT扫描结果进行评价。患者的最长随访时间为1年1个月。
1.5 统计学分析
采用SPSS 19.0软件对结果数据进行统计分析,其中计量数据采用t检验进行分析,计数数据进行卡方检验(χ2)分析;生存分析采用Kaplan-Meier方法,生存率比较采用Log rank检验。P<0.05为差异存在统计学意义。
2 结果
2.1 2组患者近期疗效评估
2组患者均完成了2个周期以上的有效化疗治疗,平均治疗周期为5.3个周期。经数据记录及分析显示,A组和B组的短期有效率(response rate,RR)分别为43.33%和53.33%。疾病控制率(disease control rate,DCR)分别为80.00%和86.67%。尽管2组在某些指标存在差异,但差异不具有统计学意义(表2)。
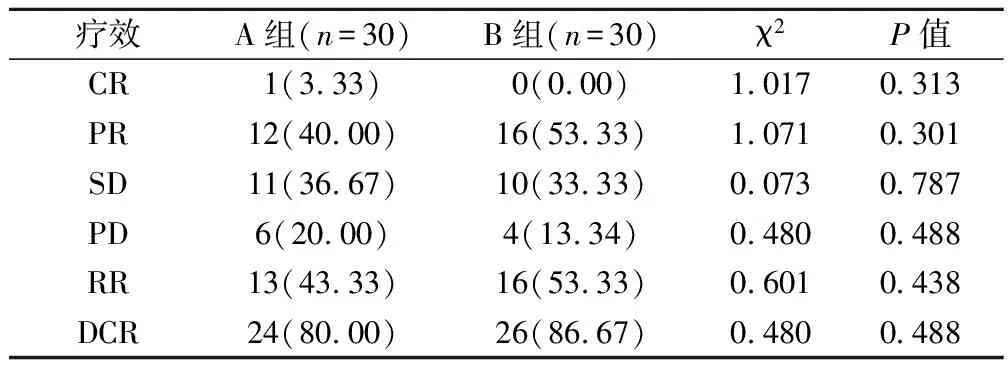
表2 2组患者近期疗效评估(例,%)
2.2 2组患者化疗前后肿瘤标志物变化
本研究,采用化学发光法分别对2组患者治疗前后血液中肿瘤标志物进行了检测,结果显示,相比化疗前,化疗后细胞角蛋白19片段(CYFRA21-1)、癌胚抗原(CEA)及糖类抗原125(CA125)的水平均发生降低,其中B组化疗前后肿瘤标志物降低具有统计学意义(P<0.05)(图1)。

图1 2组患者治疗前后肿瘤标志物变化
2.3 2组患者远期疗效评估
2组患者的最长随访时间为13个月,最短随访时间不到4个月,共存在3例失访患者。待随访结束后,共8例存活患者,其中A组患者中位生存期为10.3个月,B组患者中位生存期为11.7个月。2组患者的1年生存率分别为46.67%(14/30)和53.33%(16/30)。经统计学分析,2组患者在中位生存期和1年生存率上均无统计学差异(P>0.05)。
2.4 2组化疗方案安全性评估
本研究中患者不良反应的指标主要表现为白细胞减少、血小板计数降低、恶心、脱发、乏力、便秘、肌酐升高、肌痛、神经毒性、肝肾功能损害、腹泻、发热。其中,A组患者Ⅲ~Ⅳ级不良反应主要集中在白细胞减少(26.67%)、血小板计数降低(20.00%)、腹泻(3.33%)、脱发(6.67%)、肝肾功能损害(3.33%)和肌痛(26.67%)。B组患者Ⅲ~Ⅳ级不良反应主要集中在白细胞减少(10.00%)、血小板计数降低(6.67%)、恶心(3.33%)、肌痛(6.67%)。相比A组,B组不良反应在白细胞减少、血小板计数降低、脱发方面发生率较低,且存在统计学差异(P<0.05)(表3)。
3 讨论
在我国,肺癌的发生率和死亡率居恶性肿瘤首位,尤其是非小细胞肺癌[4-6]。肺腺癌作为非小细胞癌的一种类型,引起了包括国际肺癌研究学会等机构的高度重视[7-8]。肺癌高死亡率导致了其治疗手段的分期差异性,而早期筛查率低,使得大多肺癌患者确诊后已到达中晚期,失去了最佳的手术治疗时机[3]。2014年,非小细胞肺癌指南强调了首选两药联合的化疗方案在治疗晚期肺癌中的重要性[9]。因此,在化疗方案的同时,寻找高效安全的药物组合方式,成为当前临床研究的方向之一。
早在90年代,奈达铂单药作为第二代铂类抗肿瘤药物,在临床有效率及安全性评估上都高于顺铂[9],其联合用药的临床效果也优于顺铂联合用药,并且既往临床研究报道,奈达铂引起的胃肠道毒性明显较顺铂降低[10-11]。紫杉醇作为一类复杂次生代谢产物,因其抑制微管蛋白解聚及稳定微管蛋白特性,常联合铂类药物用于临床化疗中,并获得了较好的临床应用推广[12]。培美曲塞作为一类抗代谢类抗癌药物,通过抑制一系列的酶促反应,阻断肿瘤细胞核酸的合成,从而杀灭癌细胞。大量临床研究证实,培美曲塞联合铂类在肺癌中的治疗疗效优于部分第三代药物,且其不良反应低的优势使得该药被美国FDA认可作为治疗肺癌的推荐药物[13]。
本研究,采用随机分组法,分别研究了奈达铂联合紫杉醇(A组)和奈达铂联合培美曲塞(B组)在晚期肺腺癌患者中的疗效和安全性。陈琳等的一项临床研究显示,相比紫杉醇联合顺铂,培美曲塞联合顺铂能够获得较高的RR和DCR[14]。余清平等也在研究多西紫杉醇与培美曲塞分别联合顺铂的临床研究中发现,培美曲塞联合顺铂组患者存在较长的无进展生存期[15]。在本研究中,在2组患者基本特征无差异的情况下,A和B组的临床疗效高于之前研究的单药组水平,这表明,培美曲塞或紫杉醇联合奈达铂均获得了良好的临床疗效。
肿瘤标志物的检测能够及时预测癌症患者的病情发展变化,在临床应用中被广泛应用。目前,有关肺癌肿瘤标志物主要集中于CYFRA21-1、CEA、CA125、神经特异性烯醇化酶(NSE)[16]。CYFRA21-1因其较高的敏感性和特异性,成为肺癌检测首选的肿瘤标志物,且研究发现其含量水平与肿瘤组织的生长趋势存在相关性。尽管CEA和CA125的特异性并没有CYFRA21-1高,但介于CEA与非小细胞肺癌的复发的关系及CA125半衰期短及代谢快的特性,被用于肺癌疗效的辅助监测中[17]。之前,大多数肿瘤标志物的研究主要用于区分肺癌的类型和分期[16-17]。本研究中,无论A组还是B组,化疗后CYFRA21-1、CEA和CA125水平均发生下降,但培美曲塞联合奈达铂(B组)的血清肿瘤指标降低的更为显著明显(P<0.05)。这表明,在肿瘤标志物水平上,培美曲塞联合奈达铂的效果要优于紫杉醇联合奈达铂。

表3 2组患者不良反应发生状况/例
化疗不良反应的评估是临床研究中的一项重要指标。通常,奈达铂在肿瘤治疗阶段主要引起血小板和白细胞的降低[11]。紫杉醇通常能够造成恶心、呕吐、白细胞降低及心肝功能损伤[12]。培美曲塞常见的不良反应主要集中在骨髓抑制、胃肠消化道不良反应及乏力[18]。本研究,2组方案均引起了不同程度的不良反应。相比其他研究,在提高了总体有效率的同时,2组方案均增加了Ⅲ~Ⅳ反应在白细胞减少、血小板计数降低和肌痛(26.67%)的出现。在胃肠道副反应方面,尽管培美曲塞联合奈达铂方案存在1例Ⅲ级恶心反应,但2组不良反应发生率并无明显差异(50.00% vs 46.67%)。相比紫杉醇联合奈达铂化疗,培美曲塞联合奈达铂方案在白细胞减少、血小板计数降低、脱发方面发生率较低(P<0.05)。
综上所述,奈达铂分别联合紫杉醇或培美曲塞在晚期肺腺癌患者的临床化疗中,均显示出较好的结果。但是,从肿瘤标志物检测及不良反应等多方面因素考虑,培美曲塞联合奈达铂可能具有更好的临床推广应用价值。

