秀丽隐杆线虫作为病原菌宿主模型的研究概述
鞠守勇,陈其国
(武汉职业技术学院生物工程学院,湖北武汉 430070)
秀丽隐杆线虫(Caenorhabditiselegans)是一种以细菌为食的自由生活的线虫,广泛存在土壤和堆肥中[1]。 1963年Sydney B首次把C.elegans作为模式生物用于研究动物发育和行为的模式动物,现已经发展成为研究动物发育、神经、衰老、毒理学、脂肪沉积和天然免疫等方面重要的模式生物[1]。近些年来,以C.elegans作为病原菌宿主模型来研究病原菌与宿主的相互作用逐渐成为了一个新的热点,C.elegans作为病原菌宿主模型有很多优势,个体小,成虫的长度大约1.5 mm;生长快,3 d~3.5 d就可以长成成虫;繁殖快,成熟的线虫每次可以获得300个~350个子代个体;培养简单,可以直接以要研究的细菌为食物[1];基因组测序已经完成;基因操作系统完善,突变体数量齐备,转基因线虫和RNAi技术成熟;表型易观察等特征[2]。目前,C.elegans作为病原菌宿主模型,在病原菌的致病机制和宿主防御病原菌天然免疫等方面取得了一系列的进展。本文就近些年来利用线虫作为宿主模型,在重要病原菌的致病机制和线虫天然免疫信号通路取得的进展进行综述。
1 以C.elegans为宿主模型研究病原菌致病机制
1999 年,Ausubel F M实验室Tan M W等[3]开创了以铜绿假单胞菌(Pseudomonasaeruginosa,PA)感染C.elegans为模型来研究致病菌的致病机制。目前,以C.elegans为模式宿主进行研究的病原菌有真菌、细菌、病毒等,有50多种(表1)。其中研究较深入的主要是一些人类病原菌,如铜绿假单胞菌(P.aeruginosa)[3]、粪肠球菌(Enterococcusfaecalis)[4]、金黄色葡萄球菌(Staphylococcusaureus)[5-6]、黏质沙雷菌(Serratiamarcescens)[7]、鼠伤寒沙门菌(Salmonellatyphimurium)[8]、鼠疫耶尔森菌(Yersiniapestis)[9]等病原菌,还有一些农业中具有重要应用价值的杀线虫微生物,如厚垣普奇尼亚菌(Pochoniachlamydosporia)、淡紫拟青霉(Paecilomyceslilacinus)[10]、苏云金芽胞杆菌(Bacillusthuringiensis)[11]等。
1.1 铜绿假单胞菌
铜绿假单胞菌(Pseudomonasaeruginosa,PA)在自然界分布广泛,是医院内感染的主要病原菌之一,可以引起术后伤口感染,也可引起褥疮、脓肿、化脓性中耳炎等[3]。1999年Ausubel F M实验室首先以C.elegans作为宿主模型来研究PA的致病机制,近年来研究发现PA杀线虫的机制至少有4种方式。
1.1.1缓慢致死方式PA生长在C.elegans培养基(NGM)中,进入线虫体内后,在肠道里生长繁殖且形成生物膜,当PA在线虫肠道中聚集到线虫难以清除的数量后,PA就会在线虫肠道中大量增生从而缓慢杀死线虫[3]。
1.1.2快速致死方式研究发现,PA在营养丰富的高渗固体培养基中,毒杀线虫的速度大大加快,进一步研究发现,PA在营养丰富培养基中会分泌多种噻吩类物质等小分子毒素,直接快速杀死线虫;PA弱毒菌PAO1在脑心浸液固体培养基中产生小分子氰化氢神经毒素快速杀死线虫[12]。
1.1.3红色死亡方式PA在缺乏磷的培养基中生长过程中,可以通过蛋白PhoB激活其磷酸摄入系统,诱导群体数量感应系统(quorum-sensing pathways),激活PA中的铁载体蛋白,抢夺线虫细胞中的Fe3+导致线虫缺Fe3+死亡,因死亡线虫的咽部和肠道组织内往往观察到红色,这种死亡方式命名为“红色死亡”[13]。
1.1.4液体死亡方式2013年Kirienko N V等[14]在液体环境下用PA毒杀线虫时,发现PA在线虫体内没有进行增殖,也没有激活PA的群体数量信号系统,荧光铁载体多肽和双组份系统也没有被激活,整个PA毒杀过程中也不产生噻吩类化合物;PA在液体环境下作用于线虫的过程中,线虫启动缺氧应答因子HIF-1防御PA, PA在液体中毒杀线虫的具体机制还有待于进一步研究。
PA不但可以产生毒素杀死线虫,而且可以成功躲避线虫天然免疫系统,PA可以通过自身的GacA双组份调控系统和LasR、RhlR群体数量感应系统分泌出一些物质,诱导线虫分泌胰岛素类似蛋白INS-7,INS-7可以与DAF-2受体蛋白结合,从而抑制FOXO转录因子DAF-16进入细胞核中,不能激活免疫防御相关基因thn-2、lys-7和spp-1等,成功定植线虫肠道[15]。
1.2 粪肠球菌
粪肠球菌(Enterococcusfaecalis,Ef)是人体肠胃中的条件性致病菌,严重时可以引起人心脏内膜炎,现已发现对多种药物具有抗性的菌株[16]。Ef杀线虫的主要机制是在线虫的肠道中大量增殖,从而引起肠道肿胀,杀死线虫个体;Ef毒杀线虫的关键致病因子主要是溶细胞素(Cyl),其中群体感应系统fsr/gelE-sprE也参与了对线虫的感染,Ef侵染线虫后,线虫增加体内的活性氧(reactive oxy gen species,ROS)来抵御细菌的感染[4]。
1.3 黏质沙雷菌
黏质沙雷菌(Serratiamarcescens,Sm)是一种广宿主条件致病菌,可以感染植物、无脊椎动物和脊椎动物等,近年来,由于抗生素抗性菌株的出现,Sm对人类健康的威胁越来越严重[7]。以C.elegans为宿主模型研究发现,Sm可以成功逃避线虫口器的咀嚼,定植于线虫肠道,6 d后导致肠道肿胀而死,少量细菌也可以定植于线虫的生殖器[17],后续研究发现,线虫可以大量表达一些类似免疫蛋白抵御Sm,例如TGF-β信号通路调控的溶菌酶、凝集素等[18]。
1.4 金黄色葡萄球菌
金黄色葡萄球菌(Staphylococcusaureus,Sa)可以引起人伤口的严重感染,产生毒素,进入人体肠道后引起肠炎、呕吐、发热、腹泻等症状[19]。Sa可在线虫肠道中聚集,破坏肠道上皮组织,最终导致线虫死亡[20],通过构建Sa的插入突变体,发现Sa毒力调控基因agr和sarA缺失后,对线虫的毒力明显降低,进一步研究表明,毒力调控基调控子和下游基因V8蛋白酶、α-溶血素对Sa感染线虫必须的[19];初期感染的线虫转移到无毒细菌后,线虫可以排出肠道中定植的Sa恢复健康[20];线虫通过β-连环蛋白Bar-1调控下游基因egl-5抵御Sa的侵染[21]。
1.5 苏云金芽胞杆菌
苏云金芽胞杆菌(Bacillusthuringiensis,Bt)典型的特征在芽胞后期形成一种伴胞晶体蛋白(crystal proteins,Cry),大多数晶体蛋白具有毒杀特定的昆虫、线虫等害虫的特点,该特征使Bt广泛用于防治农业害虫、林业害虫、储藏害虫和卫生害虫[22]。2000年美国加州大学Aroian R实验室首先利用C.elegans为宿主模型来研究Bt杀虫机制[23];通过EMS诱变线虫筛选到了对Cry5B有抗性的基因,从而发现了Cry5B在线虫的新受体是无脊椎动物所特有的糖脂,同时也在昆虫中发现糖脂可以与Cry蛋白相互作用[24]。随后发现线虫抵御Cry5B蛋白的多个信号通路,包括P38/MAPK、C-JNK/MAPK信号通路,未折叠蛋白应答(unfolded protein response (UPR) )通路,Daf-2/Daf-16信号通路等[25],同时还发现线虫低氧应答机制(low oxygen response)、囊泡运输修复系统也参与了对Cry5B穿孔毒素的防御[25]。有趣的是含有Cry5B的野生Bt菌株YBT-1518在环境中毒素Cry5B处于沉默状态,当YBT-1518进入到线虫体内后,会大量表达原本沉默的毒素Cry5B,进一步研究发现,新型sRNA BtsR1负调控了Cry5Ba导致其在非宿主环境下沉默,该表型可掩盖Bt的毒性以欺骗线虫的拒食行为,使Bt更易被线虫取食,当Bt被取食进入宿主后该沉默现象解除,Cry5Ba大量表达并迅速杀死线虫,使Bt取得生存优势,该新发现揭示了一种新型的病原菌逃避宿主趋避防御行为的策略[26]。

表1 秀丽隐杆线虫的病原菌
续表1
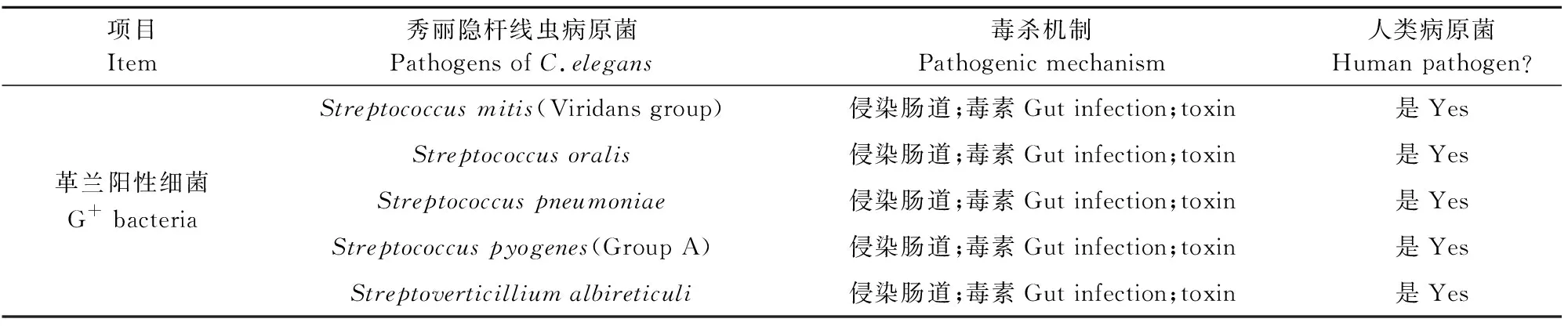
项目 Item秀丽隐杆线虫病原菌Pathogens of C.elegans毒杀机制Pathogenic mechanism人类病原菌Human pathogen? Streptococcus mitis(Viridans group)侵染肠道;毒素Gut infection;toxin是Yes Streptococcus oralis侵染肠道;毒素Gut infection;toxin是Yes 革兰阳性细菌G+ bacteriaStreptococcus pneumoniae侵染肠道;毒素Gut infection;toxin是Yes Streptococcus pyogenes(Group A)侵染肠道;毒素Gut infection;toxin是Yes Streptoverticillium albireticuli侵染肠道;毒素Gut infection;toxin是Yes
2 秀丽隐杆线虫抵御病原菌的天然免疫通路
C.elegans不但是研究病原菌致病机制的理想宿主模型,同时也是研究宿主天然免疫信号通路的理想模型[27]。近几年,利用建立的病原菌C.elegans模型,在C.elegans抵御病原菌的天然免疫信号通路方面取得了一系列的进展, 发现C.elegans主要通过3条天然免疫信号通路抵御病原菌侵染,分别是丝裂原蛋白激酶(MAPK) 信号通路、DAF-2/DAF-16 信号通路和TGF-β信号通路 (图1)。

图1 C.elegans主要的三条天然免疫信号通路
2.1 丝裂原蛋白激酶信号通路
丝裂原蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在动物和植物中极其保守,也是线虫中研究较深入的天然免疫信号通路。该通路包含三条不同激酶信号传导方式,即细胞因子抑制的抗炎药物结合蛋白激酶 (cytokine-suppressive anti-inflammatory drug-binding protein kinase)P38/MAPK、细胞外调节激酶(extracellular regulation kinase)ERK/MAPK、氨基末端激酶(c-jun N-terminal kinase)C-JNK/MAPK。在研究PA的致病机制时,发现P38/MAPK信号通路突变体更加容易导致线虫致死,对PA表现为敏感。ERK/MAPK可以抵御革兰阳性细菌细小棒状杆菌、苏云金芽胞杆菌等,C-JNK/MAPK对苏云金芽胞杆菌中的Cry蛋白有防御作用[28]。
2.2 类胰岛素受体/DAF-2/DAF-16信号通路
类胰岛素受体(insulin-like)/DAF-2/DAF-16信号通路是在研究线虫寿命中发现的,DAF-2的缺失突变体比正常的线虫寿命更长,Daf-2蛋白与胰岛素受体相似,通过调节线虫体内FOXO家族转录因子DAF-16的细胞核定位参与线虫的天然免疫、调节线虫的寿命、应激以及线虫休眠状态(Dauer)的启动等[29];Daf-2蛋白受体活化后会使DAF-16保留在细胞质中,当有拮抗剂INS-1与Daf-2结合(或Daf-2功能缺失)等情况下,DAF-16不能被磷酸化就会进入到细胞核中,并且激活一系列免疫、寿命相关基因的表达[29]。正向遗传学的研究发现Daf-2下游通过age-1/aap-1编码的磷脂酰肌醇3激酶(PI3K)激活丝氨酸/苏氨酸激酶(例如PDK-1、SGK -1、AKT-1、AKT-2等),使转录因子DAF-16磷酸化,阻止其从胞质转入核内,抑制一系列基因的转录,其中在此通路上的任何缺失都会使转录因子DAF-16不能被磷酸化,使DAF-16从胞质转入核内,发挥转录功能[29]。Daf-2突变体对多种不同的病原菌均表现出抗性,研究发现DAF-16转移到细胞核中后启动了多种抗菌基因的表达[30]。大多数p38/MAPK通路下游的病原菌诱导的免疫基因是由DAF-16/FOXO阻遏的[29]。另外,研究表明DAF-16的核定位调节参与多种反应基因,因此DAF-2/DAF-16通路可能仅仅是一个应激反应的而不是一个特定的免疫应答[30]。
2.3 转化生长因子信号通路
该通路参与到线虫的生长发育,研究发现,转化生长因子(transforming growth factor-β,TGF-β)信号通路参与了线虫抵御黏质沙雷菌和铜绿假单胞菌的侵染[2]。TGF-β 受体具有蛋白丝氨酸激酶催化结构域,TGF-β受体激活后可催化转录因子Smad发生丝氨酸磷酸化,磷酸化的Smad 子形成同源寡聚体或异源寡聚体后,进入细胞核调节相应基因的转录速度[2]。TGF-β通路调控多个免疫相关的基因:溶菌酶基因(如lys-1、lys-7、lys-8)、凝集素基因、神经细胞分泌蛋白DBL-1基因(dbl-1)等,这些基因表达产物由肠上皮细胞分泌进入肠腔发挥作用[2]。
2.4 其他防御反应
除了以上的3个重要的天然免疫信号通路,还发现线虫的损伤相关分子模式(damage associated molecular patterns,DAMPs)可以激活线虫免疫反应,DAMPs指宿主自身细胞被病原菌破坏从而释放内源性分子,即内源性危险信号,从而启动自身的免疫防御机制[30-31]。近几年来发现的线虫防御病原菌的DAMPs主要用细胞内线粒体监视通路(mitochondrial surveillance pathway)[31]、内质网未折叠蛋白应答(unfolded protein response,UPR)通路和自噬(autophagy)等[32]。随着研究的深入,发现一些转录因子也参与线虫防御病原菌的反应,例如BAR1/βcatenin、EGL5 、bZIP转录因子zip2、FSHR1[33]等。
3 小结与展望
C.elegans具有个体小,生长快,培养简单,基因操作手段成熟,特别是具有海量的突变体库,表型易观察等特征,自从1999年开始以C.elegans为宿主模型来研究PA与宿主的相互作用以来,已经在病原菌致病分子机制和宿主防御病原菌天然免疫方面取得了不错进展。同时,这个领域的研究还处于刚刚起步阶段,今后一段时期,C.elegans将在病原菌与宿主相互作用的众多领域发挥重要作用,例如,发现各种病原菌的毒素及毒力因子,寻找病原菌毒素受体,宿主防御病原菌的天然免疫信号通路及宿主识别病原菌机制等方面,这些相应分子机制的揭示有助于更好的预防和治疗病原菌引起的人畜传染病。

